какие симптомы при онкологии брюшной полости
Рак желудка
Рак желудка представляет собой злокачественное поражение эпителия слизистой оболочки органа. По статистике, рак желудка находится в пятерке «лидеров» среди всех онкологических заболеваний по частоте возникновения и занимает второе место по частоте смертельных исходов.
В большинстве случаев столь плачевная статистика связана со сложностями ранней диагностики.
Что такое рак желудка?
Рак желудка — это злокачественная опухоль, формирующаяся из клеток слизистой оболочки органа.
Несмотря на распространенность этого типа новообразований, каждый случай требует индивидуального подхода и разработки стратегии диагностики, лечения, а также тщательного стадирования. По мере развития, новообразование прорастает стенку желудка, может распространяться на соседние органы, метастазировать в отдаленные внутренние органы
Характерные черты заболевания
Рак желудка имеет ряд специфических черт:
Причины рака желудка
Среди причин рака желудка называют:
Виды рака желудка
В подавляющем большинстве, около 90% всех клинических случаев, речь идет об аденокарциноме.
Помимо аденокарциномы выделяют и другие виды опухоли желудка:
По формам роста выделяют:
Исходя из расположения, могут быть:
Симптомы и первые признаки
Первые признаки рака желудка неспецифичны. Их можно запросто пропустить, списав на гастрит и другие распространенные патологии. Однако именно на них следует обратить пристальное внимание и самостоятельно отправиться к врачу. Что же это за симптомы:
Отличить признаки рака желудка не просто. Точку в вопросе ставят диагностические мероприятия.
На развитых стадиях заболевания наблюдаются следующие симптомы опухоли желудка:
Как выглядит рак желудка?
На представленном фото рака желудка представлен внешний вид опухоли по стадиям развития.
Диагностика
Диагностика необходима, чтобы ответить на следующие вопросы:
Диагностика включает в себя два типа исследований: Выявление опухоли и оценку степени распространения опухолевого процесса для выработки оптимальной тактики лечения.
Методы диагностики
Оценка общего состояния здоровья больного.
Диагноз «рак желудка» выставляется только после полного обследования, в том числе обязательного гистологического исследования.
Методы лечения
Возможны следующие методы лечения рака желудка:
Операция может производиться классическим либо лапароскопическим способами. В ходе хирургического вмешательства может быть удалена часть желудка или весь желудок, части окружающих органов, лимфоузлы и т.д. Все зависит от размера новообразования и его распространенности на другие органы.
Также может применяться в качестве паллиативной меры химиотерапия.
Прогноз рака желудка
Выживаемость зависит от степени распространения опухолевого процесса и общего состояния больного. В целом, можно представить следующие цифры прогноза при раке желудка:
Противопоказания при лечении рака желудка
Существует несколько противопоказаний для оперативного вмешательства:
В первом случае при переходе основных заболеваний в фазу компенсации возможно поставить вопрос о возможности хирургического лечения.
Лечение после операции
Профилактика рака желудка
Профилактика предполагает изменение рациона. В нем должно быть больше растительной пищи. Не стоит злоупотреблять копчеными, жареными и жирными продуктами. Они обладают канцерогенными свойствами. Также нельзя переедать. На алиментарные причины приходится порядка 35% всех случаев возникновения рака.
Необходимо отказаться от злоупотребления алкоголем, курения. Также важно своевременно лечить воспалительные заболевания желудка, такие как гастрит. Хронический воспалительный процесс — это благодатная почва для развития рака желудка.
Видео: Боль под ложечкой — что делать? Жить здорово!
Онкологические заболевания органов ЖКТ
Онкологические заболевания пищеварительного тракта – это общий термин для целой группы раковых поражений органов желудочно-кишечного тракта. В структуре заболеваемости онкология ЖКТ занимают лидирующие позиции, одинаково часто болеют как мужчины, так и женщины, преимущественно среднего и преклонного возраста.
Акции
Оперативные вмешательства со скидкой 7%.
Онкоконсилиум может потребоваться как при лечении в «СМ-Клиника», так и пациентам других медицинских учреждений с целью получения альтернативного мнения.
«СМ-Клиника» предоставляет своим пациентам предоперационное обследование со скидкой до 72%!
Консультация врача-хирурга по поводу операции бесплатно!
Содержание статьи:
Рак пищеварительной системы включает в себя опухолевые образования:
В эту группу также относятся стромальные и эндокринно-активные (гормональные) опухоли тканей, образующих пищеварительную систему.
Общие сведения
Рак пищеварительной системы – это злокачественные поражения пищеварительной трубки, а также желез, участвующих в процессе переваривания пищи. Этот вид онкологии опасен тем, что длительное время может никак себя не проявлять, повреждает большой объем тканей и способен к метастазированию в соседние и отдаленные органы. Раковые опухоли имеют разные размеры и локализацию, гистологический тип и форму, но приводят к нарушению работы ЖКТ и формированию осложнений.
В сравнении с другими типами рака выживаемость в течение 5 лет при поражениях ЖКТ ниже. Если это опухоли желудка, она составляет до 30 %, для поражений кишечника – около 68 %. При раке поджелудочной железы после установления диагноза только 9 % людей живут более 5 лет. Летальность от рака пищеварительной системы вдвое превышает гибель от рака молочной железы и простаты вместе взятых. Источник:
Е.М. Аксель
Статистика злокачественных
новообразований желудочно-кишечного тракта //
Сибирский онкологический журнал, 2017, №16(3), с.5-11
Проблема еще и в лечении данного типа рака. Обычно требуется комбинированный подход с удалением опухоли, а также лучевыми и химиотерапевтическими методами. Это достаточно тяжело для организма, поэтому нужно подбирать терапию индивидуально и тщательно, с учетом стадии и локализации рака.
Причины рака ЖКТ
Опухоли пищеварительной системы – достаточно разнородна группа рака. На сегодняшний день не выявлено единой конкретной причины, которая бы провоцировала рост злокачественных онкологических заболеваний желудочно-кишечного тракта. Выделяют влияние негативных внешних факторов в сочетании с генетической предрасположенностью человека к развитию раковых опухолей. Эти сочетания провоцируют трансформацию здоровых клеток пищеварительной системы в неопластические, которые дают начало раковой опухоли.
Общие факторы риска рака ЖКТ актуальны для большинства опухолей. К ним относятся:
Для некоторых видов рака типичны и свои дополнительные провоцирующие факторы. Например, для рака желудка типично присутствие в слизистой органа Helicobacter pylori, кислотоустойчивых бактерий, повреждающих клетки. Для рака пищевода одним из провоцирующих факторов становится рефлюксная болезнь – постоянный заброс кислоты из желудка приводит к метаплазии эпителия и инициации рака. Для рака кишечника типичны длительные эпизоды интоксикаций на производстве и в быту. Также провокаторами рака толстой кишки могут стать язвенный колит и полипоз кишечника, пернициозная анемия.
Первые признаки, клинические симптомы
Для многих видов онкологии желудочно-кишечного тракта имеется рад специфичных признаков, отражающий нарушение функции. Общими характеристиками всех видов рака пищеварительных органов является их длительное, бессимптомное течение, на ранних стадиях пациенты не имеют жалоб, или жалобы носят общий характер. Серьезные проявления возникают, когда опухоли достигают больших размеров, разрушают стенку кишки, прорастают в соседние ткани, сдавливают протоки желез. Среди общих признаков выделяют:
Обычно симптомы онкологических заболеваний ЖКТ возникают при наличии раковых опухолей большого размера, если они давят на кишку, печень или соседние органы брюшной полости. Возникает:
При поражении желудка типична кровавая рвота, анемия, черный стул. При поражении печени – желтуха, кожный зуд, обесцвечивание кала, чередование поносов и запоров, метеоризм.
Виды рака ЖКТ
Раковые опухоли ЖКТ дифференцируют в зависимости от локализации. К ним относятся опухолевые поражения:
По форме раковой опухоли, с учетом ее внешнего вида, роста и состава клеток, выделяют несколько типов поражений:
По строению клеток, образующих раковые опухоли, выделяется несколько вариантов онкологии. На основе этих данных врач определяет агрессивность течения и прогнозы заболевания.
Методы диагностики
Для выявления рака пищеварительного тракта используются лабораторные тесты и инструментальная диагностика. Во многом план обследования зависит от локализации, размеров и типа рака. У большинства опухолей ЖКТ не имеется специфических онкомаркеров, выявляющих рак на ранней стадии, поэтому врач учитывает первые признаки у взрослых, типичные жалобы и данные, полученные при визуализации.
Обычно опухоли впервые обнаруживают при эндоскопическом исследовании (фиброгастроскопия, колоноскопия, ректороманоскопия), дополняя исследование забором биопсии подозрительного участка с проведением гистологических, генетических и гистохимических тестов.
Также показано проведение ультразвуковой диагностики для определения размеров опухоли, ее локализации и границ, выполняется КТ или МРТ, рентгенография. Общее состояние пациента определяют по данным исследований крови и мочи. Источник:
Л.А. Митина, В.М. Хомяков, С. О. Степанов
Общие принципы ультразвуковой
диагностики опухолей пищевода,
желудка и толстой кишки //
Российский онкологический журнал, 2012, №1, с.28-31
Лечение опухолей ЖКТ
Ведущий метод терапии при раке желудочно-кишечного тракта – это хирургическое удаление опухоли или ее части. Если рак выявлен в поздней стадии, определяются метастазы в отдаленные органы или прорастание в соседние ткани, опухоль неоперабельная или состояние пациента не дает возможности на радикальное вмешательство, применяют другие методики, включая паллиативную и симптоматическую терапию.
При операции хирурги удаляют все пораженные раком ткани с захватом некоторых здоровых участков, если есть метастазы, удаляют также близлежащие лимфоузлы. Это важно для предотвращения рецидивов. После операции проводится реабилитация, могут быть назначены дополнительные курсы терапии.
Лучевая терапия может быть дополнительным методом, проводится до операции с целью уменьшения размеров опухоли, или после нее – для подавления роста оставшихся клеток. Источник:
В.Ю. Скоропад, Б.А. Бердов, Л.В. Евдокимов, Л.Н. Титова
Интраоперационная лучевая терапия — инновационная
технология в комбинированном лечении опухолей
желудочно-кишечного тракта //
Поволжский онкологический вестник, 2013, №1, с.4-10
Может применяться химиотерапия (введение препаратов, подавляющих рост рака) для уничтожения раковых клеток до и после операции, а при неоперабельном раке в качестве паллиативного лечения.
Прогнозы при раке ЖКТ
Во многом прогнозы для жизни и здоровья зависят от типа опухолевых клеток, стадии выявления и особенностей лечения, возраста пациента и имеющихся у него сопутствующих патологий.
Самый неблагоприятный прогноз – при раке поджелудочной железы, самый оптимистичный – для нейроэндокринных опухолей кишечной стенки. Процент выживаемости в течение 5 лет колеблется от 5 до 90 % в зависимости от вида рака. На начальных стадиях, когда нет метастазов, шансы на успех достигают 80-90 %, в терминальных стадиях не превышают 10 %.
Канцероматоз брюшины: кому и зачем нужны циторедуктивная операция и HIPEC
Злокачественные опухоли могут метастазировать — распространяться на другие ткани и органы. Если первичная опухоль расположена в брюшной полости, она может распространиться по брюшине — это состояние называется перитонеальным канцероматозом. Такой вариант течения болезни значительно ухудшает прогноз — в среднем, в зависимости от вида опухоли и полученного лечения продолжительность жизни человека составляет от полугода до двух лет. Долгое время пациентам с канцероматозом брюшины могли предложить только паллиативную помощь, но появились и другие методы.
Рассказываем о циторедуктивной операции и гипертермической внутрибрюшинной химиотерапии (HIPEC), которые могут продлить жизнь людям с таким диагнозом.
Этот текст мы написали вместе с Онкоцентром «СМ-Клиника».
Что такое перитонеальный канцероматоз?
Брюшина — оболочка, выстилающая стенки брюшной полости, таза и поверхность внутренних органов — печени, матки, яичников, селезенки, кишечника. Любой патологический процесс, затрагивающий брюшную полость, может распространяться по брюшине за счет движения жидкости и клеток в этом пространстве. Например, эпителиальные опухоли яичников возникают из эпителия маточных труб, который сообщается с брюшиной. Из-за роста опухоли злокачественные клетки «отслаиваются» и могут свободно плавать в перитонеальной жидкости. Как правило, эти клетки имплантируются в область таза и другие части брюшины.
Канцероматоз выглядит как множество опухолевых узлов, покрывающих брюшину. Размер и количество узлов могут быть различными.
При каких опухолях чаще всего развивается канцероматоз брюшины?
Перитонеальный канцероматоз у женщин чаще всего развивается при раке яичников, а у мужчин — при раке толстой кишки и желудка. Например, при раке желудка опухолевые узлы на брюшине возникают у 60% пациентов.
В более редких случаях канцероматоз брюшины может быть самостоятельным заболеванием. Иногда расположение первичной опухоли установить не получается.
Какие симптомы могут указать на перитонеальный канцероматоз?
У этого состояния неспецифические признаки. Среди них:
— увеличение объема живота из-за скопления жидкости в брюшной полости — асцит
— тошнота, вздутие живота
— необъяснимая потеря веса
Злокачественный (то есть вызванный опухолью) асцит, в свою очередь, может вызывать другие симптомы, среди которых:
Перитонеальный канцероматоз может вызывать кишечную непроходимость. В этом случае продвижение содержимого желудка и кишечника через ЖКТ затруднено или отсутствует. Злокачественная кишечная непроходимость чаще встречается у пациентов с раком яичников и колоректальным раком.
Как диагностируют канцероматоз брюшины?
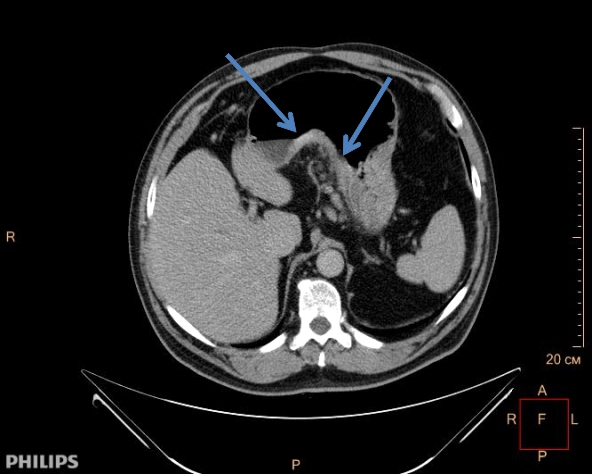
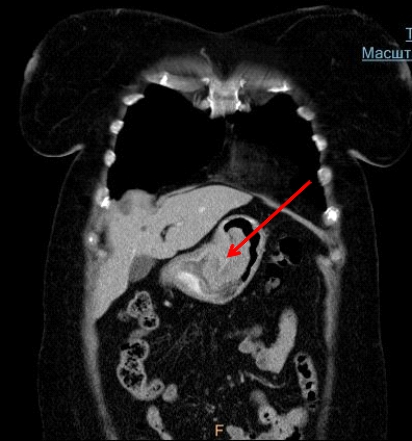
Заподозрить перитонеальный канцероматоз можно с помощью УЗИ, КТ и МРТ брюшной полости и малого таза.
В частности, КТ брюшной полости позволяет приблизительно оценить, насколько опухоль распространена. МРТ будет эффективнее для осмотра малого таза и позволит врачу оценить степень поражения находящихся там органов, например матки, мочевого пузыря.
Однако эти методы позволяют обнаружить только крупные очаги — опухолевые узлы до 5 мм редко отчетливо видны во время УЗИ, КТ и МРТ. Наибольшей точностью обладает лапароскопия: через прокол врач вводит в брюшную полость камеру, осматривает брюшину и, если необходимо, проводит биопсию — забирает часть опухоли на исследование.
Почему канцероматоз брюшины сложно лечить?
«Традиционные» методы лечения онкологических заболеваний — лучевая терапия, операция — не эффективны в случае с канцероматозом брюшины. Облучать такую большую область слишком опасно. Не все опухолевые очаги можно удалить хирургическим путем — метастазы могут быть очень маленького размера, незаметными для врача, или располагаться в труднодоступном месте. Оставшиеся опухолевые клетки спровоцируют рецидив заболевания.
Стандарты лечения канцероматоза брюшной полости включают системную химиотерапию, облегчение симптомов. В последние годы в списке методов появились циторедуктивная операция и HIPEC — гипертермическая внутрибрюшинная химиотерапия.
Что такое циторедуктивная операция и HIPEC?
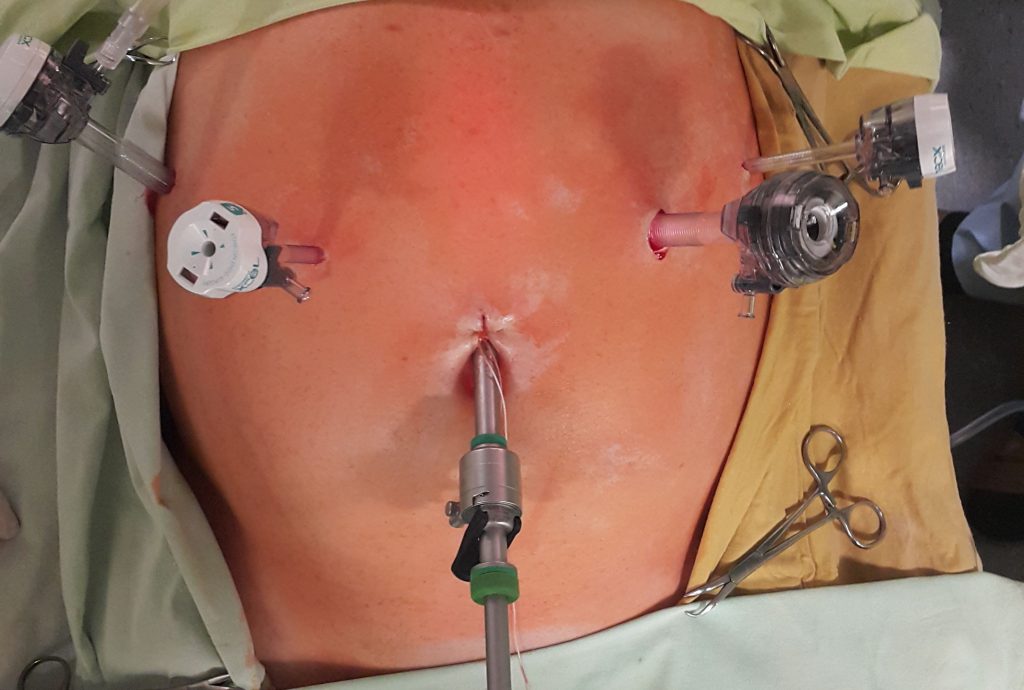
Для этого брюшную полость пациента промывают нагретым до 42°C градусов раствором химиопрепаратов. В брюшную полость устанавливают катетеры, через которые в организм пациента попадает раствор. Такой способ введения позволяет охватить все отделы брюшной полости. Для отслеживания температуры в брюшную полость помещают датчики.
Местное, а не системное (внутривенное) применение цитостатиков позволяет увеличить дозу препаратов и при этом избежать побочных явлений. Высокая температура в сочетании высокими дозами химиотерапии усиливают противоопухолевый эффект.
Спустя примерно час–полтора раствор удаляют из брюшной полости, промывают ее физраствором и зашивают. В общей сложности такое вмешательство занимает 8–10 часов.
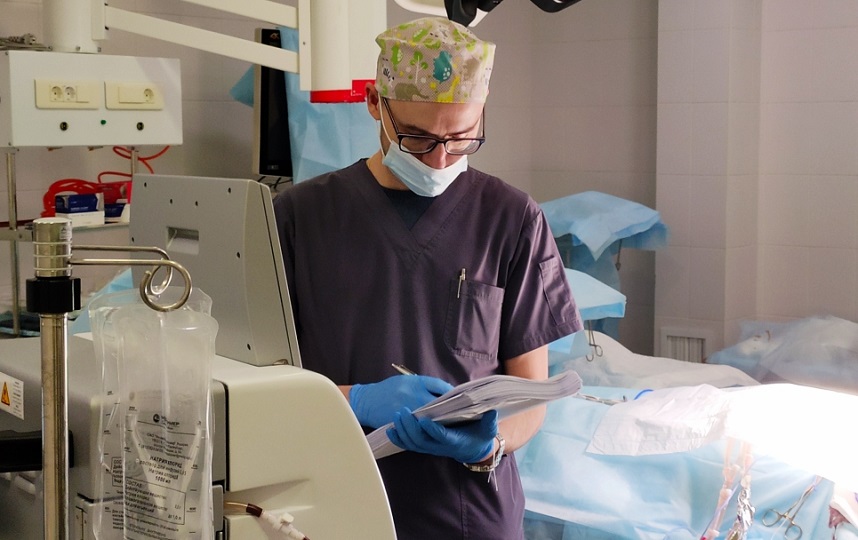 |
Техник наблюдает за процессом HIPEC-терапии
Кому может подойти такой метод лечения?
Отдельные исследования и мета-анализы демонстрируют эффективность этого метода — циторедуктивная операция в сочетании с гипертермической внутрибрюшинной химиотерапией увеличивает продолжительность жизни пациентов с перитонеальным канцероматозом. Например, в этом исследовании приняли участие пациентки с III стадией эпителиального рака яичников. Авторы приходят к выводу, что добавление гипертермической внутрибрюшинной химиотерапии к циторедуктивной операции увеличивает период без прогрессирования заболевания, общую продолжительность жизни и не повышает количество побочных эффектов по сравнению с циторедуктивной операцией.
Эта лечебная опция считается оптимальным вариантом лечения пациентов с опухолями аппендикса и псевдомиксомами брюшины.
Предполагается также, что профилактическое применение HIPEC может снизить риск развития канцероматоза брюшины в будущем. Не так давно появились данные о положительных результатах профилактического применения HIPEC при раке ободочной кишки, желудка и поджелудочной железы.
Кому циторедуктивная операция и HIPEC не подходят?
Необходимость таких вмешательств определяется исходя из истории болезни, тщательного обследования и общего состояния пациента. Циторедуктивную операцию в сочетании с HIPEC могут не провести, если:
— метастазы вышли за пределы брюшины
— заболевание прогрессирует несмотря на проведенную ранее химиотерапию
— есть кишечная непроходимость, вызванная опухолью
— общее состояние пациента тяжелое
— есть высокая опухолевая нагрузка — опухолевые импланты покрывают значительную часть толстой и тонкой кишки
В целом, исследования, оценивающие эффективность метода, как правило, основаны на результатах нерандомизированных испытаний.
Безопасность процедуры пока изучается. Например, авторы этого исследования пришли к выводу, что циторедуктивная операция в сочетании с HIPEC безопасна и чаще даже безопаснее в сравнении с другими широко распространенными онкологическими процедурами, в частности, операцией Уиппла (способ лечения рака поджелудочной железы — прим. ред.). Однако и сами авторы, и их коллеги отмечают, что у исследования есть недостатки, прежде всего, касающиеся выбора пациентов. У людей с раком поджелудочной железы в большинстве случаев нет других альтернатив, кроме операции Уиппла, а пациенту с перитонеальным канцероматозом можно предложить несколько вариантов: паллиативную терапию, циторедуктивную операцию без HIPEC, — чтобы выбрать оптимальный в конкретном случае способ лечения.
Кроме того, не существует единых протоколов, регламентирующих такое лечение: во время HIPEC могут использоваться различные химиопрепараты, температура, время промывания брюшной полости.
Таким образом, окончательное решение о выборе стратегии лечения пациент и врач должны принять, взвесив все «за» и «против».
Проконсультировать по вопросам назначения циторедуктивной операции в сочетании с HIPEC смогут специалисты Онкоцентра «СМ-Клиника». Врачи Онкоцентра оказывают различные виды помощи пациентам с онкологическими заболеваниями, в том числе проводят циторедуктивные операции с последующей процедурой HIPEC.
Перитонеальный канцероматоз
Перитонеальный канцероматоз
Вам поставили диагноз: перитонеальный канцероматоз (опухоль брюшины)
Предлагаем Вашему вниманию краткий, но очень подробный обзор перитонеального канцероматоза.
Филиалы и отделения, где лечат перитонеальный канцероматоз
МНИОИ им. П.А. Герцена – филиал ФГБУ «НМИЦ радиологии» Минздрава России.
Национальный центр лечения больных канцероматозом
МНИОИ имени П.А. Герцена – филиал ФГБУ «НМИЦ радиологии» Минздрава России
Руководитель Центра к.м.н. Владимир Михайлович Хомяков – 8 495 150 11 22
Введение
Причины возникновения перитонеального канцероматоза
Развитие перитонеального канцероматоза является поэтапным процессом. Первый этап – распространение опухолевых клеток из первичного очага поражения. Это связано с нарушением межклеточного взаимодействия и приобретением клетками опухоли подвижности. При этом эпителиальные клетки меняют фенотип на мезенхимальный, происходит деградация межклеточного матрикса. Распространение опухолевых клеток может происходить в ходе оперативного вмешательства. Их механическое отделение возможно при повреждении лимфатических или кровеносных сосудов. Попавшие в брюшную полость клетки опухоли мигрируют под действием силы тяжести, сокращений внутренних органов, имплантируются в местах повышенной резорбции: большом сальнике, в области слепой кишки, дугласовых карманах.
На втором этапе опухолевые клетки взаимодействуют с мезотелием брюшины. Механизмы адгезии определяются природой клеток, особенностями морфологии брюшины, а также наличием участков ее повреждения. Далее клетки закрепляются в мезотелии, происходит их горизонтальное распространение по поверхности перитонеума, а затем инвазивный рост – прорастание в базальную мембрану, соединительную ткань. Следующим этапом является стимуляция неоангиогенеза – обязательного фактора развития опухоли. Морфопатогенетические механизмы формирования канцероматоза брюшины еще недостаточно изучены, в связи с чем отсутствуют радикальные методы лечения.
Частота развития канцероматоза брюшины зависит не только от первичной локализации опухоли, но и от ее размеров, глубины инвазии, гистотипа, степени дифференцировки (недифференцированный рак желудка осложняется поражением брюшины в 60% случаев, ограниченный – в 15%).
Классификация перитонельного канцероматоза
Единая классификация данного заболевания отсутствует, поскольку характеристики первичных опухолей, приводящих к поражению брюшины, весьма разнообразны. Наиболее распространена классификация перитонеального канцероматоза брюшины в зависимости от числа, локализации метастазов, которая предусматривает три степени:
Р1 – локальное поражение брюшины
Р2 – несколько областей канцероматоза, разделенных здоровыми участками брюшины
Р3 – многочисленные очаги поражения
Также используется метод определения индекса канцероматоза брюшины: суммируются баллы измерения максимальных очагов поражения (0-3 балла) в каждой из 13 наиболее вероятных областей поражения брюшины.
Симптомы перитонеального канцероматоза
Перитонеальный канцероматоз брюшины является вторичным поражением, поэтому его клиническая картина во многом определяется проявлениями первичной опухоли. Характерным признаком является обильный выпот в брюшную полость – формирование асцита. Зачастую асцитический синдром, развивающийся вследствие обструкции лимфатического дренажа, является единственным признаком заболевания, и пациенты могут поступать в отделение гастроэнтерологии или терапии для диагностики причин асцита. Состояние больных тяжелое, характерна значительная потеря веса. Неспецифическими признаками являются тошнота, рвота, выраженная слабость, утомляемость. При наличии крупных метастазов возможно их прощупывание через брюшную стенку.
Диагностика перитонеального канцероматоза
Перитонельный канцероматоз имеет неспецифическую клиническую картину, однако консультация гастроэнтеролога или онколога позволяет предположить данное заболевание на основании симптомов и физикальных данных. Лабораторные анализы не выявляют специфических изменений: определяется лейкоцитоз, ускорение СОЭ. Диагностическая программа обязательно должна включать УЗИ органов брюшной полости и малого таза, позволяющее обнаружить распространенное поражение, а также МСКТ брюшной полости с контрастированием. Обязательно проводится цитологическое исследование асцитической жидкости, полученной при лапароцентезе, которое дает возможность впервые установить или подтвердить диагноз, а также определить гистогенез клеток опухоли.
Информативным методом диагностики перитонеального канцероматоза является лапароскопия с осмотром перитонеума, дугласова пространства, диафрагмы, сопровождающаяся биопсией. Высокой специфичностью обладает обратнотранскриптазная полимеразная цепная реакция (ОТ-ПЦР), которая позволяет определить источник диссеминации даже при малом количестве опухолевых клеток.
Сложности диагностики возникают при наличии перитонеального канцероматоза без выявленного первичного очага. Данная форма заболевания, встречающаяся в 3-5 % случаев, проявляется клинически только при уже сформировавшемся поражении брюшины. При этом первичный очаг может иметь настолько малые размеры, что его прижизненное обнаружение невозможно.
В качестве дополнительных методов может использоваться определение онкомаркеров (кислой фосфатазы, раково-эмбрионального антигена, альфа-фетопротеина, бета-субъединицы ХГЧ). Такая диагностика не обладает высокой специфичностью, но применяется для оценки прогноза, раннего выявления диссеминации, рецидивов, а также для контроля эффективности лечения.
Лечение перитонеального канцероматоза
Хирургическое лечение канцероматоза включает удаление первичной опухоли с регионарными метастазами и отсевами по брюшине. Циторедуктивная операция выполняется в объеме перитонэктомии, может сочетаться с удалением матки и придатков, сигмовидной кишки, желчного пузыря. После проведения операции оценивается индекс полноты циторедукции: СС-0: после проведения хирургического лечения очаги поражения визуально не определяются; СС-1: имеются неудаленные очаги диаметром до 2,5 мм; СС-2: очаги диаметром 2,5 мм – 2,5 см; СС-3: очаги поражения более 2,5 см в диаметре. Однако даже при определении индекса СС-0 нельзя полностью исключить возможность диссеминации, поэтому обязательно проводится химиотерапия.
Эффективные подходы к лечению, как правило, подразумевают проведение комбинированной терапии, например, сочетания хирургического вмешательства и системной химиотерапии. Одним из наиболее эффективных методов является локальная химиотерапия. Идея локальной химиотерапии состоит в том, чтобы обеспечить доставку лекарственного препарата непосредственно к опухолевым клеткам, находящимся на внутренней выстилке анатомической полости. Из-за крайне низкой проницаемости этой области для лекарственных препаратов, например, при внутривенном их введении или приеме в виде таблеток, доставка препаратов в виде аэрозоля под давлением углекислого газа даёт накопление препарата в опухоли в значительно больших концентрациях.
Методы лечения перитонеального канцероматоза
Длительное время канцероматоз брюшины и плевры считали терминальной стадией болезни, не подлежащей специальному лечению. Разработка методик непосредственного воздействия на брюшину и плевру позволила улучшить прогноз при этом состоянии. МНИОИ им. П.А. Герцена обладает уникальными возможностями лечения больных с канцероматозом, имея в арсенале весь комплекс новейших методов терапии.
Гипертермическая интраоперационная внутрибрюшная (внутриплевральная) химиотерапия (HITEC).
Это методика, при которой во время операции в брюшную или плевральную полость вводится подогретый до 42,5С, высококонцентрированный раствор химиотерапевтических препаратов, что обеспечивает их воздействие непосредственно на раковые клетки в брюшной (плевральной) полости при минимальном воздействии на другие органы. Сеанс проводится в течение часа, что позволяет разрушить опухолевые клетки, оставшиеся после так называемой циторедуктивной операции.
Внутрибрюшная (внутриплевральная) аэрозольная химиотерапия под давлением (PIРAC)
Это новейший инновационный метод лечения перитонеального канцероматоза, который обеспечивает доставку лекарственного препарата непосредственно к опухолевым клеткам, находящимся на внутренней выстилке анатомической полости. Метод совсем недавно появился в России. Процедуру проводят посредством лапароскопии (торакоскопии). В брюшной или плевральной полости под давлением углекислого газа распыляют аэрозоль химиопрепаратов и оставляют в течение 30 мин. При таком способе введения химиопрепаратов их воздействие на опухоль многократно возрастает при полном отсутствии системной токсичности. Ноу-хау МНИОИ имени П.А. Герцена в этом методе лечения стала разработка собственной специальной форсунки, которая формирует поток мелкодисперсного аэрозоля с размером капель от 1 до 40 мкм. Изделие выполнено из специализированных материалов и не уступает по качеству импортному аналогу, а по ряду технических характеристик его превосходит.