какие соединения образует сера
Какие соединения образует сера
Основное и возбужденное состояние атома серы
Электроны s- и p-подуровня способны распариваться и переходить на d-подуровень. Как и всегда, количество валентных электронов отражает количество возможных связей у атома.
В разных электронных конфигурациях сера способна принимать валентности: II, IV и VI.
Природные соединения
В местах вулканической активности встречаются залежи самородной серы.
В промышленности серу получают из природного газа, который содержит газообразные соединения серы: H2S, SO2.
Серу можно получить разложением пирита
В лабораторных условиях серу можно получить слив растворы двух кислот: серной и сероводородной.
При нагревании сера бурно взаимодействует со многими металлами с образованием сульфидов.
При взаимодействии с концентрированными кислотами (при длительном нагревании) сера окисляется до сернистого газа или серной кислоты.
Сера вступает в реакции диспропорционирования с щелочами.
Сера вступает в реакции с солями. Например, в кипящем водном растворе сера может реагировать с сульфитами с образованием тиосульфатов.
Бесцветный газ с характерным запахом тухлых яиц. Огнеопасен. Используется в химической промышленности и в лечебных целях (сероводородные ванны).
Сероводород получают в результате реакции сульфида алюминия с водой, а также взаимодействия разбавленных кислот с сульфидами.
Сероводород плохо диссоциирует в воде, является слабой кислотой. Реагирует с основными оксидами, основаниями с образованием средних и кислых солей (зависит от соотношения основания и кислоты).
KOH + H2S = KHS + H2O (гидросульфид калия, избыток кислоты)
Металлы, стоящие в ряду напряжений до водорода, способны вытеснить водород из кислоты.
Качественной реакцией на сероводород является реакция с солями свинца, при котором образуется сульфид свинца.
В промышленных условиях сернистый газ получают обжигом пирита.
В лаборатории SO2 получают реакцией сильных кислот на сульфиты. В ходе подобных реакций образуется сернистая кислота, распадающаяся на сернистый газ и воду.
Сернистый газ получается также в ходе реакций малоактивных металлов с серной кислотой.
Химически сернистый газ очень активен. Его восстановительные свойства продемонстрированы в реакциях ниже.
В присутствии сильных восстановителей SO2 способен проявлять окислительные свойства (понижать степень окисления).
Сернистая кислота
Слабая, нестойкая двухосновная кислота. Существует лишь в разбавленных растворах.
Диссоциирует в водном растворе ступенчато.
С сильными восстановителями сернистая кислота принимает роль окислителя.
Как и сернистый газ, сернистая кислота и ее соли обладают выраженными восстановительными свойствами.
Является высшим оксидом серы. Бесцветная летучая жидкость с удушающим запахом. Ядовит.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Сера (S)
Соединения серы:
В природе сера встречается, как в виде самородков, так и в виде разнообразных соединений: сульфидов (FeS2; FeCuS2) и сульфатов (BaSO4), входящих в состав разнообразных минералов (пирит, медный колчедан, гипс, барит). Также сера в виде соединений присутствует в природных углеводородах: нефте, газе, угле.
Атом серы содержит 16 электронов, при этом у серы, как и у атома кислорода, на внешнем энергетическом уровне находится 6 валентных электронов (см. Электронная структура атомов).
В отличие от кислорода, атом серы способен образовывать не только 2 (H2S) ковалентные связи, но и 4 (H2SO3) или 6 (H2SO4) (см. Ковалентная связь). Данное свойство объясняется наличием у атома серы свободного d-подуровня, на который могут переходить 1 или 2 электрона с s- или р-подуровня (см. Атомы 16(VIa) группы).
Сера, как простое вещество
Молекула S2 имеет строение, аналогичное O2.
Сера при высоких температурах может существовать в газообразном состоянии:
Химические свойства серы
Сера является типичным активным неметаллом.
В воде сера практически не растворяется (даже не смачивается водой), а в органических растворителях сера растворяется хорошо.
При взаимодействии с другими веществами сера может выступать, как в роли окислителя, так и в роли восстановителя, в зависимости от окислительно-восстановительных свойств веществ, с которыми сера вступает в реакцию:
Реакции, в которых сера является окислителем:
Реакции, в которых сера является восстановителем:
Взаимодействие серы со сложными веществами:
Аллотропные модификации серы
α-сера
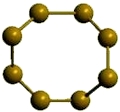
Рис. Ромбическая α-сера.
β-сера
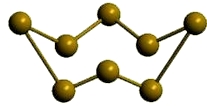
Рис. Моноклинная β-сера.
Пластическая сера
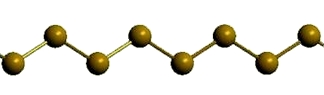
Рис. Пластическая сера.
Получение и применение серы
Способы получения серы:
Применение серы:
Если вам понравился сайт, будем благодарны за его популяризацию 🙂 Расскажите о нас друзьям на форуме, в блоге, сообществе. Это наша кнопочка:
Код кнопки: 
Политика конфиденциальности Об авторе
Cера — химические свойства, получение, соединения. VIа группа
 Нахождение серы в природе
Нахождение серы в природе
Сера встречается в свободном (самородном) состоянии и связанном виде.
Важнейшие природные соединения серы:
FeS2 — железный колчедан или пирит,
ZnS — цинковая обманка или сфалерит (вюрцит),
PbS — свинцовый блеск или галенит,
Кроме того, сера присутствует в нефти, природном угле, природных газах, в природных водах (в виде сульфат-иона и обуславливает «постоянную» жёсткость пресной воды). Жизненно важный элемент для высших организмов, составная часть многих белков, концентрируется в волосах.
Аллотропные модификации серы
Аллотропия — это способность одного и того же элемента существовать в разных молекулярных формах (молекулы содержат разное количество атомов одного и того же элемента, например, О2 и О3, S2 и S8, Р2 и Р4 и т.д).
Сера отличается способностью образовывать устойчивые цепочки и циклы из атомов. Наиболее стабильны S8, образующие ромбическую и моноклинную серу. Это кристаллическая сера — хрупкое вещество жёлтого цвета.
Открытые цепи имеет пластическая сера, вещество коричневого цвета, которая получается при резком охлаждении расплава серы (пластическая сера уже через несколько часов становится хрупкой, приобретает жёлтый цвет и постепенно превращается в ромбическую).
t°пл. = 113°C; r = 2,07 г/см 3
Наиболее устойчивая модификация.
2) моноклинная — темно-желтые иглы
t°пл. = 119°C; r = 1,96 г/см 3
Устойчивая при температуре более 96°С; при обычных условиях превращается в ромбическую.
3) пластическая — коричневая резиноподобная (аморфная) масса
Неустойчива, при затвердевании превращается в ромбическую
Получение серы
Химические свойства серы
Окислительные свойства серы
(S 0 + 2ē → S -2 )
1) Сера реагирует со щелочными металлами без нагревания:
c остальными металлами (кроме Au, Pt) — при повышенной t°:
2) С некоторыми неметаллами сера образует бинарные соединения:
Восстановительные свойства сера проявляет в реакциях с сильными окислителями:
(S — 2ē → S +2 ; S — 4ē → S +4 ; S — 6ē → S +6 )
S + O2 – t° → S +4 O2
S + Cl2 → S +2 Cl2
Со сложными веществами:
5) c кислотами — окислителями:
Реакции диспропорционирования:
7) сера растворяется в концентрированном растворе сульфита натрия:
Сероводород H2S и сульфиды- химические свойства
Соединения серы +4: сернистый газ, сернистая кислота и её соли сульфиты.
Серная кислота – химические свойства и промышленное производство
Биологическая роль р-элементов VIA группы. Применение их соединений в медицине
Урок №22. Свойства и применение серы
СЕРА – S
Cера в природе
Украина, Поволжье, Центральная Азия и др
Cu 2 S – медный блеск (халькозин)
ZnS – цинковая обманка (сфалерит)
FeS 2 – пирит, серный колчедан, кошачье золото
H 2 S – сероводород (в минеральных источниках и природном газе)
Волосы, кожные покровы, ногти…
MgSO 4 x 7H 2 O – горькая соль (английская)
Na 2 SO 4 x 10H 2 O – глауберова соль (мирабилит)
Физические свойства
Получение серы
2. Неполное окисление сероводорода (при недостатке кислорода).
2H 2 S + O 2 = 2S + 2H 2 O
3. Реакция Вакенродера
2H 2 S + SO 2 = 3S + 2H 2 O
Химические свойства серы
1) Сера реагирует со щелочными металлами без нагревания:
2Al + 3S = t° = Al 2 S 3
2) С некоторыми неметаллами сера образует бинарные соединения:
2P + 3S = t° = P 2 S 3
S + O 2 = t° = S +4 O 2
2) c галогенами (кроме йода):
S + 2H 2 SO 4 (конц) = 3S +4 O 2 + 2H 2 O
S + 6HNO 3 (конц) = H 2 S +6 O 4 + 6NO 2 + 2H 2 O
Сера – восстановитель и окислитель в реакциях диспропорционирования:
Применение
Вулканизация каучука, получение эбонита, производство спичек, пороха, в борьбе с вредителями сельского хозяйства, для медицинских целей (серные мази для лечения кожных заболеваний), для получения серной кислоты и т.д.
ЗАДАНИЯ
№1. Закончите уравнения реакций:
Расставьте коэффициенты методом электронного баланса, укажите окислитель, восстановитель.
№2. Осуществите превращения по схеме:
H 2 S → S → Al 2 S 3 → Al(OH) 3
№3. Закончите уравнения реакций, укажите, какие свойства проявляет сера (окислителя или восстановителя):
Это интересно.
В сутки человеку необходимо 1 г серы.
Серой богаты горох, фасоль, овсяные хлопья, пшеница, мясо, рыба, плоды и сок манго.
Сера входит в состав гормонов, витаминов, белков, она есть в хрящевой ткани, в волосах, ногтях. При недостатке серы в организме наблюдается хрупкость ногтей и костей, выпадение волос.
Знаете ли вы.
Соединения серы могут служить лекарственными препаратами
Сера – основа мази для лечения грибковых заболеваний кожи, для борьбы с чесоткой. Тиосульфат натрия Na 2 S 2 O 3 используется для борьбы с нею
Многие соли серной кислоты содержат кристаллизационную воду: ZnSO 4 ×7H 2 O и CuSO 4 ×5H 2 O. Их применяют как антисептические средства для опрыскивания растений и протравливания зерна в борьбе с вредителями сельского хозяйства
Железный купорос FeSO 4 ×7H 2 O используют при анемии
BaSO 4 применяют при рентгенографическом исследовании желудка и кишечника
Минерал Na 2 SO 4 ×10H 2 O носит название «глауберова соль» в честь открывшего его в VIII веке немецкого химика Глаубера И.Р. Глаубер во время своего путешествия внезапно заболел. Он ничего не мог есть, желудок отказывался принимать пищу. Один из местных жителей направил его к источнику. Как только он выпил горькую соленую воду, сразу стал есть. Глаубер исследовал эту воду, из нее выкристаллизовалась соль Na 2 SO 4 ×10H 2 O. Сейчас ее применяют как слабительное в медицине, при окраске хлопчатобумажных тканей. Соль также находит применение в производстве стекла
Тысячелистник обладает повышенной способностью извлекать из почвы серу и стимулировать поглощение этого элемента с соседними растениями
Чеснок выделяет вещество – альбуцид, едкое соединение серы. Это вещество предотвращает раковые заболевания, замедляет старение, предупреждает сердечные заболевания.
Сера и ее соединения
Твердое кристаллическое вещество желтого цвета, нерастворима в воде, водой не смачивается (плавает на поверхности), t°кип = 445°С
t°пл. = 113°C; r = 2,07 г/см3
Наиболее устойчивая модификация.
t°пл. = 119°C; r = 1,96 г/см3
Устойчивая при температуре более 96°С; при обычных условиях превращается в ромбическую.
Неустойчива, при затвердевании превращается в ромбическую.
Размещение электронов по уровням и подуровням
1s22p22p63s23p4
Размещение электронов по
орбиталям (последний слой)
+4 IV
+6 VI
2H2S + O2 ® 2S + 2H2O
3. Реакция Вакенродера
2H2S + SO2 ® 3S + 2H2O
Окислительные свойства серы
(S0 + 2e ® S-2)
1) Сера реагирует со щелочными металлами без нагревания:
2Al + 3S –t°® Al2S3
Zn + S –t°® ZnS
2) С некоторыми неметаллами сера образует бинарные соединения:
H2 + S ® H2S
2P + 3S ® P2S3
C + 2S ® CS2
S + O2 –t°® S+4O2
2S + 3O2 –t°;pt® 2S+6O3
4) c галогенами (кроме йода):
S + 2H2SO4(конц) ® 3S+4O2 + 2H2O
S + 6HNO3(конц) ® H2S+6O4 + 6NO2 + 2H2O
3S0 + 6KOH ® K2S+4O3 + 2K2S-2 + 3H2O
7) сера растворяется в концентрированном растворе сульфита натрия:
S0 + Na2S+4O3 ® Na2S2O3 тиосульфат натрия
Применение
Вулканизация каучука, получение эбонита, производство спичек, пороха, в борьбе с вредителями сельского хозяйства, для медицинских целей (серные мази для лечения кожных заболеваний), для получения серной кислоты и т.д.
Физические свойства
FeS + 2HCl ® FeCl2 + H2S
1) Раствор H2S в воде – слабая двухосновная кислота:
H2S « H+ + HS- « 2H+ + S2-
K1 = ([H+] • [HS-]) / [H2S] = 1 • 10-7
K2 = ([H+] • [S2-]) / [HS-] = 1,3 • 10-14
2) Взаимодействует с основаниями:
H2S + 2NaOH ® Na2S + 2H2O
3) H2S проявляет очень сильные восстановительные свойства:
H2S-2 + Br2 ® S0 + 2HBr
H2S-2 + 2FeCl3 ® 2FeCl2 + S0 + 2HCl
H2S-2 + 4Cl2 + 4H2O ® H2S+6O4 + 8HCl
3H2S-2 + 8HNO3(конц) ® 3H2S+6O4 + 8NO + 4H2O
H2S-2 + H2S+6O4(конц) ® S0 + S+4O2 + 2H2O
4) Сероводород окисляется:
2H2S-2 + O2 ® 2S0 + 2H2O
2H2S-2 + 3O2 ® 2S+4O2 + 2H2O
5) Серебро при контакте с сероводородом чернеет:
4Ag + 2H2S + O2 ® 2Ag2S + 2H2O
H2S + Pb(NO3)2 ® PbS¯ + 2HNO3
Na2S + Pb(NO3)2 ® PbS¯ + 2NaNO3
Pb2+ + S2- ® PbS¯
Одной из основных причин потемнения художественных картин старых мастеров было использование свинцовых белил, которые за несколько веков, взаимодействуя со следами сероводорода в воздухе (образуются в небольших количествах при гниении белков; в атмосфере промышленных регионов и др.) превращаются в PbS.
PbS + 4H2O2 ® PbSO4(белый) + 4H2O
1) Многие сульфиды получают нагреванием металла с серой:
2) Растворимые сульфиды получают действием сероводорода на щелочи:
H2S + 2KOH ® K2S + 2H2O
3) Нерастворимые сульфиды получают обменными реакциями:
CdCl2 + Na2S ® 2NaCl + CdS¯
Pb(NO3)2 + Na2S ® 2NaNO3 + PbS¯
ZnSO4 + Na2S ® Na2SO4 + ZnS¯
MnSO4 + Na2S ® Na2SO4 + MnS¯
2SbCl3 + 3Na2S ® 6NaCl + Sb2S3¯
SnCl2 + Na2S ® 2NaCl + SnS¯
1) Растворимые сульфиды сильно гидролизованы, вследствие чего их водные растворы имеют щелочную реакцию:
K2S + H2O « KHS + KOH
S2- + H2O « HS- + OH-
2) Сульфиды металлов, стоящих в ряду напряжений левее железа (включительно), растворимы в сильных кислотах:
ZnS + H2SO4 ® ZnSO4 + H2S
HgS + H2SO4 –\®
Нерастворимые сульфиды можно перевести в растворимое состояние действием концентрированной HNO3:
FeS2 + 8HNO3 ® Fe(NO3)3 + 2H2SO4 + 5NO + 2H2O
3) Водорастворимые сульфиды растворяют серу с образованием полисульфидов:
Na2S + nS ® Na2Sn+1 (1 £ n £ 5)
Полисульфиды при окислении превращаются в тиосульфаты, например:
2Na2S2 + 3O2 ® 2Na2S2O3
На различной растворимости сульфидов и различной окраске многих из них основан качественный анализ катионов.
ОКСИДЫ СЕРЫ
SO2 (сернистый ангидрид; сернистый газ)
1) При сжигании серы в кислороде:
2) Окислением сульфидов:
4FeS2 + 11O2 ® 2Fe2O3 + 8SO2
3) Обработкой солей сернистой кислоты минеральными кислотами:
Na2SO3 + 2HCl ® 2NaCl + SO2 + H2O
4) При окислении металлов концентрированной серной кислотой:
Cu + 2H2SO4(конц) ® CuSO4 + SO2 + 2H2O
SO2 + H2O « H2SO3 ¬K1® H+ + HSO3- ¬K2® 2H+ + SO32-
K1 = ([H+] • [HSO3-]) / [H2SO3] = 1,6 • 10-2
K2 = ([H+] • [SO32-]) / [HSO3-] = 1,3 • 10-7
Ba(OH)2 + SO2 ® BaSO3¯(сульфит бария) + H2O
Ba(OH)2 + 2SO2 ® Ba(HSO3)2(гидросульфит бария)
2) Реакции окисления (S+4 – 2e ® S+6)
SO2 + Br2 + 2H2O ® H2SO4 + 2HBr
5SO2 + 2KMnO4 + 2H2O ® K2SO4 + 2MnSO4 + 2H2SO4
Водные растворы сульфитов щелочных металлов окисляются на воздухе:
2Na2SO3 + O2 ® 2Na2SO4; 2SO32- + O2 ® 2SO42-
3) Реакции восстановления (S+4 + 4e ® S0)
SO2 + С –t°® S + СO2
SO2 + 2H2S ® 3S + 2H2O
SO3 (серный ангидрид)
Бесцветная летучая жидкость, t°пл. = 17°C; t°кип. = 66°С; на воздухе «дымит», сильно поглощает влагу (хранят в запаянных сосудах).
Твердый SO3 существует в трех модификациях. SO3 хорошо растворяется в 100%-ной серной кислоте, этот раствор называется олеумом.
2SO2 + O2 ¬кат;450°C® 2SO3
Fe2(SO4)3 –t°® Fe2O3 + 3SO3
SO3 + H2O ® H2SO4 « H+ + HSO4- « 2H+ + SO42-
2NaOH + SO3 ® Na2SO4 + H2O
NaOH + SO3 ® NaHSO4
H2SO4
Тяжелая маслянистая жидкость («купоросное масло»); r = 1,84 г/см3; нелетучая, хорошо растворима в воде – с сильным нагревом; t°пл. = 10,3°C, t°кип. = 296°С, очень гигроскопична, обладает водоотнимающими свойствами (обугливание бумаги, дерева, сахара).
Помните!
Кислоту вливать малыми порциями в воду, а не наоборот!
Производство серной кислоты
1-я стадия. Печь для обжига колчедана.
4FeS2 + 11O2 ® 2Fe2O3 + 8SO2 + Q
Процесс гетерогенный:
1) измельчение железного колчедана (пирита)
2) метод «кипящего слоя»
3) 800°С; отвод лишнего тепла
4) увеличение концентрации кислорода в воздухе
2-я стадия. После очистки, осушки и теплообмена сернистый газ поступает в контактный аппарат, где окисляется в серный ангидрид (450°С – 500°С; катализатор V2O5):
3-я стадия. Поглотительная башня:
nSO3 + H2SO4(конц) ® (H2SO4 • nSO3)(олеум)
Воду использовать нельзя из-за образования тумана. Применяют керамические насадки и принцип противотока.
H2SO4 « H+ + HSO4- « 2H+ + SO42-
Первая ступень (для средних концентраций) приводит к 100%-ой диссоциации:
K2 = ([H+] • [SO42-]) / [HSO4-] = 1,2 • 10-2
1) Взаимодействие с металлами:
a) разбавленная серная кислота растворяет только металлы, стоящие в ряду напряжений левее водорода:
Zn0 + H2+1SO4(разб) ® Zn+2SO4 + H2O
2Ag0 + 2H2+6SO4 ® Ag2+1SO4 + S+4O2 + 2H2O
8Na0 + 5H2+6SO4 ® 4Na2+1SO4 + H2S-2 + 4H2O
2) концентрированная H2S+6O4 реагирует при нагревании с некоторыми неметаллами за счет своих сильных окислительных свойств, превращаясь в соединения серы более низкой степени окисления, (например, S+4O2):
С0 + 2H2S+6O4(конц) ® C+4O2 + 2S+4O2 + 2H2O
S0 + 2H2S+6O4(конц) ® 3S+4O2 + 2H2O
2P0 + 5H2S+6O4(конц) ® 5S+4O2 + 2H3P+5O4 + 2H2O
3) с основными оксидами:
CuO + H2SO4 ® CuSO4 + H2O
CuO + 2H+ ® Cu2+ + H2O
H2SO4 + 2NaOH ® Na2SO4 + 2H2O
H+ + OH- ® H2O
H2SO4 + Cu(OH)2 ® CuSO4 + 2H2O
2H+ + Cu(OH)2 ® Cu2+ + 2H2O
5) обменные реакции с солями:
BaCl2 + H2SO4 ® BaSO4¯ + 2HCl
Ba2+ + SO42- ® BaSO4¯
Образование белого осадка BaSO4 (нерастворимого в кислотах) используется для идентификации серной кислоты и растворимых сульфатов.













 Нахождение серы в природе
Нахождение серы в природе


