какие степени окисления могут быть у фтора
Валентность и степень окисления
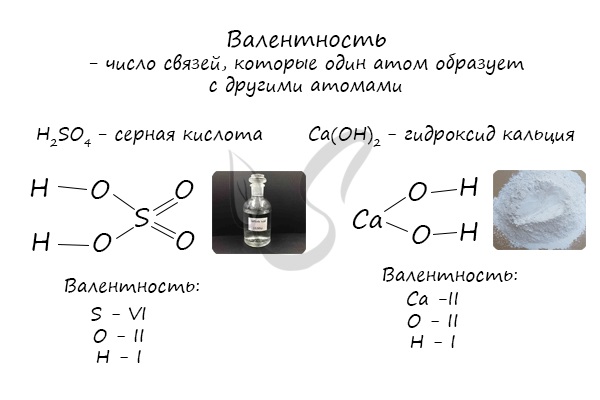
Валентность
Определяют валентность по числу связей, которые один атом образует с другими. Для примера рассмотрим две молекулы
Для определения валентности нужно хорошо представлять графические формулы веществ. В этой статье вы увидите множество формул. Сообщаю вам также о химических элементах с постоянной валентностью, знать которые весьма полезно.
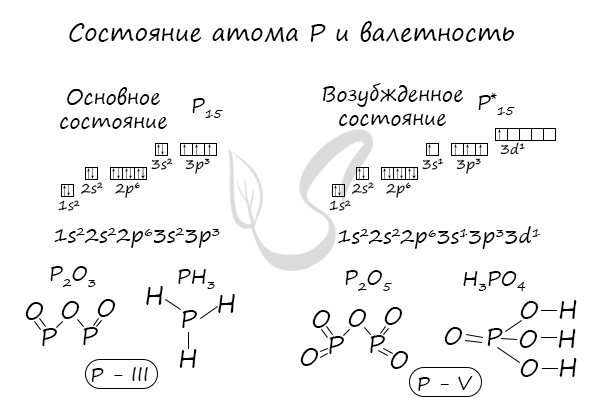
В электронной теории считается, что валентность связи определяется числом неспаренных (валентных) электронов в основном или возбужденном состоянии. Мы касались с вами темы валентных электронов и возбужденного состояния атома. На примере фосфора объединим эти две темы для полного понимания.
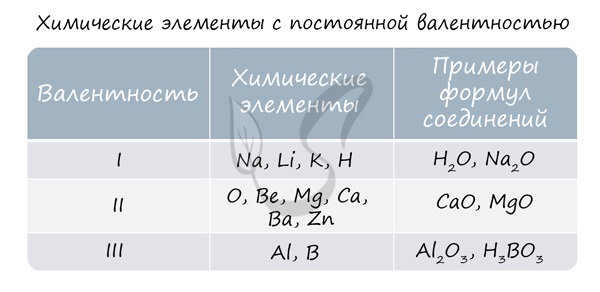
Подавляющее большинство химических элементов обладает непостоянным значением валентности. Переменная валентность характерна для меди, железа, фосфора, хрома, серы.
Степень окисления
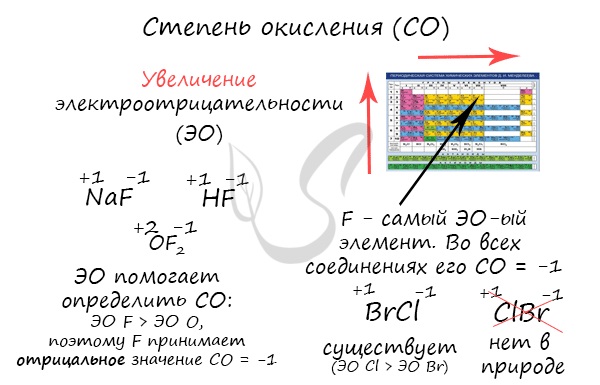
Численно степень окисления равна условному заряду, который можно приписать атому, руководствуясь предположением, что все электроны, образующие связи, перешли к более электроотрицательному элементу.
Зная изменения электроотрицательности в периодах и группах периодической таблицы Д.И. Менделеева, можно сделать вывод о том какой элемент принимает «+», а какой минус. Помогают в этом вопросе и элементы с постоянной степенью окисления.
Самостоятельно определите степени окисления атомов в следующих веществах: RbOH, NaCl, BaO, NaClO3, SO2Cl2, KMnO4, Li2SO3, O2, NaH2PO4. Ниже вы найдете решение этой задачи.
Сравнивайте значение электроотрицательности по таблице Менделеева, и, конечно, пользуйтесь интуицией 🙂 Однако по мере изучения химии, точное знание степеней окисления должно заменить даже самую развитую интуицию 😉
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Блиц-опрос по теме Валентность и степень окисления
Какая степень окисления у фтора?
Дайте краткую характеристику элемента фтора. Положение в периодической системе; электронная конфигурация атомов; валентные возможности. Какая степень окисления у фтора (с примерами веществ)? Укажите высший оксид, его характер, высший гидроксид, его характер.
Фтор — девятый по счету элемент Периодической таблицы Д.И. Менделеева. Он находится во втором периоде во VIIA группе. В ядре атома фтора содержится 9 протонов и 10 нейтронов (массовое число равно 19). В атоме фтора есть два энергетических уровня, на которых находятся 9 электронов.
Электронная формула атома фтора в основном состоянии имеет следующий вид:
Фтор проявляет постоянную валентность I во всех своих соединениях.
Фтор образует двухатомные молекулы состава F2 за счет наведения ковалентных неполярных связей, а, как известно, в соединениях с неполярными связями степень окисления элементов равна нулю.
Фтор характеризуется наибольшим значением электроотрицательности, в своих соединениях он всегда имеет постоянную отрицательную степень окисления равную (-1) (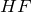
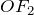
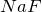
Высший оксид фтора — 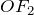
1.3.2. Электроотрицательность. Степень окисления и валентность химических элементов.
Электроотрицательность
Электроотрицательность — способность атома какого-либо химического элемента в соединении оттягивать на себя электроны связанных с ним атомов других химических элементов.
Электроотрицательность, как и прочие свойства атомов химических элементов, изменяется с увеличением порядкового номера элемента периодически:
График выше демонстрирует периодичность изменения электроотрицательности элементов главных подгрупп в зависимости от порядкового номера элемента.
При движении вниз по подгруппе таблицы Менделеева электроотрицательность химических элементов уменьшается, при движении вправо по периоду возрастает.
Электроотрицательность отражает неметалличность элементов: чем выше значение электроотрицательности, тем более у элемента выражены неметаллические свойства.
Степень окисления
Степень окисления – условный заряд атома химического элемента в соединении, рассчитанный исходя из предположения, что все связи в его молекуле ионные, т.е. все связывающие электронные пары смещены к атомам с большей электроотрицательностью.
Как рассчитать степень окисления элемента в соединении?
1) Степень окисления химических элементов в простых веществах всегда равна нулю.
2) Существуют элементы, проявляющие в сложных веществах постоянную степень окисления:
Элементы, проявляющие постоянную СО
Значение постоянной СО этого элемента
IA группы — Li, Na, K, Rb, Cs, Fr
Be, Mg, Ca, Sr, Ba, Ra, Zn, Cd
3) Существуют химические элементы, которые проявляют в подавляющем большинстве соединений постоянную степень окисления. К таким элементам относятся:
Элемент
Степень окисления практически во всех соединениях
Исключения
Фторид кислорода —
4) Алгебраическая сумма степеней окисления всех атомов в молекуле всегда равна нулю. Алгебраическая сумма степеней окисления всех атомов в ионе равна заряду иона.
5) Высшая (максимальная) степень окисления равна номеру группы. Исключения, которые не попадают под это правило, — элементы побочной подгруппы I группы, элементы побочной подгруппы VIII группы, а также кислород и фтор.
Химические элементы, номер группы которых не совпадает с их высшей степенью окисления (обязательные к запоминанию)
Химический элемент
Номер группы
Высшая степень окисления
6) Низшая степень окисления металлов всегда равна нулю, а низшая степень окисления неметаллов рассчитывается по формуле:
низшая степень окисления неметалла = №группы − 8
Отталкиваясь от представленных выше правил, можно установить степень окисления химического элемента в любом веществе.
Нахождение степеней окисления элементов в различных соединениях
Пример 1
Определите степени окисления всех элементов в серной кислоте.
Решение:
Запишем формулу серной кислоты:
Степень окисления водорода во всех сложных веществах +1 (кроме гидридов металлов).
Обозначим степень окисления серы как x:
Молекула серной кислоты, как и молекула любого вещества, в целом электронейтральна, т.к. сумма степеней окисления всех атомов в молекуле равна нулю. Схематически это можно изобразить следующим образом:
Т.е. мы получили следующее уравнение:
Таким образом, степень окисления серы в серной кислоте равна +6.
Пример 2
Определите степень окисления всех элементов в дихромате аммония.
Решение:
Запишем формулу дихромата аммония:
Как и в предыдущем случае, мы можем расставить степени окисления водорода и кислорода:
Однако мы видим, что неизвестны степени окисления сразу у двух химических элементов — азота и хрома. Поэтому найти степени окисления аналогично предыдущему примеру мы не можем (одно уравнение с двумя переменными не имеет единственного решения).
Мы знаем степени окисления водорода и кислорода. Зная, что сумма степеней окисления атомов всех элементов в ионе равна заряду, и обозначив степени окисления азота и хрома как x и y соответственно, мы можем записать:
Т.е. мы получаем два независимых уравнения:
Решая которые, находим x и y:
Как определять степени окисления элементов в органических веществах можно почитать здесь.
Валентность
Валентность атомов обозначается римскими цифрами: I, II, III и т.д.
Валентные возможности атома зависят от количества:
1) неспаренных электронов
2) неподеленных электронных пар на орбиталях валентных уровней
3) пустых электронных орбиталей валентного уровня
Валентные возможности атома водорода
Изобразим электронно-графическую формулу атома водорода:
Было сказано, что на валентные возможности могут влиять три фактора — наличие неспаренных электронов, наличие неподеленных электронных пар на внешнем уровне, а также наличие вакантных (пустых) орбиталей внешнего уровня. Мы видим на внешнем (и единственном) энергетическом уровне один неспаренный электрон. Исходя из этого, водород может точно иметь валентность, равную I. Однако на первом энергетическом уровне есть только один подуровень — s, т.е. атом водорода на внешнем уровне не имеет как неподеленных электронных пар, так и пустых орбиталей.
Таким образом, единственная валентность, которую может проявлять атом водорода, равна I.
Валентные возможности атома углерода
Рассмотрим электронное строение атома углерода. В основном состоянии электронная конфигурация его внешнего уровня выглядит следующим образом:
Т.е. в основном состоянии на внешнем энергетическом уровне невозбужденного атома углерода находится 2 неспаренных электрона. В таком состоянии он может проявлять валентность, равную II. Однако атом углерода очень легко переходит в возбужденное состояние при сообщении ему энергии, и электронная конфигурация внешнего слоя в этом случае принимает вид:
Несмотря на то что на процесс возбуждения атома углерода тратится некоторое количество энергии, траты с избытком компенсируются при образовании четырех ковалентных связей. По этой причине валентность IV намного более характерна для атома углерода. Так, например, валентность IV углерод имеет в молекулах углекислого газа, угольной кислоты и абсолютно всех органических веществ.
Помимо неспаренных электронов и неподеленных электронных пар на валентные возможности также влияет наличие вакантных ( ) орбиталей валентного уровня. Наличие таких орбиталей на заполняемом уровне приводит к тому, что атом может выполнять роль акцептора электронной пары, т.е. образовывать дополнительные ковалентные связи по донорно-акцепторному механизму. Так, например, вопреки ожиданиям, в молекуле угарного газа CO связь не двойная, а тройная, что наглядно показано на следующей иллюстрации:
Резюмируя информацию по валентным возможностям атома углерода:
1) Для углерода возможны валентности II, III, IV
2) Наиболее распространенная валентность углерода в соединениях IV
3) В молекуле угарного газа CO связь тройная (!), при этом одна из трех связей образована по донорно-акцепторному механизму
Валентные возможности атома азота
Запишем электронно-графическую формулу внешнего энергетического уровня атома азота:
Как видно из иллюстрации выше, атом азота в своем обычном состоянии имеет 3 неспаренных электрона, в связи с чем логично предположить о его способности проявлять валентность, равную III. Действительно, валентность, равная трём, наблюдается в молекулах аммиака (NH3), азотистой кислоты (HNO2), треххлористого азота (NCl3) и т.д.
Выше было сказано, что валентность атома химического элемента зависит не только от количества неспаренных электронов, но также и от наличия неподеленных электронных пар. Связано это с тем, что ковалентная химическая связь может образоваться не только, когда два атома предоставляют друг другу по одному электрону, но также и тогда, когда один атом, имеющий неподеленную пару электронов — донор( ) предоставляет ее другому атому с вакантной (
) орбиталью валентного уровня (акцептору). Т.е. для атома азота возможна также валентность IV за счет дополнительной ковалентной связи, образованной по донорно-акцепторному механизму. Так, например, четыре ковалентных связи, одна из которых образована по донорно-акцепторному механизму, наблюдается при образовании катиона аммония:
Несмотря на то что одна из ковалентных связей образуется по донорно-акцепторному механизму, все связи N-H в катионе аммония абсолютно идентичны и ничем друг от друга не отличаются.
Валентность, равную V, атом азота проявлять не способен. Связано это с тем, что для атома азота невозможен переход в возбужденное состояние, при котором происходит распаривание двух электронов с переходом одного из них на свободную орбиталь, наиболее близкую по уровню энергии. Атом азота не имеет d-подуровня, а переход на 3s-орбиталь энергетически настолько затратен, что затраты энергии не покрываются образованием новых связей. Многие могут задаться вопросом, а какая же тогда валентность у азота, например, в молекулах азотной кислоты HNO3 или оксида азота N2O5? Как ни странно, валентность там тоже IV, что видно из нижеследующих структурных формул:
em>Резюмируя информацию по валентным возможностям атома азота:
1) Для азота возможны валентности I, II, III и IV
2) Валентности V у азота не бывает!
3) В молекулах азотной кислоты и оксида азота N2O5 азот имеет валентность IV, а степень окисления +5 (!).
Валентные возможности фосфора
Изобразим электронно-графическую формулу внешнего энергетического уровня атома фосфора:
Как мы видим, строение внешнего слоя у атома фосфора в основном состоянии и атома азота одинаково, в связи с чем логично ожидать для атома фосфора так же, как и для атома азота, возможных валентностей, равных I, II, III и IV, что и наблюдается на практике.
Однако в отличие от азота, атом фосфора имеет на внешнем энергетическом уровне еще и d-подуровень с 5-ю вакантными орбиталями.
Таким образом, недоступная для азота валентность V для атома фосфора возможна. Так, например, валентность, равную пяти, атом фосфора имеет в молекулах таких соединений, как фосфорная кислота, галогениды фосфора (V), оксид фосфора (V) и т.д.
Валентные возможности атома кислорода
Электронно-графическая формула внешнего энергетического уровня атома кислорода имеет вид:
Мы видим на 2-м уровне два неспаренных электрона, в связи с чем для кислорода возможна валентность II. Следует отметить, что данная валентность атома кислорода наблюдается практически во всех соединениях. Выше при рассмотрении валентных возможностей атома углерода мы обсудили образование молекулы угарного газа. Связь в молекуле CO тройная, следовательно, кислород там трехвалентен (кислород — донор электронной пары).
Из-за того что атом кислорода не имеет на внешнем уровне d-подуровня, распаривание электронов s и p-орбиталей невозможно, из-за чего валентные возможности атома кислорода ограничены по сравнению с другими элементами его подгруппы, например, серой.
Таким образом, кислород практически всегда имеет валентность, равную II, однако в некоторых частицах он трехвалентен, в частности, в молекуле угарного газа C≡O. В случае, когда кислород имеет валентность III, одна из ковалентных связей образована по донорно-акцепторному механизму.
Валентные возможности атома серы
Внешний энергетический уровень атома серы в невозбужденном состоянии:
У атома серы, как и у атома кислорода, в обычном состоянии два неспаренных электрона, поэтому мы можем сделать вывод о том, что для серы возможна валентность, равная двум. И действительно, валентность II сера имеет, например, в молекуле сероводорода H2S.
Как мы видим, у атома серы на внешнем уровне появляется d-подуровень с вакантными орбиталями. По этой причине атом серы способен расширять свои валентные возможности в отличие от кислорода за счет перехода в возбужденные состояния. Так, при распаривании неподеленной электронной пары 3p-подуровня атом серы приобретает электронную конфигурацию внешнего уровня следующего вида:
В таком состоянии атом серы имеет 4 неспаренных электрона, что говорит нам о возможности проявления атомами серы валентности, равной IV. Действительно, валентность IV сера имеет в молекулах SO2, SF4, SOCl2 и т.д.
При распаривании второй неподеленной электронной пары, расположенной на 3s-подуровне, внешний энергетический уровень приобретает конфигурацию:
В таком состоянии уже становится возможным проявление валентности VI. Примером соединений с VI-валентной серой являются SO3, H2SO4, SO2Cl2 и т.д.
Аналогично можно рассмотреть валентные возможности остальных химических элементов.
Галогены. Химия галогенов и их соединений
Галогены
Положение в периодической системе химических элементов
Галогены расположены в главной подгруппе VII группы (или в 17 группе в современной форме ПСХЭ) периодической системы химических элементов Д.И. Менделеева.
Электронное строение галогенов
Электронная концигурация хлора :
Атомы галогенов содержат на внешнем энергетическом уровне 1 неспаренный электрон и три неподеленные электронные пары в основном энергетическом состоянии. Следовательно, в основном состоянии атомы галогенов могут образовывать 1 связи по обменному механизму.
При этом у фтора возбужденного состояния нет, т.е. максимальная валентность фтора в соединения равна I.
Однако, в отличие от фтора, за счет вакантной d-орбитали атомы хлора, брома и йода могут переходить в возбужденное энергетическое состояние.
Таким образом, максимальная валентность галогенов (кроме фтора) в соединениях равна VII. Также для галогенов характерны валентности I, III, V.
Физические свойства и закономерности изменения свойств
Галогены образуют двухатомные молекулы состава Hal2. В твёрдом состоянии имеют молекулярную кристаллическую решетку. Плохо растворимы в воде, все имеют запах, летучи.
| Галоген | F | Cl | Br | I |
| Электронная формула | … 2s 2 2p 5 | … 3s 2 3p 5 | … 4s 2 4p 5 | … 5s 2 5p 5 |
| Электроотрицательность | 4,0 | 3,0 | 2,8 | 2,5 |
| Степени окисления | -1 | -1, +1, +3, +5, +7 | -1, +1, +3, +5, +7 | -1, +1, +3, +5, +7 |
| Агрегатное состояние | Газ | Газ | Жидкость | Твердые кристаллы |
| Цвет | Светло-желтый | Жёлто-зелёный | Буровато-коричневый | Тёмно-серый с металлическим блеском |
| Запах | Резкий | Резкий, удушливый | Резкий, зловонный | Резкий |
| T плавления | –220 о С | –101 о С | –7 о С | 113,5 о С |
| Т кипения | –188 о С | –34 о С | 58 о С | 185 о С |
Внешний вид галогенов:
Фтор
Хлор
Бром
В природе галогены встречаются в виде соединений, в основном, в виде галогенидов.
Соединения галогенов
Типичные соединения хлора:
| Степень окисления | Типичные соединения |
| +7 | Хлорная кислота HClO4 Перхлораты MeClO4 |
| +5 | Хлорноватая кислота HClO3 Хлораты MeClO3 |
| +3 | Хлористая кислота HClO2 |
| +1 | Хлорноватистая кислота HClO Гипохлориты MeClO |
| –1 | Хлороводород HCl, Хлориды MeCl |
Бром и йод образуют подобные соединения.
Способы получения галогенов
1. Получение хлора.
В промышленности хлор получают электролизом расплава или раствора хлорида натрия.
Электролиз расплава хлорида натрия.
В расплаве хлорид натрия диссоциирует на ионы:
NaCl → Na + + Cl −
На катоде восстанавливаются ионы натрия:
K(–): Na + +1e → Na 0
На аноде окисляются ионы хлора:
A(+): 2Cl − ̶ 2e → Cl2 0
Ионное уравнение электролиза расплава хлорида натрия:
2Na + + 2Cl − → 2Na º + Cl2º
Суммарное уравнение электролиза расплава хлорида натрия:
2NaCl → 2Na + Cl2
Электролиз раствора хлорида натрия.
В растворе хлорид натрия диссоциирует на ионы:
NaCl → Na + + Cl −
На катоде восстанавливаются молекулы воды:
K(–): 2H2O + 2e → H2° + 2OH −
На аноде окисляются ионы хлора:
A(+): 2Cl − ̶ 2e → Cl2 0
Ионное уравнение электролиза раствора хлорида натрия:
Суммарное уравнение электролиза раствора хлорида натрия:
2NaCl + 2H2O → H2↑ + 2NaOH + Cl2↑
В лаборатории хлор получают взаимодействием концентрированной соляной кислоты с сильными окислителями.
Или перманганатом калия:
2KMnO4 + 16HCl → 2MnCl2 + 2KCl + 5Cl2↑ + 8H2O
Бертолетова соль также окисляет соляную кислоту:
KClO3 + 6HCl → KCl + 3Cl2↑ + 3H2O
Бихромат калия окисляет соляную кислоту:
2. Получение фтора.
Фтор получают электролизом расплава гидрофторида калия.
3. Получение брома.
Бром можно получить окислением ионов Br – сильными окислителями.
2HBr + Cl2 → Br2 + 2HCl
Соединения марганца также окисляют бромид-ионы.
4. Получение йода.
Йод получают окислением ионов I – сильными окислителями.
2KI + Cl2 → I2 + 2KCl
Соединения марганца также окисляют йодид-ионы.
Химические свойства галогенов
Химическая активность галогенов увеличивается снизу вверх – от астата к фтору.
1.1. Галогены не горят на воздухе. Фтор окисляет кислород с образованием фторида кислорода:
1.2. При взаимодействии галогенов с серой образуются галогениды серы:
1.3. При взаимодействии фосфора и углерода с галогенами образуются галогениды фосфора и углерода:
1.4. При взаимодействии с металлами галогены проявляют свойства окислителей, образуя галогениды.
3Cl2 + 2Fe → 2FeCl3
Аналогичная ситуация с медью : фтор, хлор и бром окисляют медь до галогенидов меди (II),а йод до йодида меди (I):
I2 + 2Cu → 2CuI
Активные металлы бурно реагируют с галогенами, особенно с фтором и хлором (горят в атмосфере фтора или хлора).
Еще пример : алюминий взаимодействует с хлором с образованием хлорида алюминия:
3Cl2 + 2Al → 2AlCl3
1.5. Водород горит в атмосфере фтора:
С хлором водород реагирует только при нагревании или освещении. При этом реакция протекает со взрывом:
Бром также реагирует с водородом с образованием бромоводорода:
Взаимодействие йода с водородом происходит только при сильном нагревании, реакция протекает обратимо, с поглощением теплоты (эндотермическая):
1.6. Галогены реагируют с галогенами. Более активные галогены окисляют менее активные.
2. Со сложными веществами галогены реагируют, также проявляя преимущественно окислительные свойства. Галогены охотно диспропорционируют при растворении в воде или в щелочах.
2.1. При растворении в воде хлор и бром частично диспропорционируют, повышая и понижая степень окисления. Фтор окисляет воду.
Cl2 + H2O ↔ HCl + HClO
Фтор реагирует с водой со взрывом:
2.2. При растворении в щелочах хлор, бром и йод диспропорционируют с образованием различных солей. Фтор окисляет щелочи.
При взаимодействии с горячим раствором гидроксида натрия образуются хлорид и хлорат:
Еще пример : хлор растворяется в холодном растворе гидроксида кальция:
2.3. Более активные галогены вытесняют менее активные галогены из солей и галогеноводородов.
Cl2 + 2NaI → 2NaCl + I2
Cl2 + 2NaBr → 2NaCl + Br2
Еще одно свойство: более активные галогены окисляют менее активные.
Cl2 + F2 → 2Cl + F –
В свою очередь, хлор окисляет йод. При этом в растворе образуется соляная кислота и йодная кислота:
2.4. Галогены проявляют окислительные свойства, взаимодействуют с восстановителями.
Cl2 + H2S → S + 2HCl
Хлор также окисляет сульфиты:
Также галогены окисляют пероксиды:
Или, при нагревании или на свету, воду:
2Cl2 + 2H2O → 4HCl + O2 (на свету или кип.)
Галогеноводороды
Строение молекулы и физические свойства
Галогеноводороды HHal – это бинарные соединения водорода с галогенами, которые относятся к летучим водородным соединениям. Галогеноводороды – бесцветные ядовитый газы, с резким запахом, хорошо растворимые в воде.
В ряду HCl – HBr – HI увеличивается длина связи и ковалентности связи уменьшается полярность связи H – Hal.
Растворы галогеноводородов в воде (за исключением фтороводорода) – сильные кислоты. Водный раствор фтороводорода – слабая кислота.
Способы получения галогеноводородов
В лаборатории галогеноводороды получают действием нелетучих кислот на хлориды металлов.
Галогеноводороды получают также прямым взаимодействием простых веществ:
Химические свойства галогеноводородов
2HCl + CaO → CaCl2 + H2O
HCl + NaOH → NaCl + H2O
Fe + 2HCl → FeCl2 + H2
HF ↔ H + + F –
Водные растворы хлороводорода (соляная кислота), бромоводорода и йодоводорода – сильные кислоты, в разбавленном растворе диссоциируют практически полностью:
HCl ↔ H + + Cl –
3. Водные растворы галогеноводородов взаимодействуют с солями более слабых кислот и с некоторыми растворимыми солями (если образуется газ, осадок, вода или слабый электролит).
Качественная реакция на галогенид-ионы – взаимодействие с растворимыми солями серебра.
При взаимодействии соляной кислоты с нитратом серебра (I) образуется белый осадок хлорида серебра:
HCl + AgNO3 = AgCl↓ + HNO3
Осадок бромида серебра – бледно-желтого цвета:
HBr + AgNO3 = AgBr↓ + HNO3
Осадок иодида серебра – желтого цвета:
HI + AgNO3 = AgI↓ + HNO3
Фторид серебра – растворимая соль, поэтому реакция плавиковой кислоты и ее солей с нитратом серебра не является качественной.
Видеоопыты качественных реакций на хлорид-, бромид- и йодид-ионы (взаимодействие с нитратом серебра) можно посмотреть здесь.
4. Восстановительные свойства галогеноводородов усиливаются в ряду HF – HCl – HBr – HI.
Br2 + 2HI → I2 + 2HBr
А вот хлор не может вытеснить фтор из фтороводорода.
Фтороводород практически невозможно окислить.
Концентрированная соляная кислота окисляется соединениями марганца с валетностью выше II или соединениями хрома (VI).
Например : концентрированная соляная кислота окисляется оксидом марганца (IV):
Бромоводород – сильный восстановитель и окисляется соединениями марганца, хрома (VI), концентрированной серной кислотой и другими сильными окислителями:
Бромоводород реагирует с бихроматом калия с образованием молекулярного брома:
Или с оксидом марганца (IV):
Пероксид водорода также окисляет бромоводород до молекулярного брома:
Йодоводород – еще более сильный восстановитель, и окисляется другими неметаллами и даже такими окислителями, как соединения железа (III) и соединения меди (II).
2HI + 2FeCl3 → I2 + 2FeCl2 + 2HCl
или с сульфатом железа (III):
или молекулярной серой при нагревании:
2HI + S → I2 + H2S
5. Плавиковая кислота реагирует с оксидом кремния (IV) (растворяет стекло):
Галогениды металлов
Галогениды – это бинарные соединения галогенов и металлов или некоторых неметаллов, соли галогеноводородов.
Способы получения галогенидов
При взаимодействии железа с хлором образуется хлорид железа (III):
3Cl2 + 2Fe → 2FeCl3
2. Галогениды металлов можно получить при взаимодействии металлов с галогеноводородами.
Fe + 2HCl → FeCl2 + H2
3. Галогениды металлов можно получить при взаимодействии основных и амфотерных оксидов с галогеноводородами.
2HCl + CaO → CaCl2 + H2O
Еще пример : взаимодействие оксида алюминия с соляной кислотой:
4. Галогениды металлов можно получить при взаимодействии оснований и амфотерных гидроксидов с галогеноводородами.
HCl + NaOH → NaCl + H2O
Или при взаимодействии гидроксида меди (II) с соляной кислотой:
Гидроксид цинка (II) также взаимодействует с соляной кислотой:
5. Некоторые соли взаимодействуют с галогеноводородами с образованием галогенидов металлов.
HBr + NaHCO3 → NaBr + CO2↑ + H2O
Взаимодействие с нитратом серебра – качественная реакция на соляную кислоту, бромодоводород и йодоводород:
HCl + AgNO3 → AgCl↓ + HNO3
HBr + AgNO3 → AgBr↓ + HNO3
HI + AgNO3 → AgI↓ + HNO3
Химические свойства галогенидов
NaCl + AgNO3 → AgCl↓ + NaNO3
Фторид серебра – растворимая соль, поэтому реакция фторидов с нитратом серебра не является качественной.
Видеоопыты качественных реакций на хлорид-, бромид- и йодид-ионы (взаимодействие с нитратом серебра) можно посмотреть здесь.
Mg + CuCl2 → MgCl2 + Cu
Обратите внимание! В растворе более активные металлы вытесняют менее активные только если более активные металлы не взаимодействуют с водой (металлы, расположенные в ряду активности до магния). Если добавляемый металл слишком активен, то он провзаимодействует с водой, а не с солью.
Na + ZnCl2(раствор) ≠
3. Галогениды подвергаются электролизу в растворе или расплаве. При этом на аноде образуются галогены.
2KBr → 2K + Br2
При электролизе раствора бромида калия на катоде выдялется водород, а на аноде также образуется бром:
Еще пример : йодид калия окисляется соединениями меди (II) и соединениями железа (III):
4KI + 2CuCl2 → 2CuI↓ + I2↓ + 4KCl
2KI + 2FeCl3 → I2↓ + 2FeI2 + 2KCl
Еще несколько примеров восстановительных свойств галогенидов:
KI + 3H2O + 3Cl2 → HIO3 + KCl + 5HCl
Более активные галогены вытесняют менее активные из солей.
При этом галогениды металлов не горят в кислороде.
6. Нерастворимые галогениды под действием света разлагаются на галоген и металл.
2AgCl → 2Ag + Cl2
Кислородсодержащие кислоты галогенов
Рассмотрим кислородсодержащие кислоты галогенов на примере хлора:
| Степень окисления галогена | +1 | +3 | +5 | +7 |
| Формула | HClO | HClO2 | HClO3 | HClO4 |
| Название кислоты | Хлорноватистая | Хлористая | Хлорноватая | Хлорная |
| Устойчивость и сила | Существует только в растворах, слабая кислота | Существует только в растворах, слабая кислота | Существует только в растворах, сильная кислота | Сильная кислота |
| Название соответствующей соли | Гипохлориты | Хлориты | Хлораты | Перхлораты |
Хлорноватистая кислота и ее соли
Хлорноватистая кислота HClO устойчива только в разбавленном водном растворе.
Cпособ получения хлорноватистой кислоты:
1. Диспропорционирование хлора в холодной воде :
Cl2 + H2O ↔ HCl + HClO
Химические свойства хлорноватистой кислоты:
Хлорноватистая кислота HClO – это слабая кислота, но сильный окислитель.
1. Под действием ультрафиолета (на свету) хлорноватистая кислота разлагается :
2HClO → 2HCl + O2
HClO + KOH → KClO + H2O
HClO + 2HI → HCl + I2 + H2O
4. Хлорноватистая кислота диспропорционирует:
3HClO → 2HCl + НСlO3
Химические свойства солей хлорноватистой кислоты (гипохлоритов):
1. Более сильные кислоты вытесняют гипохлориты из солей.
NaClO + 2HCl → NaCl + Cl2 + H2O
Серная кислота реагирует с гипохлоритом кальция при нагревании или под действием излучения:
Даже угольная кислота вытесняет гипохлориты:
3. При нагревании гипохлориты разлагаются :
Хлористая кислота и ее соли
Хлористая кислота HClO2 – существует только в водных растворах.
Способы получения:
Хлористую кислоту можно получить окислением оксида хлора пероксидом водорода:
Химические свойства хлористой кислоты:
1. Хлористая кислота является также слабой. Реагирует с щелочами с образованием хлоритов:
2. При длительном хранении разлагается:
Хлорноватая кислота и ее соли
Хлорноватая кислота HClO3 – также существует только в водных растворах.
Способы получения:
Хлорноватую кислоту можно получить из солей хлорноватой кислоты – хлоратов.
Химические свойства хлорноватой кислоты:
1. Хлорноватая кислота – сильная кислота. Реагирует с щелочами с образованием хлоратов:
2. Хлорноватая кислота – сильный окислитель.
Химические свойства солей хлорноватой кислоты – хлоратов:
1. Хлораты – сильные окислители.
4KClO3 → 3KClO4 + KCl
В присутствии катализатора (оксид марганца (IV)) хлорат калия разлагается, окисляя кислород:
2KClO3 → 2KCl + 3O2↑
Еще пример : хлорат калия окисляет серу и фосфор:
2KClO3 + 3S → 2KCl + 3SO2
Хлорная кислота и ее соли
Хлорная кислота HClO4 – это бесцветная жидкость, хорошо растворимая в воде.
Способы получения:
Хлорную кислоту можно получить из солей хлорной кислоты – перхлоратов.
Химические свойства хлорной кислоты:
1. Хлорная кислота – сильная кислота. Реагирует с щелочами с образованием перхлоратов:
2. Хлорная кислота – сильный окислитель.
3. При нагревании хлорная кислота разлагается:
Химические свойства солей хлорной кислоты – перхлоратов:
1. Перхлораты – сильные окислители.
Еще пример : перхлорат калия окисляет алюминий: