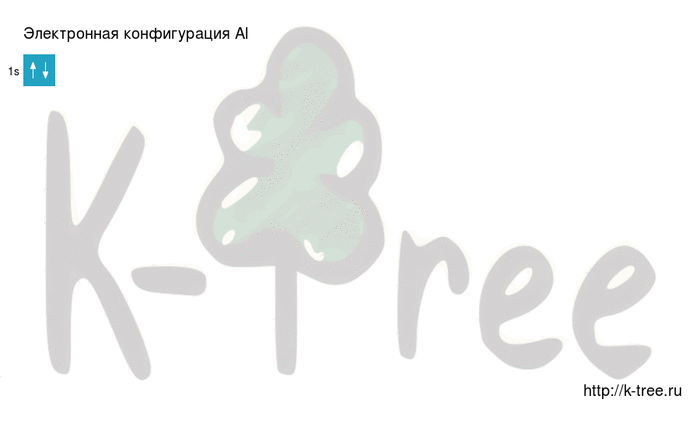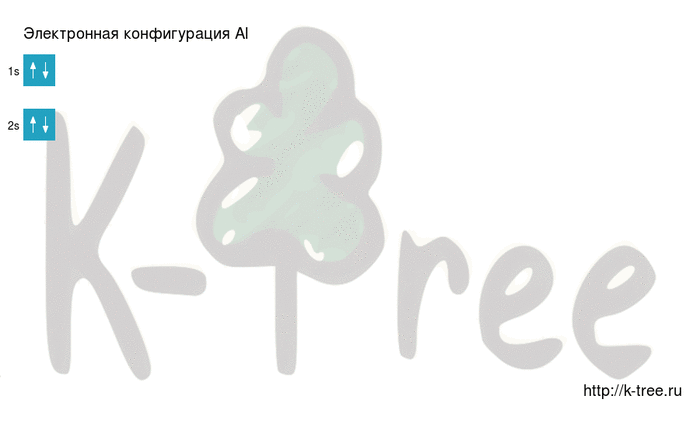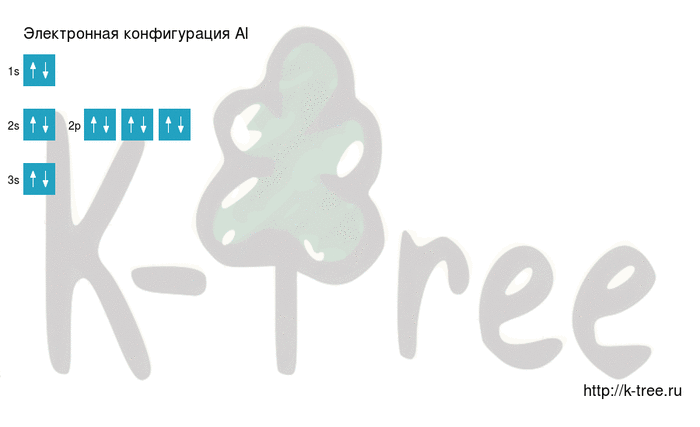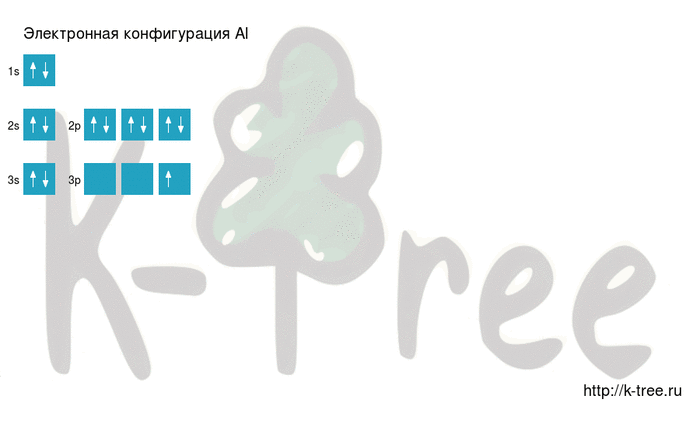какие степени окисления возможны для алюминия
Алюминий Al
Алюминий в таблице менделеева занимает 13 место, в 3 периоде.
| Символ | Al |
| Номер | 13 |
| Атомный вес | 26.9815385 |
| Латинское название | Aluminium |
| Русское название | Алюминий |
Как самостоятельно построить электронную конфигурацию? Ответ здесь
Электронная схема алюминия
Короткая запись:
Al: [Ne]3s 2 3p 1
Порядок заполнения оболочек атома алюминия (Al) электронами: 1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d → 5p → 6s → 4f → 5d → 6p → 7s → 5f → 6d → 7p.
Алюминий имеет 13 электронов, заполним электронные оболочки в описанном выше порядке:
2 электрона на 1s-подуровне
2 электрона на 2s-подуровне
6 электронов на 2p-подуровне
2 электрона на 3s-подуровне
1 электрон на 3p-подуровне
Степень окисления алюминия
Атомы алюминия в соединениях имеют степени окисления 3, 1.
Ионы алюминия
Валентность Al
Атомы алюминия в соединениях проявляют валентность III, I.
Валентность алюминия характеризует способность атома Al к образованию хмических связей. Валентность следует из строения электронной оболочки атома, электроны, участвующие в образовании химических соединений называются валентными электронами. Более обширное определение валентности это:
Число химических связей, которыми данный атом соединён с другими атомами
Валентность не имеет знака.
Квантовые числа Al
Видео заполнения электронной конфигурации (gif):
Результат:
Энергия ионизации
Перейти к другим элементам таблицы менделеева
Алюминий
Алюминий является самым распространенным металлом в земной коре. Свойства алюминия позволяют активно применять в составе металлоконструкций: он легкий, мягкий, поддается штамповке, обладает высокой антикоррозийной устойчивостью.
Для алюминия характерна высокая химическая активность, отличается также высокой электро- и теплопроводностью.
Основное и возбужденное состояние
При переходе атома алюминия в возбужденное состояние 2 электрона s-подуровня распариваются, и один электрон переходит на p-подуровень.
Природные соединения
Получение
Химические свойства
При комнатной температуре реагирует с галогенами (кроме фтора) и кислородом, покрываясь при этом оксидной пленкой.
Al + Br2 → AlBr3 (бромид алюминия)
При нагревании алюминий вступает в реакции с фтором, серой, азотом и углеродом.
Al + F2 → (t) AlF3 (фторид алюминия)
Al + S → (t) Al2S3 (сульфид алюминия)
Al + N2 → (t) AlN (нитрид алюминия)
Al + C → (t) Al4C3 (карбид алюминия)
С помощью алюминотермии получают Fe, Cr, Mn, Ca, Ti, V, W.
Оксид алюминия
Проявляет амфотерные свойства: реагирует и с кислотами, и с основаниями.
Al2O3 + NaOH + H2O → Na[Al(OH)4] (тетрагидроксоалюминат натрия)
Гидроксид алюминия
Проявляет амфотерные свойства. Реагирует и с кислотами, и с основаниями. Вследствие нерастворимости гидроксид алюминия не реагирует с солями.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Какие степени окисления возможны для алюминия
Главную подгруппу III группы периодической системы составляют бор (В), алюминий (А l ), галлий ( Ga ), индий ( In ) и таллий (Т l ).
Как видно из приведенных данных, все эти элементы были открыты в XIX столетии.
Открытие металлов главной подгруппы III группы
Бор представляет собой неметалл. Алюминий — переходный металл, а галлий, индий и таллий — полноценные металлы. Таким образом, с ростом радиусов атомов элементов каждой группы периодической системы металлические свойства простых веществ усиливаются.
Видео YouTube
1. Положение алюминия в таблице Д. И. Менделеева. Строение атома, проявляемые степени окисления.
Элемент алюминий расположен в III группе, главной «А» подгруппе, 3 периоде периодической системы, порядковый номер №13, относительная атомная масса Ar ( Al ) = 27. Его соседом слева в таблице является магний – типичный металл, а справа – кремний – уже неметалл. Следовательно, алюминий должен проявлять свойства некоторого промежуточного характера и его соединения являются амфотерными.
Запишите в тетрадь: строение атома, физические и химические свойства:
1s 2 2s 2 2p 6 3s 2 3p 1
1s 2 2s 2 2p 6 3s 1 3p 2
Алюминий проявляет в соединениях степень окисления +3:
2. Физические свойства
Алюминий в свободном виде — серебристо-белый металл, обладающий высокой тепло- и электропроводностью. Температура плавления 650 о С. Алюминий имеет невысокую плотность (2,7 г/см 3 ) — примерно втрое меньше, чем у железа или меди, и одновременно — это прочный металл.
3. Нахождение в природе
По распространённости в природе занимает 1-е среди металлов и 3-е место среди элементов, уступая только кислороду и кремнию. Процент содержания алюминия в земной коре по данным различных исследователей составляет от 7,45 до 8,14 % от массы земной коры.
В природе алюминий встречается только в соединениях (минералах).
· Глинозёмы (смеси каолинов с песком SiO2, известняком CaCO3, магнезитом MgCO3)
4. Химические свойства алюминия и его соединений (посмотрите видео-опыты)
Алюминий легко взаимодействует с кислородом при обычных условиях и покрыт оксидной пленкой (она придает матовый вид).
Её толщина 0,00001 мм, но благодаря ней алюминий не коррозирует. Для изучения химических свойств алюминия оксидную пленку удаляют. (При помощи наждачной бумаги, или химически: сначала опуская в раствор щелочи для удаления оксидной пленки, а затем в раствор солей ртути для образования сплава алюминия со ртутью – амальгамы).
I . Взаимодействие с простыми веществами
2А l + 3 S = А l 2 S 3 (сульфид алюминия),
2А l + N2 = 2А lN (нитрид алюминия),
А l + Р = А l Р (фосфид алюминия),
4А l + 3С = А l 4 С3 (карбид алюминия).
2 Аl + 3 I 2 = 2 A l I3 (йодид алюминия) ОПЫТ
Все эти соединения полностью гидролизуются с образованием гидроксида алюминия и, соответственно, сероводорода, аммиака, фосфина и метана:
В виде стружек или порошка он ярко горит на воздухе, выделяя большое количество теплоты:
4А l + 3 O 2 = 2А l 2 О3 + 1676 кДж.
II . Взаимодействие со сложными веществами
Взаимодействие с водой :
Взаимодействие с оксидами металлов:
Алюминий – хороший восстановитель, так как является одним из активных металлов. Стоит в ряду активности сразу после щелочно-земельных металлов. Поэтому восстанавливает металлы из их оксидов. Такая реакция – алюмотермия – используется для получения чистых редких металлов, например таких, как вольфрам, ваннадий и др.
Термитная смесь Fe3O4 и Al (порошок) –используется ещё и в термитной сварке.
Взаимодействие с кислотами :
С холодными концентрированными серной и азотной не реагирует (пассивирует). Поэтому азотную кислоту перевозят в алюминиевых цистернах. При нагревании алюминий способен восстанавливать эти кислоты без выделения водорода:
2 Al + 2 NaOH + 6 H 2 O = 2 Na [ Al ( OH )4 ] + 3 H 2 ОПЫТ
По предложению химика Горбова, в русско-японскую войну эту реакцию использовали для получения водорода для аэростатов.
Если поверхность алюминия потереть солью ртути, то происходит реакция:
Выделившаяся ртуть растворяет алюминий, образуя амальгаму.
Обнаружение ионов алюминия в растворах : ОПЫТ
5. Применение алюминия и его соединений
Физические и химические свойства алюминия обусловили его широкое применение в технике. Крупным потребителем алюминия является авиационная промышленность: самолет на 2/3 состоит из алюминия и его сплавов. Самолет из стали оказался бы слишком тяжелым и смог бы нести гораздо меньше пассажиров. Поэтому алюминий называют крылатым металлом. Из алюминия изготовляют кабели и провода: при одинаковой электрической проводимости их масса в 2 раза меньше, чем соответствующих изделий из меди.
Учитывая коррозионную устойчивость алюминия, из него изготовляют детали аппаратов и тару для азотной кислоты. Порошок алюминия является основой при изготовлении серебристой краски для защиты железных изделий от коррозии, а также для отражения тепловых лучей такой краской покрывают нефтехранилища, костюмы пожарных.
Оксид алюминия используется для получения алюминия, а также как огнеупорный материал.
Гидроксид алюминия – основной компонент всем известных лекарств маалокса, альмагеля, которые понижают кислотность желудочного сок.
Соли алюминия сильно гидролизуются. Данное свойство применяют в процессе очистки воды. В очищаемую воду вводят сульфат алюминия и небольшое количество гашеной извести для нейтрализации образующейся кислоты. В результате выделяется объемный осадок гидроксида алюминия, который, оседая, уносит с собой взвешенные частицы мути и бактерии.
Таким образом, сульфат алюминия является коагулянтом.
6. Получение алюминия
Видео YouTube
Валентность и степень окисления
Валентность
Определяют валентность по числу связей, которые один атом образует с другими. Для примера рассмотрим две молекулы
Для определения валентности нужно хорошо представлять графические формулы веществ. В этой статье вы увидите множество формул. Сообщаю вам также о химических элементах с постоянной валентностью, знать которые весьма полезно.
В электронной теории считается, что валентность связи определяется числом неспаренных (валентных) электронов в основном или возбужденном состоянии. Мы касались с вами темы валентных электронов и возбужденного состояния атома. На примере фосфора объединим эти две темы для полного понимания.
Подавляющее большинство химических элементов обладает непостоянным значением валентности. Переменная валентность характерна для меди, железа, фосфора, хрома, серы.
Степень окисления
Численно степень окисления равна условному заряду, который можно приписать атому, руководствуясь предположением, что все электроны, образующие связи, перешли к более электроотрицательному элементу.
Зная изменения электроотрицательности в периодах и группах периодической таблицы Д.И. Менделеева, можно сделать вывод о том какой элемент принимает «+», а какой минус. Помогают в этом вопросе и элементы с постоянной степенью окисления.
Самостоятельно определите степени окисления атомов в следующих веществах: RbOH, NaCl, BaO, NaClO3, SO2Cl2, KMnO4, Li2SO3, O2, NaH2PO4. Ниже вы найдете решение этой задачи.
Сравнивайте значение электроотрицательности по таблице Менделеева, и, конечно, пользуйтесь интуицией 🙂 Однако по мере изучения химии, точное знание степеней окисления должно заменить даже самую развитую интуицию 😉
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Блиц-опрос по теме Валентность и степень окисления
Степень окисления и физические свойства алюминия
Степень окисления алюминия характеризует валентность химического элемента, отражает его способность образовывать соединения. Это свойство учитывается при разведке месторождений руд, богатых на ценный компонент, технологии их обогащения, очистки от примесей второстепенных соединений и применении в разных отраслях производства.
Физические и химические параметры элемента
Алюминий — химический элемент с атомным номером 13, представляющий собой металл серебристо-белого цвета. Его название происходит от латинского слова alumen — квасцы. Практически во всех соединениях химический элемент проявляет валентность 3.
Технологии извлечения алюминия
Химический элемент № 13 является самым распространенным в природе, его содержание в земной коре составляет около 9%. Металл входит в состав более 250 минералов, главным образом, алюмосиликатов, из которых состоит земная кора.
Продуктом разрушения образований является глина, состоящая из каолинита. В ней иногда содержится примесь железа, придающая бурый цвет.
Несмотря на то, что в природе существует много минеральных образований, не все они являются рудным материалом для извлечения ценного компонента. Для добычи используют бокситовые руды, в которых содержится промышленная концентрация металла.
Алюминий образует минерал корунд, по твердости уступающий алмазу. Содержание в алюминиевом соединении Al2O3 примеси оксида хрома, титана и железа формирует драгоценные минералы рубин и сапфир.
Широко применяется в производстве чистого алюминия химический способ. Он состоит в обработке руды щелочью NaOH при температуре 220 °C с получением Al (OH)2. В результате гидролиза раствора происходит окисление алюминия и осаждение его соединения.
Потом в результате использования углекислого газа получают соду и поташ. Для получения химически чистого материала технический материал нагревают в парах AlF3 с последующим охлаждением. В результате изменения температуры происходит выделение чистого алюминия.
Производство металла высокой чистоты предусматривают разработку новых технологий и создание условий, при которых металл может оксидировать без дополнительных затрат энергии.
Один из новых методов предусматривает синтез оксида алюминия высокой чистоты методом каталитического окисления металла кислородом воды с применением ультразвуковых колебаний, разработку автокаталитического способа получения субмикронного порошка с последующим формирование брикет высокой плотности.
Сферы использования металла и его соединений
Значительное количество алюминия находится в фарфоре, кирпиче, цементе. По масштабам использования сплавы металла уступают место железу. Широкое применение алюминиевых материалов в различных отраслях связано с рядом физических и химических параметров:
При добавлении разных лигатурных компонентов сплавы на основе алюминия приобретают новые свойства, формируя интерметаллические соединения или твердые растворы.
Не все материалы способны образовывать оксидные пленки даже принудительно. Для сохранения антикоррозионных свойств материала кислотно-щелочной баланс должен соответствовать диапазону от 6 до 8 единиц.
Чистый алюминий практически не подвергается воздействию агрессивной среды. Даже тонкое покрытие поверхности металлом без примесей способно предотвратить реакцию.
Основную массу металла используют для получения легких сплавов:
В металлургии химический элемент используют в качестве лигатурной добавки в составы на основе меди, никеля, железа, магния. Такие соединения широко применяются в автомобилестроении, в быту, авиационной технике.
Из сплава с основным содержанием алюминия был изготовлен первый искусственный спутник планеты Земля. В виде порошка его используют как компонент ракетного топлива. Эта идея принадлежит Ф. А. Цандеру. Сплав металла с цирконием используют в строительстве ядерных реакторов, изготовлении взрывчатых материалов.
Электрохимическим способом на поверхности ювелирной бижутерии наносят защитные окрашенные пленки, по внешнему виду напоминающие золото. Сплав алюминия с золотом, обладающий насыщенным фиолетовым цветом, используют в качестве вставок в украшения.
При обращении с металлом в домашних условиях нужно соблюдать правила эксплуатации посуды из алюминия. Чтобы продукты не окислились, то их стоит хранить в эмалированной или стеклянной посуде.
Готовить в посуде из алюминия можно нейтральные жидкости, например, воду или молоко. Кислые блюда реагируют с металлом и приобретают неприятный вкус в результате разрушения оксидной пленки.
Металл можно расплавить в домашних условиях с целью изготовления различных деталей методом литья. В промышленном производстве в качестве материала для форм используют металл с высшей температурой плавления, а в кустарных условиях для этой цели применяют гипс.