какие существуют основные противопоказания к парентеральному питанию в послеоперационном периоде
Питание в послеоперационный период
Изменения в метаболизме после операций или травмы являются фактором риска послеоперационных осложнений.
Показатели обмена веществ у пациента влияют на скорость, с какой он восстановится после операции или травмы. Если ответ организма на вмешательство мощный, то человек истощается, слабеет иммунитет, может легко присоединиться инфекция. Это осложняет процесс восстановления. Почему так происходит?
Как организм реагирует на операцию или травму
При операции и травме в кровь пациента поступают гормоны стресса и цитокины. Цитокины – вещества, которые регулируют воспалительные процессы в организме. Воспаление – реакция организма на различные повреждения. Эта реакция активизирует защитные силы организма – потому что через любую рану может попасть инфекция. Выброс в кровь цитокинов и гормонов стресса изменяет обмен веществ. Что это за изменения? Запускается процесс расщепления гликогена – тратится энергетический запас организма. В качестве дополнительных источников энергии перерабатываются жиры из жировой ткани и белки из мышц. Расход белка на энергетические потребности не позволяет использовать его на первоочередные нужды: создание новых клеток и тканей, т.е. заживление раны. Это мешает восстановлению пациента после хирургического вмешательства:
Чтобы улучшить прогноз для больного, нужно снабжать его организм дополнительными питательными веществами, которые дают легкоусвояемую энергию и белок. Профилактика общего истощения положительно влияет на иммунитет, повышая защитные силы всего организма. Даже минимальное питание оказывает лечебное действие на клетки слизистой кишечника, сохраняя барьерную функцию желудочно-кишечного тракта по отношению к микробам.
Одна из составляющих поддержки больного на пути к его выздоровлению – нутритивная терапия. Это питание для пациента, которое направлено на профилактику или лечение истощения. В нутритивную терапию входит питание через рот – обычная или лечебная диета, энтеральное и парентеральное питание.
Какому хирургическому пациенту нужна нутритивная терапия?
— больному без признаков истощения, если ожидается, что он не сможет есть больше 5 дней, или у него будут проблемы с приемом достаточного количества пищи через рот (меньше 60% больше 7 дней)
— больному, у которого возможен риск послеоперационных осложнений, связанных с питанием. Скрининг риска проводится, когда у пациента
Своевременная профилактика недостаточного питания заметно влияет на исход заболевания. Как это выглядит в цифрах – читайте статистику ниже.
Немного статистики исследований «прогностическое влияние состояния питания на осложнения и летальность»
Раннее начало питания после операций может показаться особенно сомнительным в случае хирургических вмешательств на желудочно-кишечном тракте. Но даже здесь – при соблюдении правил проведения нутритивной поддержки – снижается процент осложнений и время, проведенное в больнице. Это показано в Кокрейновском обзоре 2 о влиянии раннего энтерального питания на частоту осложнений после операций на желудочно-кишечном тракте. Кокрейн – это некоммерческая организация, которая анализирует опубликованные медицинские исследования и проверяет их на соответствие принципам доказательной медицины.
Авторы обзора отобрали 14 исследований, включавших 1224 пациента. По этим работам они заключили, что начало нутритивной поддержки в течение 24 часов после операции сокращает пребывание в больнице на 1 день и уменьшает частоту некоторых осложнений:
В качестве нутритивной терапии подходят сбалансированные по питательным веществам, витаминам и микроэлементам специальные смеси.
Продукты Nutrien Stadard и Nutrien Energy для восстановления организма после операции
К таким смесям относятся Nutrien Standard и Nutrien Energy. Это универсальные лечебные продукты, которые подходят для перорального приема и энтерального питания через зонд после операций и травм.
Обе смеси содержат:
молочный белок, который легко усваивается,
полиненасыщенные жирные кислоты (омега-3), которые способствуют противовоспалительному и иммуномодулирующему действию,
жиры, которые не перегружают поджелудочную железу, легко усваиваются и дают быстро и много энергии,
Nutrien Energy отличается большей концентрацией белка и энергии, витаминов и минералов, и лучше подходит для более поздней, длительной реабилитации, когда желудочно-кишечный тракт восстановился после операционного стресса. Какая из этих смесей лучше подойдет? Для точного ответа получите рекомендации от лечащего врача.
Нутритивная терапия статистически улучшает прогноз хирургического пациента, но нюансы поддержки с помощью питания могут отличаться у разных больных. Чтобы получить только пользу от лечебных смесей, важно не только понимать, как организовать свое питание после операции, но и действовать согласованно с лечащим врачом или диетологом.
Парентеральное питание в терапевтической практике
Парентеральным питанием (от греч. рara — около + enteron — кишка) называют обеспечение организма питательными ингредиентами (нутриентами) минуя желудочно-кишечный тракт. Парентеральное питание может быть полным, когда все питательные вещества вводят в со
Парентеральным питанием (от греч. рara — около + enteron — кишка) называют обеспечение организма питательными ингредиентами (нутриентами) минуя желудочно-кишечный тракт. Парентеральное питание может быть полным, когда все питательные вещества вводят в сосудистое русло (больной не пьет даже воду), частичным (неполным), когда используют только основные питательные вещества (например, белки и углеводы), и вспомогательным, когда питание через рот недостаточно и требует дополнения.
Патофизиология голодания. В организме взрослого человека главным фактором, определяющим нормальный баланс процессов обмена веществ, является cоотношение между поступлением пищи и расходом энергии.
Если человека лишить пищи, в первую очередь снижается содержание глюкозы в крови и, как следствие, секреция анаболического гормона инсулина. Одновременно повышается секреция катаболического гормона глюкагона, стимулирующего гликогенолиз в печени. Таким образом, запасы гликогена в печени истощаются.
Начиная со вторых суток голодания, глюкагон активирует гормончувствительную липазу, благодаря чему высвобождается большее количество жирных кислот, при окислении которых возрастает уровень кетоновых тел. Если уровень их образования превосходит скорость утилизации, развивается метаболический ацидоз.
При продолжении голодания источниками энергии становятся тканевые белки. Первыми мобилизуются лабильные белки желудочно-кишечного тракта и циркулирующей крови, затем распадаются белки внутренних органов и мышц и последними — белки нервной системы.
Таким образом, голодание в известном смысле можно рассматривать как состояние, при котором организм для удовлетворения своих энергетических потребностей «пожирает сам себя».
Основными целями парентерального питания являются:
Показания к парентеральному питанию. Среди показаний к парентеральному питанию в стационаре выделяют:
а) больной не может питаться через рот (после травм и вмешательств в области лицевого черепа, на пищеварительном тракте);
б) больной не должен питаться через рот.
Случаи целесообразности энтерального питания возникают в послеоперационном периоде у больных с кишечной непроходимостью, панкреонекрозом, после оперативных вмешательств на желудочно-кишечном тракте, а также при воспалительных заболеваниях кишечника (болезнь Крона, неспецифический язвенный колит, илеус);
Такое происходит при травмах черепа и мозга, тяжелых ожогах, состоянии стойкого катаболизма после обширных операций и травм, гнойно-деструктивных процессах с генерализацией высоко инвазивной инфекции. Парентеральное питание рекомендуется при дистрофической форме застойной сердечной недостаточности, реабилитации глубоко астенизированных больных, при тяжелых инфекционных болезнях с предельным катаболизмом, у неврологических больных с распространенными поражениями нервной системы — от инсультов до демиелинизирующих заболеваний;
Достижение описанных целей возможно только при соблюдении следующих условий: адекватная нагрузка жидкостью, достаточная масса быстро усвояемых энергодающих нутриентов, обеспечивающих усвоение достаточного количества ионов калия и условного белка в виде аминокислот в количестве не менее 0,5 г/кг массы тела.
Перед началом парентерального питания необходимо проведение следующих мероприятий:
Расчет потребности в парентеральном питании. Для этого требуется оценка питания больного. Чтобы определить изначальный уровень питания больного, используют показатель массо-ростового индекса (МРИ): МРИ=МТ(кг)/ м 2 (рост).
В норме МРИ равен 21–25 кг/м 2 ; менее 20 кг/м 2 означает отчетливое снижение питания; 17 кг/м2 — значительное снижение питания; менее 16 кг/м 2 — предельное истощение.
Другим ориентировочным показателем питательного статуса является отношение фактической массы тела (ФМТ) к идеальной массе тела (ИМТ), выраженное в %: ИМТ= Рост (см) — 100.
Снижение отношения ФМТ/ИМТ до 80% означает слабую степень белково-энергетической недостаточности; снижение в пределах 70–80% — умеренную недостаточность; снижение до 70% и менее — тяжелую степень белково-энергетической недостаточности.
Одним из наиболее полезных биохимических показателей в оценке питательного статуса, эффективности проводимой нутритивной терапии считается креатинин, 98% которого содержится в скелетных мышцах, преимущественно в виде креатининфосфата. Для расчета мышечной массы используют индекс креатинина (ИК) — отношение суточной экскреции креатинина (г) к росту (см).
В норме ИК = 10,5. При слабой степени белково-энергетической недостаточности ИК = 9,5–8,4.
Определение энергетической потребности. Минимальные энергетические затраты организма в условиях относительно полного физического и эмоционального покоя (в состоянии бодрствования, натощак) определяются как основной обмен (ОО).
ОО (ккал/сут) в покое можно рассчитать по уравнению Харриса–Бенедикта:
ОО = 66,5 + (13,75 х М) + (5 х Р) — (6,7 х В), где М — масса тела (кг), Р — рост (см), В — возраст (годы).
Также возможно использование упрощенной и, соответственно, менее точной формулы ОО = 25 Ё М.
Расчет действительной энергетической потребности больного (ДПЭ) (ккал/сут) производят по формуле
ДПЭ = ОО х ФА х ФУ х ТФ х ДМТ, где ФА — фактор активности: постельный режим — 1,1; полупостельный — 1,2; ходячий — 1,3;
ФУ фактор увечья: после небольших операций — 1,1; большие операции — 1,3; перитонит — 1,4; сепсис — 1,5; множественные травмы — 1,6; черепно-мозговая травма — 1,7 [3];
ТФ — температурный фактор: 38,0°С — 1,1; 39,0°С — 1,2; 40,0°С — 1,3; 41,0°С — 1,4.
Энергию организм получает в основном за счет углеводов и жиров. При окислении 1 г жира выделяется около 9 ккал (38 кДж), в то время как 1 г углеводов обеспечивает около 4 ккал (17 кДж) и 1 г белка или аминокислот — около 5 ккал (23 кДж).
В программе парентерального питания рекомендуемая доля калорийности, получаемая благодаря жировым эмульсиям, составляет 35–40%, глюкозе — 40–45% и аминокислотам — 5–15% [3].
В таблице приведены рекомендованные величины основных компонентов парентерального питания. Рекомендации по дозам аминокислот, глюкозы, липидов и энергетической нагрузке не зависят от типа питания: полное парентеральное питание, энтеральное или смешанное.
Углеводы. В современном парентеральном питании используют главным образом глюкозу, хотя, по мнению некоторых авторов, возможно применение фруктозы, сорбитола и ксилитола. Учитывая ряд нежелательных влияний глюкозы в высоких концентрациях (более 20%) на кислотно-основное состояние (ацидоз), миокард (угнетение его функции), не рекомендуется применение растворов глюкозы в концентрации свыше 20–25%. Максимальная скорость утилизации глюкозы при внутривенном введении составляет 0,75 г/кг в 1 ч. Превышение отмеченной скорости введения препарата приводит к осмотическому диурезу.
Сорбитол фосфорилируется в печени во фруктозо-6-фосфат. Инсулин не действует ни на сорбитол, ни на фруктозу, что делает их инсулиннезависимыми источниками энергии. При их применении не возникает гипергликемический ацидоз, который встречается в случаях, когда для парентерального питания используются препараты, содержащие глюкозу.
Суточная потребность в глюкозе составляет от 2 г/кг (не менее, иначе глюкоза начинает синтезироваться из аминокислот) до 6 г/кг. Инсулин показан из расчета 1 ЕД на 4–6 г глюкозы.
Использование более концентрированных растворов глюкозы (20–40%) возможно для пациентов, требующих ограничения объема инфузии.
Аминокислоты и белки. Определение суточной потребности в белке. Среди лабораторных показателей, отражающих показатели белкового обмена, выделяют содержание сывороточного альбумина, трансферрина, преальбуминов и протеинов, связанных с ретинолом. Снижение концентрации этих протеинов в сыворотке происходит в результате повышенного катаболизма и снижения синтеза белков. Наибольшую информативность содержат лабильные белки с коротким периодом полужизни — преальбумины.
Ориентировочно приводят следующие цифры суточной потребности в белке: минимальное количество — 0,54 г/кг/сут, рекомендованное количество — 0,8 г/кг/сут; при усиленном катаболизме (катаболический статус) — 1,2 —1,6 г/кг/сут.
Об адекватности суточного поступления белка судят по величине азотистого баланса (АБ), определяющего разницу между потреблением и потерями азота и рассчитываемого по следующей формуле:
АБ (г) = (количество потребленного белка/ 6,25) — (АМ + 4), где АМ — содержание азота в моче, собранной за 24 ч.
Коэффициент 6,25 отражает пересчет содержания азота в содержание белка (в 6,25 г белка содержится 1 г азота). Поправка 4 учитывает азот, выделенный не с мочой. При диарее, кровопотере или усиленном отторжении некротизированных тканей внепочечные потери азота принимают равными 6 г/сут.
Зная количество распавшегося белка, также можно оценить суточную потребность в энергии, с учетом того, что на окисление 1 г белка требуется от 150 до 180 ккал.
Современным стандартом является применение в качестве белковой составляющей только растворов кристаллических аминокислот. Гидролизаты белков в настоящее время полностью исключены из клинической практики парентерального питания.
Общая доза вводимых аминокислот составляет до 2 г/кг в сутки, скорость введения — до 0,1 г/кг в час.
Общепринятых требований (в том числе ВОЗ) к растворам аминокислот не существует, однако большинство рекомендаций для растворов аминокислот для парентерального питания включает следующее:
К незаменимым аминокислотам относятся изолейцин, фенилаланин, лейцин, треонин, лизин, триптофан, метионин, валин. Однако перечисленные выше аминокислоты являются незаменимыми лишь для здорового и взрослого организма. Следует учитывать, что 6 аминокислот — аланин, глицин, серин, пролин, глутаминовая и аспарагиновая кислоты — синтезируются в организме из углеводов. Четыре аминокислоты (аргинин, гистидин, тирозин и цистеин) синтезируются в недостаточном количестве.
Аминокислоты, введенные в организм внутривенно, входят в один из двух возможных метаболических путей: анаболический путь, в котором аминокислоты связываются пептидными связями в конечные продукты — специфические белки, и метаболический путь, при котором происходит трансаминация аминокислот.
Аминокислота L-аргинин способствует оптимальному превращению аммиака в мочевину, связывая при этом токсичные ионы аммония, которые образуются при катаболизме белков в печени. L-яблочная кислота необходима для регенерации L-аргинина в этом процессе и как энергетический источник для синтеза мочевины.
Наличие в препаратах заменимых аминокислот L-орнитин-аспартата, L-аланина и L-пролина уменьшает потребность организма в глицине.
Орнитин стимулирует глюкозоиндуцированную выработку инсулина и активность карбамоилфосфатсинтетазы, что способствует увеличению утилизации глюкозы периферическими тканями, синтезу мочевины и, в сочетании с аспарагином, уменьшению содержания аммиака.
Кроме «чистых» растворов аминокислот существуют растворы с энергетическими и электролитными добавками.
Из энергетических компонентов, помимо глюкозы, могут добавляться сорбитол или ксилитол, применение которых рекомендуется не всеми авторами. Сорбитол является лучшим, чем глюкоза, растворителем аминокислот, так как не содержит альдегидных и кетоновых групп и, таким образом, не связывается с аминогруппами в комплексы, снижающие действие аминокислот.
Так, вамин EF содержит глюкозу, аминосол, полиамин и хаймикс — сорбитол, инфезол 40 — ксилитол.
Ион натрия является основным катионом экстрацелюллярной жидкости и вместе с анионом хлорида является важнейшим элементом для поддержания гомеостаза. Ион калия — основной катион интрацеллюлярной жидкости. Было обнаружено, что позитивного баланса азота в организме при общем парентеральном питании можно достичь только при добавлении в инфузионный раствор ионов калия.
Ион магния важен для сохранения целостности митохондрий и для возбуждения импульса в мембранах нервных клеток, миокарде и мышцах скелета, а также для передачи высокоэнергетических фосфатов при синтезе аденозинтрифосфата. У больных на длительном парентеральном питании гипомагнезиемия часто сопровождается гипокалиемией.
Содержащийся в растворах фосфор активизирует глюкозофосфатный цикл.
Электролиты содержат следующие растворы аминокислот: аминосол, инфезол 40 и 100, аминоплазмаль Е.
Дополнение стандартных растворов аминокислот витаминами комплекса В (рибофлавин, никотинамид, пантенол и пиридоксин) обусловлено их ограниченными резервами в организме и необходимостью ежедневного введения, особенно при длительном полном парентеральном питании [1].
Специализированные растворы аминокислот. При различных патологических состояниях имеются особенности в проявлении нарушений обмена. Соответственно меняется количественная и качественная потребность в аминокислотах, вплоть до возникновения избирательной недостаточности отдельных аминокислот. В связи с этим для патогенетически направленного метаболического лечения и парентерального питания были разработаны и широко применяются в клинической практике специальные растворы аминокислот (аминокислотные смеси направленного действия).
Отличительной особенностью растворов аминокислот для больных с печеночной недостаточностью (аминостерил N-гепа, аминоплазмаль гепа (является снижение содержания ароматических (фенилаланин, тирозин) аминокислот и метионина с одновременным увеличением содержания аргинина до 6–10 г/л и разветвленных незаменимых аминокислот (валин, лейцин, изолейцин) — до 43,2 г/л.
Количество аргинина увеличивается для обеспечения функции цикла мочевины и тем самым активации детоксикации аммиака в печени и предупреждения гипераммониемии. Исключение ароматических аминокислот из смесей обусловлено тем, что при печеночной недостаточности в плазме повышается концентрация ароматических аминокислот и метионина. Одновременно концентрация разветвленных аминокислот снижается. Увеличение транспорта ароматических аминокислот в головной мозг усиливает синтез патологических медиаторов, вызывающих симптомы печеночной энцефалопатии. Введение препаратов с повышенным содержанием разветвленных незаменимых аминокислот уменьшает эти проявления. Поскольку эти аминокислотные растворы содержат все незаменимые и широкий спектр заменимых аминокислот, они оказывают корригирующее влияние на метаболические процессы и применяются для парентерального питания.
Для парентерального питания и лечения больных с острой и хронической почечной недостаточностью применяют специальные растворы аминокислот: аминостерил КЕ нефро безуглеводный, нефротект, нефрамин, с определенным соотношением аминокислот. Соотношение незаменимых аминокислот и заменимых в таких растворах составляет 60:40. Кроме того, препараты данной группы содержат восемь незаменимых аминокислот и гистидин (5 г/л), что дает возможность при их введении снизить азотемию. За счет взаимодействия специально подобранного спектра аминокислот с азотистыми остатками происходит выработка новых заменимых аминокислот и синтез белка. В результате уменьшается уремия. Концентрация аминокислот в таких растворах находится в пределах 57%. Отсутствуют углеводы и электролиты или количество электролитов в растворе минимально [1].
Жировые эмульсии. Другим источником энергообеспечения являются жировые эмульсии.
Жировые эмульсии обычно применяют в долговременных программах нутритивной поддержки, особенно в тех случаях, когда парентеральное питание продолжается более 5 дней и возникает необходимость в покрытии дефицита незаменимых жирных кислот.
Незаменимые жирные кислоты являются структурными компонентами всех клеточных мембран и способствуют восстановлению их структур, проницаемости и осмотической резистентности. Кроме того, ненасыщенные жирные кислоты как предшественники простагландинов, тромбоксанов и лейкотриенов играют важную роль в восстановлении метаболических и газообменных функций легких, обеспечивают транспорт жирорастворимых витаминов, являются модуляторами иммунных процессов.
Кроме нутритивного эффекта, жировые эмульсии осуществляют еще следующие функции:
В настоящее время доступны жировые эмульсии нескольких типов.
Клинические эффекты применения физической смеси средне- и длинноцепочечных триглицеридов не отличаются от жировых эмульсий на основе длинноцепочечных триглицеридов. Метаанализ D. Heyland и соавторов (2003) [15] показал отсутствие каких-либо преимуществ физической смеси триглицеридов перед общепринятыми жировыми эмульсиями.
Общепринятые жировые эмульсии, содержащие длинноцепочечные триглицериды с 16–20 атомами углерода, следует рассматривать как наиболее безопасные и отдавать им предпочтение как базовой жировой эмульсии, которая в зависимости от состояния больного может дополняться эмульсией на основе рыбьего жира.
Суточная доза жировых эмульсий составляет до 2 г/кг в сутки, при печеночной недостаточности, энцефалопатии — до 1,5 г/кг в сутки. Скорость введения — до 0,15 г/кг/ч.
Жировые эмульсии противопоказаны при нарушении жирового обмена, расстройствах в системе гемостаза, беременности, остром инфаркте миокарда, различных эмболиях, нестабильном диабетическом обмене веществ, шоке.
Осложнения парентерального питания. Среди осложнений полного парентерального питания выделяют механические, метаболические, гнойно-септические осложнения и аллергические реакции.
Механические осложнения представляют собой технические осложнения катетеризации центральных вен (пневмоторакс, перфорация подключичной вены/артерии, повреждение грудного лимфатического протока, гемоторакс, гидроторакс, паравазальная гематома), различные виды эмболий, тромбоз и тромбофлебит.
Метаболические осложнения включают:
Гнойно-септические осложнения подразумевают инфицирование в месте введения препарата и генерализацию инфекции [4].
Таким образом, парентеральное питание можно рассматривать как фармакотерапию метаболических нарушений и единственный путь обеспечения энергопластических потребностей организма в постагрессивном периоде, требующих наличия специально подобранных композиций питательных веществ.
Литература
В. Г. Москвичев, кандидат медицинских наук
Р. Ю. Волохова
МГМСУ, Москва
Парентеральное питание и гидратация в паллиативной помощи
У большинства паллиативных пациентов возникают проблемы с нутритивным статусом, вследствии чего им требуется парентеральное питание. О том, когда его следует назначать, а когда — нет, можно ли совмещать энтеральное и парентеральное питание и многое другое о нутритивной поддержке рассказала Варвара Брусницына, заведующая отделением длительной респираторной поддержки и отделением паллиативной помощи №3, врач анестезиолог-реаниматолог, врач реабилитолог ГБУЗ «Московский многопрофильный центр паллиативной помощи» ДЗМ.
Статья подготовлена по материалам вебинара из цикла «Врачи врачам»
Как оценить нутритивный статус пациента?
Первое, что необходимо сделать — это оценить тяжесть состояния пациента и его жизненный прогноз. Условно (поскольку четких критериев в паллиативе не существует) всех пациентов можно разделить на две группы:
Обе группы пациентов оцениваются субъективно и объективно.
Субъективная оценка — это мнение врача, которое он составляет о пациенте, просто осматривая его.
Если врач видит снижение или отсутствие подкожно-жировой клетчатки, дряблость кожных покровов, то, скорей всего, сделает вывод, что пациент получает плохое питание или\и его болезнь прогрессирует.
Оценить состояние подкожно-жировой клетчатки довольно просто. Для этого существует специальный прибор, но им вряд ли располагает врач патронажной службы, к тому же без него можно легко обойтись. Для измерения нужно зажать кожную складку под углом лопатки или над трицепсом в средней части плеча и примерно оценить расстояние между пальцами. В норме оно должно быть 1-2 сантиметра. Расстояние меньше одного сантиметра означает, что истощаются запасы жировой клетчатки вследствии их большого расхода, либо пациент недоедает, либо из-за заболевания у него слишком высокий катаболизм.
Всегда проверяйте состояние подкожно-жировой клетчатки, даже если человек выглядит нормально.
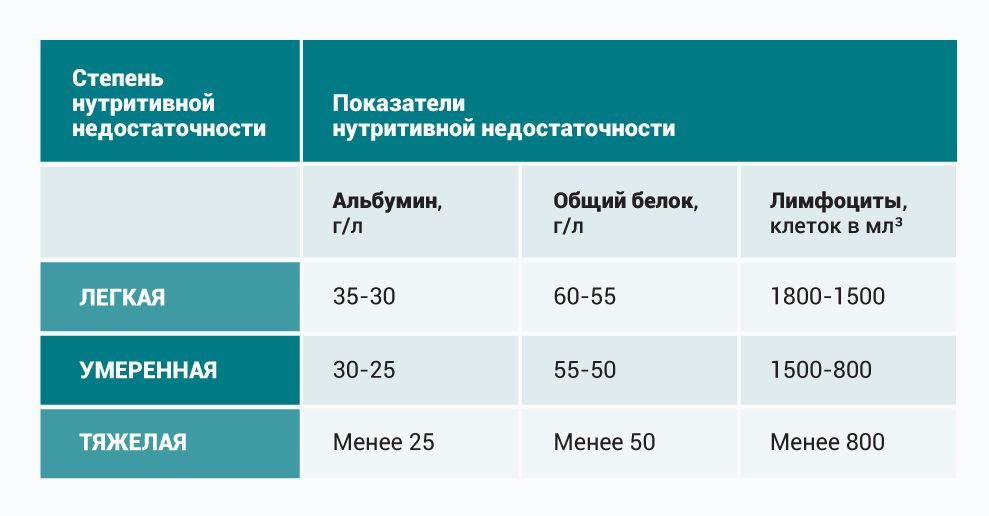
Критерии субъективной оценки клинических признаков нутритивной недостаточности:
Объективная оценка — это точные показатели, полученные в результате измерений или обследований.
Шаг 1. Измерение индекса массы тела.
Примеры: