какие свечи противовирусные для детей лучше 2 года
Свечи от простуды и гриппа для детей и беременных женщин

Суппозитории (в переводе с латинского suppositorium – подставка) – это дозированная лекарственная форма, твердая в обычных условиях и легко расплавляющаяся при температуре, равной температуре тела. Как лекарственная форма суппозитории существуют с незапамятных времен. По крайней мере, в древнеегипетском папирусе Эберса (
1500 год до н. э.) среди 800 различных лекарств была указана форма ректальных свечей. Само слово «суппозиторий» появилось в медицинской практике в XVII веке (от лат. suppositorius – находящийся внизу, от suppono – кладу под, прикладываю снизу).
Особенно важным быстродействие лекарства может быть при лечении ОРВИ, в том числе гриппа, когда необходимо купировать неприятные симптомы и предотвратить развитие осложнений.
Суппозитории: скорость действия и комфорт применения
Ректальные суппозитории чаще всего выпускаются в виде:
Его масса обычно колеблется от 1 до 4 грамм для взрослых, а для детей – 0,5-1,5 грамм. Одной из самых комфортных в применении форм является форма в виде конуса, так как суппозитории такой формы легко вводятся и без усилий преодолевают кольцевой сфинктер прямой кишки.
Суппозитории содержит основное действующее (активное) вещество и формирующие его вспомогательные компоненты.
Масло какао (Oleum Cacao, Butyrum Cacao), которое применяется при производстве ряда суппозиториев в качестве основы, относится к липофильным (нерастворимым в воде) основам. Температура плавления масла какао – 30-34° С. Благодаря такой температуре суппозитории на основе масла какао плавятся быстро. Особенно это актуально для лечения маленьких детей.
Масло какао содержит фосфолипиды, которые позволяют не использовать в производстве синтетические токсичные эмульгаторы, а присутствие полиненасыщенных жирных кислот облегчает введение и растворение препарата. Важно помнить, что масло какао в отличие от порошка какао не содержит растительных аллергенов, что тем самым минимизирует риск развития аллергии. Однако, поскольку это масло является импортным продуктом, далеко не все российские компании могут позволить производство лекарственных препаратов с содержанием этого ингредиента.
Свечи или таблетки: что лучше при простуде и гриппе
Существует ряд особенностей суппозиториев, отличающих их от других лекарственных форм выпуска препаратов:
Однако, несмотря на вышеперечисленные особенности суппозиториев, не стоит однозначно утверждать, что для лечения простудных и любых других заболеваний необходимо выбирать только свечи. Назначать препараты и подбирать их форму должен врач с учетом индивидуальных особенностей пациента, его анамнеза, возраста и состояния здоровья на данный момент.
Какие свечи можно ставить детям при ОРЗ и ОРВИ
Как только ребенок заболел, необходимо обратиться к педиатру, ведь даже самое эффективное и популярное лекарство может не подойти ребенку, став причиной серьезных осложнений. И только после этого приступать к терапии.
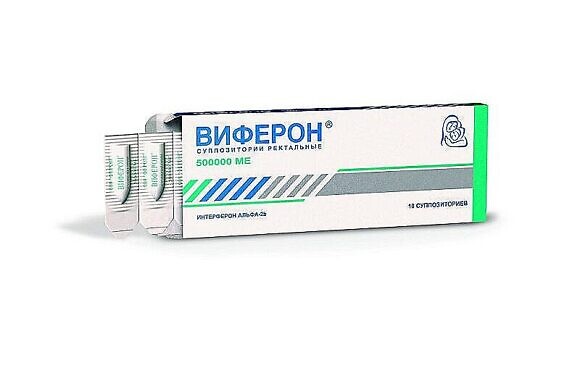
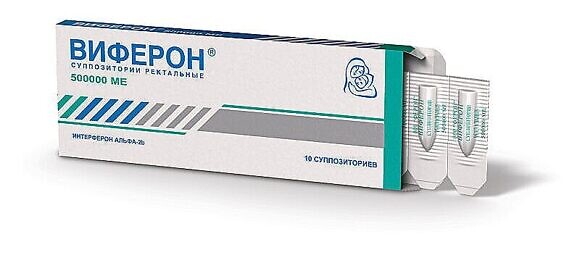
Для лечения детей при простуде и гриппе применяются суппозитории с содержанием интерферона – белковых молекул, которые отвечают за противовирусный иммунитет. Одним из таких препаратов является иммуномодулирующий препарат ВИФЕРОН Свечи, обладающий противовирусным действием. Он производится в виде ректальных суппозиториев пулевидной формы бело-желтого или желтого цвета с воронкообразным углублением. Один суппозиторий содержит в качестве активного вещества интерферон альфа-2b человеческий рекомбинантный в дозировках 150 000, 500 000, 1 000 000 и 300 000 МЕ. Для лечения гриппа и ОРВИ применяется препарат ВИФЕРОН Свечи 150 000 МЕ и 500 000 МЕ.
Оригинальная формула препарата ВИФЕРОН Свечи, сочетающая интерферон альфа-2b и высокоактивные антиоксиданты-витамины С и Е, не только блокирует вирус, но и помогает восстанавливать иммунитет. В основе суппозиториев – масло какао, о котором упоминали выше. Оно делает применение суппозиториев легким и удобным для детей любого возраста и взрослых. Препарат ВИФЕРОН занимает первое место в России среди назначений препаратов педиатрами 2 при гриппе и ОРВИ.
Дозировки детских свечей ВИФЕРОН
Детям до 7 лет, в т.ч. новорожденным и недоношенным с гестационным возрастом более 34 недель, назначают ВИФЕРОН 150 000 ME по 1 суппозиторию 2 раза/сут через 12 ч ежедневно в течение 5 суток. Детям старше 7 лет назначают ВИФЕРОН 500 000 МЕ. По клиническим показаниям терапия может быть продолжена. Перерыв между курсами составляет 5 суток.
Гестационный возраст – это период, прошедший с зачатия. Поскольку точный момент зачатия редко бывает известен, гестационный возраст исчисляют от первого дня последнего менструального цикла.
Недоношенным новорожденным детям с гестационным возрастом менее 34 недель назначают ВИФЕРОН 150 000 ME по 1 суппозиторию 3 раза/сут через 8 ч ежедневно в течение 5 суток. По клиническим показаниям терапия может быть продолжена. Перерыв между курсами составляет 5 суток.
Как правильно поставить свечу ребенку?
Для того, чтобы у вас получилось поставить ребенку суппозиторий легко, быстро и без неприятных ощущений со стороны малыша, достаточно пошагово придерживаться несложных правил.
С более старшим ребенком можно поиграть в веселую игру, придумав историю о волшебной рыбке, ракете или корабле в виде свечи, которая несет здоровье и возможность быть бодрым и играть столько, сколько хочется.
Дозировка свечей ВИФЕРОН для беременных при простуде
В первом триместре
Применение лекарственных средств у беременных женщин предполагает оценку врачом соотношения пользы и риска в отношении матери и плода. При заболеваниях у будущих мам можно применять только надежные, проверенные временем препараты, которые разрешены для беременных женщин, что обязательно должно быть указано в инструкции. Один из таких препаратов – ВИФЕРОН. Этот препарат выпускается в виде суппозиториев, геля и мази.
Препараты ВИФЕРОН Гель и Мазь можно применять уже с первого триместра беременности, а суппозитории – с 14-й недели. При наружном и местном применении препарат в форме геля/мази оказывает действие только в очаге поражения. Для лечения ОРВИ, в том числе гриппа, в том числе осложненных бактериальной инфекцией, нанесение геля ВИФЕРОН на слизистую оболочку носовых ходов необходимо повторять 3-5 раз в день в течение 5 дней. Мазь наносят тонким слоем 3 раза в сутки. Количество препарата – одна горошина диаметром 0,5 см, примерный курс лечения – 5 суток.
Во втором и третьем триместре
Суппозитории ВИФЕРОН разрешены к применению с 14-ой недели беременности.
Рекомендуемая доза для будущих мам во втором и третьем триместрах – ВИФЕРОН 500 000 ME по 1 суппозиторию 2 раза/сут через 12 ч ежедневно в течение 5 суток. По клиническим показаниям терапия может быть продолжена.
Справочно-информационный материал
Противовирусные препараты для детей

Противовирусными лекарственными средствами называются препараты, используемые для лечения и в рамках профилактики заболеваний вирусной этиологии. По механизму действия их можно условно разделить на две группы:
Но как понять, помогут ли противовирусные препараты ребенку и не навредит ли его иммунитету такое вмешательство извне? Стоит ли доверять рекламе различных препаратов, в том числе недорогих, которая обещает молниеносно избавить ребенка от заболевания, и при этом без вреда для его организма?
Чтобы ответить на эти важные вопросы, необходимо сначала разобраться в том, что такое вирус, как он ведет себя при попадании в организм, как иммунная система реагирует на вторжение и чем ей могут помочь противовирусные препараты.
Как заболевание развивается у ребенка
Когда ребенок заражается вирусом, что чаще всего случается при общении с переносчиком заболевания, ДНК или РНК вируса сразу же атакует клетки с помощью особых ферментов. Обустроившись, вирус продуцирует синтез новых вирусных частиц, которые накапливаются в клетках и со временем, исчерпав все ресурсы, разрушают их. После гибели клеток и разрыва клеточных оболочек вирус выходит наружу и захватывает новые, пока еще здоровые клетки. Таким образом инфекция прогрессирует, вызывая неприятные и всем знакомые симптомы.
К сожалению, усилий организма бывает недостаточно, и когда заболевание все же развивается, требуется хорошее противовирусное средство.
Противовирусные препараты с тремя принципами действия
В настоящее время существуют препараты, борющиеся с вирусами, которые можно разделить на три группы.
По составу детские противовирусные препараты можно разделить на следующие категории:
Таблица противовирусных препаратов по возрастам
Противовирусные препараты для детей до 1 года
Для лечения младенцев применяются лекарственные препараты с содержанием аффинно-очищенных антител к человеческому гамма интерферону, к гистамину и к CD4. Также по разрешению педиатра для ребенка до года допустимо применять:
Противовирусные препараты для детей от 1 года до 2-х лет
В дополнение к тем препаратам, которые можно применять для лечения совсем маленьких детей, для ребенка в период с года до двух можно применять сироп, капсулы и порошок с содержанием альфа-глутамил-триптофана натрия (тимоген), аскорбиновой кислоты (витамин C) и бендазола гидрохлорида (дибазол). Препараты на основе интерферона, например в свечах, мазях и гелях, также применяются для возрастной группы 1-1,5-2 года.
Противовирусные препараты для детей от 3-х лет
Для борьбы с простудой и гриппом ребенку до трех лет можно давать препараты с содержанием умифеновира (метилфенилтиометил-диметиламинометил-гидроксиброминдол карбоновой кислоты этиловый эфир), Инозина Пранобекса, сополимера госсипола с карбоксиметилцеллюлозой и гомеопатические лекарства, куда входят аконит, бриония двудомная, фосфор, ипекакуана, посконник пронзеннолистный и гельземий вечнозеленый.
Противовирусные препараты для детей от 4-х лет
Для лечении ребенка, которому уже исполнилось четыре года, можно применять лекарства в виде таблеток, растворов и суспензий с содержанием меглюмина акридонацетата.
Противовирусные препараты для детей от 5 лет
Пятилетним детям от гриппа и других ОРВИ можно давать препараты, где основным действующим веществом является занамивир. Занамивир действует во внеклеточном пространстве, угнетая воспроизведение всех типов вируса ОРВИ и предотвращая выброс вирусных частиц из клеток поверхностного эпителия дыхательных путей.
Противовирусные препараты для детей от 6 лет
Для лечения ребенка, которому уже исполнилось 6 лет, можно использовать препараты, в состав которых входит азоксимера бромид. Такие препараты обладают иммуностимулирующим и дезинтоксикационным действием.
Противовирусные препараты для детей от 7 лет
Семилетнему ребенку можно давать препараты с содержанием натриевой соли двуспиральной рибонуклеиновой кислоты Saccharomyces serevisiae, ремантандина гидрохлорида, витаглутама (имидазолилэтанамид пентандиовой кислоты) и тилорона.
Противовирусные препараты для детей от 10-12 лет
Ребенка в этом возрасте можно лечить при помощи вышеперечисленных лекарств, которые подходят и для более младшего возраста при соблюдении необходимой дозировки. Симптоматические препараты, которые борются не с заболеванием, а только с его симптомами (например, уменьшают количество выделений из носа), необходимо принимать по рекомендации врача. Температуру до 38 0 С в большинстве случаев, при отсутствии показаний, лучше не сбивать.
Какие противовирусные препараты подойдут для ребенка любого возраста?
Таких препаратов не так много, но они есть. И один из них – это препарат ВИФЕРОН Свечи (суппозитории), который содержит интерферон альфа-2b человеческий рекомбинантный.
Виферон Свечи для детей детям до года и старше
Поскольку препарат ВИФЕРОН Свечи (суппозитории) обладает широким спектром противовирусной активности, он является универсальным средством против гриппа и ОРВИ. Этот препарат нового поколения помогает эффективно бороться с инфекцией на любой стадии заболевания. ВИФЕРОН обеспечивает мощный противовирусный эффект и позволяет сократить общую продолжительность заболевания, быстрее справиться с проявлениями инфекции (насморк, кашель, слабость, температура и др.), а также снижает вероятность развития осложнений и последующих заболеваний. 1
Виферон Гель детям до года и старше
Кроме того, для лечения детей всех возрастов, в том числе новорожденных, можно применять противовирусный препарат ВИФЕРОН Гель. Для того, чтобы уберечь ребенка от ОРВИ и гриппа, необходимо 2 раза в день в качестве профилактики наносить полоску геля длиной примерно 0,5 см на слизистую оболочку носа. Длительность курса – 2-4 недели. Для лечения ОРВИ, в том числе осложненных бактериальной инфекцией, нанесение геля ВИФЕРОН необходимо повторять 3-5 раз в день в течение 5 дней.
Виферон Мазь грудничкам до года детям старшего возраста
ВИФЕРОН Мазь применяют у детей старше года. Для лечения ОРВИ у детей от 1 года до 2-х лет применяется ВИФЕРОН Мазь 2500 МЕ (1 горошина диаметром 0,5 см) 3 раза в сутки, у детей от 2-х до 12 лет – мазь 2500 МЕ (1 горошина диаметром 0,5 см) 4 раза в сутки, у детей от 12 до 18 лет – мазь 5000 МЕ (1 горошина диаметром 1 см) 4 раза в сутки. Длительность лечения составляет 5 дней. Совместное применение суппозиториев ВИФЕРОН и ВИФЕРОН Мазь/Гель позволяет усилить клинические эффекты проводимой терапии. 2
Автор статьи
Врач общей практики
Справочно-информационный материал
Препараты интерферона в терапии острых респираторных вирусных инфекций и гриппа у новорожденных и детей первых месяцев жизни
Приведены результаты сравнительного клинического исследования препаратов рекомбинантного человеческого интерферона a-2b в лекарственной форме суппозиториев при их применении в терапии острых респираторных вирусных инфекций у новорожденных детей и детей пе
The results of comparative clinical research of recombinant a-2b human interferon preparations in drug formulation of suppositories, when being applied in the therapy of acute respiratory viral infections in newborns and infants, were given.
Острые респираторные вирусные инфекции (ОРВИ) — это обширная группа заболеваний, характеризующихся сходной клинической картиной. После перенесенных ОРВИ развивается типоспецифический и непродолжительный иммунитет, что обусловливает повторные случаи заболеваний, вызванных даже принадлежащими к той же таксономической группе вирусами [1]. Несмотря на многочисленные исследования, посвященные проблемам гриппа и ОРВИ, профилактика и лечение этих заболеваний остаются крайне сложной задачей и в настоящее время. Среди основных причин следует отметить этиологическую гетерогенность ОРВИ, высокую контагиозность возбудителей, а также изменчивость антигенных свойств вирусов (особенно гриппа), что делает создание средств профилактики и специфического лечения крайне затруднительным [2].
Особенно серьезной проблемой являются острые респираторные инфекции у детей первого года жизни в связи с высоким уровнем заболеваемости, повышенным риском развития осложнений, а также значительным удельным весом этих инфекций в структуре летальных исходов у детей раннего возраста [3, 4].
Основными факторами, которые определяют тяжесть течения ОРВИ, являются индивидуальные и возрастные особенности детского организма, фоновые состояния (недоношенность, морфофункциональная незрелость, иммунодефицитные состояния, искусственное вскармливание и пр.), а также тип возбудителя. У детей первых лет жизни чаще, чем в других возрастных группах, отмечаются случаи более тяжелого течения респираторных инфекций, а также неблагоприятные исходы заболевания [5]. Стоит отметить, что максимальный показатель смертности от гриппа (35%) отмечается именно среди детей в возрасте до 2 лет [6]. Поэтому обсуждение вопросов рациональной терапии ОРВИ у детей раннего возраста представляется крайне актуальным.
Организм новорожденного ребенка наиболее подвержен действию различных инфекционных агентов в силу ряда факторов, среди которых превалирующее значение имеет физиологическая незрелость иммунной системы [4]. Первая неделя жизни ребенка представляет собой период радикальной функциональной, а в ряде случаев и анатомической перестройки всех органов и систем [7]. Результатом происходящих изменений является адаптация организма новорожденного ребенка к внеутробной жизни. Роль иммунной системы в ранней постнатальной адаптации чрезвычайно важна. Моментальный переход от условий внутриутробного развития в условия крайне высокой антигенной нагрузки модифицирует все структуры иммунной системы. В результате одновременно происходят разнонаправленные процессы: становление адекватного иммунного ответа, формирование иммунологической памяти и поддержание иммунологической толерантности, сдерживание возможного развития гиперергических реакций и воспаления [8]. Особенности иммунитета в неонатальном периоде предохраняют ребенка от избыточных реакций в ответ на контакт с микроорганизмами окружающего мира, но одновременно делают его уязвимым в отношении срыва защитных реакций и развития инфекционных заболеваний.
Иммунная система новорожденных находится в состоянии физиологической депрессии и характеризуется незавершенным характером фагоцитоза, низким числом Пейеровых бляшек, сниженным процессом распознавания антигенов клетками главного комплекса гистосовместимости НLА 1-го типа, сниженным количеством СD8- и СD4+ лимфоцитов, отсутствием клеток памяти, преобладанием супрессорных реакций, преимущественным образованием Тh2-клеток, недостаточностью реакции пути активации системы комплемента, недостаточным синтезом иммуноглобулинов, а также сниженной продукцией интерферона (ИФН) [9].
Слизистые респираторного тракта детей первых месяцев жизни практически лишены локальной защиты, так как секреторный иммуноглобулин А (sIgА) к моменту рождения не вырабатывается. Становление продукции sIgА у доношенных детей происходит лишь к 3-му месяцу жизни, однако она остается недостаточной вплоть до школьного возраста. Бактерицидная функция sIgА реализуется в присутствии лактоферрина, который оказывает бактериостатическое действие на многие инфекционные патогены. Слизистые оболочки кишечника детей раннего возраста способны вырабатывать лактоферрин лишь в очень низкой концентрации [10]. Активный гуморальный фактор защиты лизоцим, способный лизировать 75% видов микробов, в секретах новорожденного отсутствует, появляясь в незначительных количествах лишь к 2–3-недельному возрасту [9]. Для детей 3–6 месяцев жизни характерна утрата полученных от матери антител на фоне низкой продукции иммуноглобулинов M, А и отсутствия синтеза иммуноглобулинов G [11].
В период новорожденности (0–28 дней) в сыворотке крови циркулирует значительное количество «раннего» ИФН. «Ранние» ИФН отличаются по физико-химическим и, что особенно важно, биологическим свойствам от ИФН, синтезируемых клетками взрослого организма: они более гидрофобны, имеют сниженные противовирусные, антипролиферативные и иммуномодулирующие свойства. У новорожденных детей в становлении противоинфекционной защиты организма принимает участие только гамма-звено интерфероновой защиты, активность которой в ряде случаев значительно снижена, особенно у недоношенных детей. Уменьшение способности новорожденных к синтезу ИФН гамма обусловливает изменение показателей иммунорегуляторного индекса в сторону преобладания супрессорной активности Т-лимфоцитов и снижения киллерной активности клеток [4].
В связи с высокой восприимчивостью к инфекционным заболеваниям, несостоятельностью иммунной системы и относительно малым выбором лекарственных средств, терапия у новорожденных и детей грудного возраста должна проводиться с высокой степенью осторожности, а используемые препараты должны обладать доказанной эффективностью и благоприятным профилем безопасности [4, 12, 13].
Решить проблему эффективного и безопасного лечения гриппа и ОРВИ у детей в периоде новорожденности и первых месяцев жизни возможно, используя препараты рекомбинантного ИФН альфа. ИФН альфа способен оказывать прямой противовирусный эффект, не обладающий специфичностью, то есть данный цитокин эффективен против респираторных вирусов любой этиологии [3, 14, 15]. Дополнительным терапевтическим действием ИФН альфа при различных инфекциях является его иммуномодулирующая активность, поскольку ИФН выступает в роли регуляторного цитокина и кооперирует работу иммунокомпетентных клеток. Оптимальной лекарственной формой для применения ИФН у детей являются суппозитории. Такая лекарственная форма обеспечивает возможность использования относительно низких доз ИФН и благодаря постепенному попаданию в системный кровоток не оказывает типичных для инъекционно вводимых препаратов ИФН нежелательных лекарственных реакций [14, 16]. Учитывая указанные ранее особенности функционирования иммунной системы детского организма в первые месяцы жизни, применение экзогенного ИФН альфа играет значимую роль в лечении инфекционных заболеваний у новорожденных и грудных детей [5, 15, 17].
ИФН альфа в лекарственной форме суппозиториев положительно зарекомендовал себя при лечении вирусных и бактериальных инфекций у новорожденных: ОРВИ, сепсиса, пневмонии, специфических внутриутробных инфекций. Результаты проведенных клинических исследований и ретроспективный анализ клинического опыта применения показали взаимосвязь между факторами специфической, неспецифической и антиоксидантной защиты организма, корригируемой препаратами ИФН альфа [4].
Наиболее современным препаратом рекомбинантного человеческого интерферона α-2b (рчИФН-α-2b) является Генферон® лайт, который производится российской биотехнологической компанией «Биокад» (номер регистрационного удостоверения ЛСР-005614/09, дата регистрации — 13.07.2009). В состав препарата входит также аминокислота таурин, оказывающая положительное воздействие при воспалительных процессах. Таурин широко применяется при целом ряде заболеваний в виде офтальмологических капель, входит в состав растворов для парентерального питания у новорожденных детей. Таурин обладает антиоксидантным действием, непосредственно взаимодействуя с активными формами кислорода, избыточное накопление которых способствует развитию патологических процессов (воспаление, интоксикация и т. д.) [18]. В НИИ гриппа Минздрава РФ (г. Санкт-Петербург) было проведено сравнительное исследование влияния ИФН в сочетании с различными антиоксидантами на течение острой экспериментальной инфекции, вызванной вирусом гриппа, in vivo [19]. Комбинации препаратов формировали исходя из следующих соотношений: рчИФН-α-2b + таурин в соотношении 125 000 МЕ: 5,0 мг, рчИФН-α-2b + аскорбиновая кислота + токоферола ацетат в соотношении 150 000 МЕ: 55 мг: 55 мг. По результатам исследования установлено, что наибольшей антиоксидантной активностью обладал таурин, а комбинация ИФН с таурином являлась наиболее эффективной в отношении экспериментальной гриппозной инфекции.
Терапия животных интерфероном в комбинации с таурином снижала показатели смертности на 43–46%. Использование токоферола в комбинации с аскорбиновой кислотой хотя и умеренно снижало смертность животных (на 14–23% в зависимости от дозы вируса), но не повышало эффективности интерферона при совместном применении. При использовании сочетания ИФН и аскорбиновой кислоты при введении мышам инфицирующей дозы вируса, равной 10 LD50, продемонстрирован индекс защиты 23,1%, в то время как комбинация ИФН с таурином обусловливала 46,2%-ный индекс защиты. Также проводилось исследование противовирусной активности ИФН в комбинации с антиоксидантами in vitro. Кроме противовирусной активности ИФН в сочетании с антиоксидантами, в исследовании изучалась собственная противовирусная активность антиоксидантов и их дозозависимая цитотоксичность. К сравнению были представлены комбинации ИФН альфа в дозе 10000 МЕ с токоферолом, аскорбиновой кислотой, таурином и унитолом. В результате исследования было установлено, что наибольшей противовирусной активностью обладала комбинация ИФН и таурина. Важным наблюдением стало то, что таурин проявлял собственную противовирусную активность и, в отличие от других антиоксидантов, даже в максимальных исследованных дозах (5000 мкг/мл) не оказывал цитотоксического действия на клеточную культуру [20].
На основании этих данных можно сделать вывод, что сочетание ИФН с таурином в одной лекарственной форме позволяет обеспечить более широкий спектр действия препарата и оказывать выраженное терапевтическое действие даже при более низких дозах ИФН.
Полученные данные представляются особенно актуальными, так как при выборе терапии у детей первого года жизни важно избегать полипрагмазии и учитывать степень лекарственной нагрузки.
С целью доказательства того, что комбинация таурина и ИФН позволяет снизить дозу последнего и добиться как минимум эквивалентной эффективности в терапии ОРВИ у новорожденных и детей первых месяцев жизни по сравнению с более высокой дозой препарата ИФН (150000 МЕ), в котором антиоксиданты представлены в качестве вспомогательных компонентов (аскорбиновая кислота и токоферол), проведено настоящее клиническое исследование. Исследование проводилось на основании разрешения Министерства здравоохранения № 137 от 13 июня 2012 г.
Материалы и методы исследования
Согласно протоколу клинического исследования, для достижения поставленной цели необходимый размер выборки составил 102 человека. В исследование включались дети в возрасте от 0 до 6 месяцев включительно с клинический установленным диагнозом ОРВИ, установленным на основании клинических данных, продолжительность катаральных явлений у которых на момент включения не превышала 48 часов.
До включения в исследование врач проводил подробную беседу с родителями (или с законными представителями ребенка) с детальным объяснением процедур исследования, его целей и задач, а также потенциальных рисков, после чего в случае принятия положительного решения родители подписывали информированное согласие.
В результате проведения рандомизации пациенты были разделены на две группы. Пациенты основной группы получали препарат Генферон® лайт в дозе 125 000 МЕ + 5 мг ректально 2 раза в сутки в течение 5 дней параллельно симптоматической терапии. Симптоматическая терапия включала обильное теплое питье, аскорбиновую кислоту в возрастной дозировке, деконгестанты, жаропонижающие препараты (по показаниям). Допускалась антибактериальная терапия при наличии симптомов смешанной бактериально-вирусной инфекции. У пациентов группы сравнения применялись суппозитории, содержащие 150 000 МЕ рчИФН α-2b, ректально 2 раза в сутки в течение 5 дней (также в сочетании с симптоматическим лечением и антибактериальной терапией при наличии соответствующих показаний).
До начала лечения и на 6–7 день у всех больных определялось наличие респираторных вирусов в мазке с носоглотки с помощью метода полимеразной цепной реакции (ПЦР) (определялись антигены/генетический материал вируса гриппа А, вируса гриппа В, аденовирусов, респираторно-синцитиального вируса, вирусов парагриппа 1-го, 2-го и 3-го типов, риновируса, метапневмовируса). Также проводился клинический анализ крови, тщательный общий осмотр, оценка состояния верхних дыхательных путей, регистрировались случаи развития осложнений и нежелательных явлений.
На протяжении всего периода лечения (5 дней) проводилось заполнение мультипараметрической таблицы, которая отражала выраженность основных симптомов ОРВИ (лихорадка, интоксикация, катаральные изменения со стороны респираторного тракта). На 30-й день врач устанавливал телефонный контакт с родителями ребенка с целью выявления повторных эпизодов ОРВИ, случаев возникновения иных заболеваний и нежелательных явлений.
Обязательному анализу подлежали все случаи нежелательных явлений, наблюдаемые у больных, вне зависимости от наличия/отсутствия связи с исследуемой терапией. Тщательная оценка безопасности осуществлялась у всех пациентов, получивших хотя бы одно введение исследуемого препарата или препарата сравнения.
Статистическая обработка данных производилась с помощью программного обеспечения Statistica 10.0.
Величины показателей представлены в виде среднего значения и стандартного отклонения или медианы и интерквартильного размаха в зависимости от типа распределения данных. Сравнение двух групп по количественному признаку в случае нормального распределения признака осуществлялось с помощью t-критерия Стьюдента. В случае распределения признака, отличающегося от нормального, сравнение в группах осуществлялось с использованием критерия Манна–Уитни. Сравнение групп по качественному бинарному признаку (анализ частот) проводилось с помощью точного критерия Фишера. При интерпретации результатов использовались стандартные методы сравнительного анализа и описательной статистики. Статистически значимыми считались различия при р 0,05). По данным акушерско-гинекологического анамнеза матерей пациентов из группы препарата Генферон® лайт медиана возраста матери на момент родов составила 28 [24,00–33,00] лет, в группе препарата сравнения — 28,00 [24,00–31,00] лет (р > 0,05).
У пациентов из основной группы состояние при рождении определялось как удовлетворительное в 47 (92,16%) случаях, средней тяжести в 3 (5,88%) случаях, тяжелое у одного (1,96%) пациента. У пациентов из группы сравнения состояние при рождении определялось как удовлетворительное в 46 (90,20%) случаях, средней тяжести в 4 (7,84%) случаях, тяжелое состояние при рождении зарегистрировано у одного (1,96%) пациента (р > 0,05).
В группе препарата Генферон® лайт было 3 (5,88%) пациента, которые родились раньше положенного срока, в группе сравнения было 2 (3,92%) недоношенных ребенка (р > 0,05).
Сопутствующая патология
К наиболее распространенным (выявлены более чем у 4 человек) сопутствующим заболеваниями относились синдром мышечной дистонии, синдром нервно-рефлекторной возбудимости, перинатальное поражение ЦНС. Частота встречаемости отдельных сопутствующих заболеваний в обеих группах была сопоставимой (р > 0,05). Аллергии на лекарственные средства не отмечалось в анамнезе ни у одного пациента из двух групп исследуемых препаратов. У 4 (7,84%) детей из группы Генферон® лайт и у 4 (7,84%) пациентов из группы препарата сравнения имелась пищевая аллергия в анамнезе (р > 0,05).
Клиническая характеристика больных при включении в исследование
Длительность симптомов ОРВИ у всех пациентов на момент включения не превышала 48 часов. Клиническая картина ОРВИ была представлена классическими симптомами: интоксикацией (вялость, снижение аппетита, сонливость), лихорадкой, катаральными изменениями со стороны носо- и ротоглотки (ринит, фарингит и т. п.).
Сравнительная оценка клинических признаков ОРВИ не выявила достоверных различий по частоте встречаемости тех или иных симптомов исследования на момент включения у пациентов основной группы и группы сравнения (табл.).
Сроки купирования отдельных симптомов ОРВИ в группах
Лихорадка
На момент включения пациентов в исследование лихорадочный синдром наблюдался в 100% случаев как в основной группе, так и в группе сравнения.
Длительность лихорадочного синдрома в основной группе составила, в среднем, 2,88 ± 0,73 дня (медиана 3,00 [2,00–3,00]). У пациентов, получавших рекомбинантный ИФН в дозе 150 000 МЕ — 3,17 ± 0,88 дня (медиана 3,00 [3,00–4,00]) (р > 0,05).
На 2-й день исследования лихорадка сохранялась у 33 (64,70%) детей из группы препарата Генферон® лайт и у 40 (78,0%) детей из группы сравнения (р > 0,05). К 4-му дню исследования лихорадки не было ни у одного ребенка из группы препарата Генферон® лайт, а в группе сравнения лихорадка наблюдалась у 3 (5,88%) детей (р > 0,05). На 5-й лихорадка наблюдалась только в группе сравнения у 1 (1,96%) ребенка (р > 0,05). На 6–7 день исследования, по окончании приема исследуемых препаратов, лихорадка отсутствовала у всех пациентов из обеих групп (р > 0,05) (рис. 1).
На фоне приема исследуемых препаратов ни у одного ребенка не зарегистрировано случаев развития типичных для инъекционно вводимого ИФН нежелательных лекарственных реакций: утяжеления лихорадки или эпизодов резкого подъема температуры тела, связанных с проводимой терапией (так называемого гриппоподобного синдрома).
Сроки купирования симптомов интоксикации
На момент включения пациентов в исследование симптомы интоксикации наблюдались в 100% случаев в двух группах. На 6–7 день исследования, по окончании приема исследуемых препаратов, симптомы интоксикации отсутствовали у пациентов из основной группы, в группе сравнения указанные симптомы наблюдались у 1 (1,96%) ребенка (р > 0,05) (рис. 2).
Среднее время до купирования симптомов интоксикации в основной группе составило, в среднем, 3,23 ± 0,92 дня (медиана 3,00 дня [3,00; 4,00]). У пациентов, получавших рекомбинантный ИФН в дозе 150 000 МЕ — 3,19 ± 0,80 дня (медиана 3,00 дня [3,00; 4,00]) (р > 0,05). Как показали результаты статистического анализа, частота и сроки купирования интоксикации в исследуемых группах не имели достоверных отличий, характеризовались одновекторной направленностью и одинаковой динамикой.
Сроки купирования основных симптомов гриппа и других ОРВИ
Для анализа были взяты следующие симптомы воспалительных изменений верхних дыхательных путей, которые отражают течение гриппа и ОРВИ: затруднение носового дыхания, гиперемия слизистой ротоглотки, кашель.
В целом показатель среднего времени до клинического улучшения, заключавшегося в купировании основных симптомов гриппа и ОРВИ, в группе препарата Генферон® лайт составил 3,67 ± 1,14 дня, медиана 4,00 дня [3,00; 5,00], в группе сравнения в дозе 150 000 МЕ 3,71 ± 1,09 дня, медиана 4,00 дня [3,00; 4,00] (р > 0,05).
Достижение критериев реконвалесценции к 6–7 дню исследования
Пациент считался реконвалесцентом при наличии всех перечисленных критериев: отсутствие лихорадки (температура тела, измеренная в подмышечной впадине, не превышает 37,2 °С) и признаков интоксикации; полное отсутствие катаральных явлений или остаточные проявления гриппа или другой ОРВИ, выраженность которых согласно итоговому баллу не превышает 2; отсутствие осложнений гриппа или другой ОРВИ.
К 6–7 дню исследования количество детей, достигших реконвалесценции, в основной группе (препарат Генферон® лайт) составило 46 (90,20%), в группе сравнения (препарат рчИФН-α-2b) 47 (92,16%). Представленные результаты не имели статистически значимых различий (р > 0,05).
Элиминация возбудителя
В качестве дополнительного критерия были оценены результаты ПЦР-диагностики для выявления элиминационной активности препаратов.
По данным проведенного на скрининге ПЦР-исследования на возбудителей ОРВИ (гриппа А, В, парагриппа, аденовируса, риновируса, респираторно-синцитиального вируса, метапневмовируса) в группе препарата Генферон® лайт вирус гриппа А определялся у 3 (5,8%) пациентов, респираторно-синцитиальный вирус определялся у 5 (9,8%) пациентов, вирус парагриппа — у 5 (9,8%) пациентов, риновирус — у 6 (11,76%) пациентов, метапневмовирус — у 1 (1,96%) пациента. В группе препарата рчИФН-α-2b вирус гриппа А определялся у 2 (3,92%) пациентов, респираторно-синцитиальный вирус — у 6 (11,76%) пациентов, вирус парагриппа — у 3 (5,8%) пациентов, риновирус — у 8 (15,69%) пациентов, метапневмовирус — у 1 (1,96%) ребенка (р > 0,05).
Доля пациентов, у которых на 6–7 день от начала терапии зарегистрирована элиминация возбудителя по данным ПЦР-диагностики, в группе препарата Генферон® лайт составила 60% (12 случаев элиминации после лечения из 20 случаев, выявленных ПЦР-диагностикой на скрининге). В группе препарата сравнения — 30% (8 случаев элиминации после лечения из 20 случаев, выявленных ПЦР-диагностикой на скрининге) (р > 0,05) (рис. 3). В группе Генферон® лайт отмечалась тенденция к более высокой элиминационной активности.
Среднее значение баллов согласно мультипараметрической таблице
Анализ данных мультипараметрической таблицы, в которую ежедневно вносились данные с целью оценки регресса клинических проявлений ОРВИ, показал, что уже к 4 дню в обеих группах наблюдалась достоверная положительная динамика выраженности симптомов.
Среднее ежедневное значение температуры тела в течение 5 дней применения исследуемого препарата не имело статистически значимых различий между двумя группам. На момент включения медианы температуры тела пациентов, составляли в основной группе 37,5 [37,40; 38,00] °C, в группе сравнения 37,50 [37,40; 38,00] °C.
На 2-е сутки температура тела в группе препарата Генферон® лайт имела медианы 37,30 [39,90; 37,40] °C, в группе препарата Виферон® 37,30 [37,20; 37,50] °C. С 3-х суток и до окончания применения исследуемой терапии, медианы температуры тела в группах имели нормальное значение. На 6–7-е сутки медианы температуры тела в группе препарата Генферон® лайт, как и в группе препарата Виферон® составили 36,60 [36,50; 36,60] °C.
Медианы баллов выраженности симптома интоксикации на протяжении исследования в группах не имели различий и составили 1,00 балла [0,00; 1,00] в основной группе (препарат Генферон® лайт) и 1,00 балла [0,00; 1,00] в группе сравнения (препарат Виферон®).
Среднее значение баллов, отражающих выраженность катаральных симптомов гриппа или другой ОРВИ, оцениваемых ежедневно в течение 5 дней применения исследуемой терапии, также не показало статистически достоверных различий между группами (р > 0,05).
Анализ изменений гемограммы
Анализ крови выполнялся всем включенным в исследование больным. В течение периода мониторинга клинического анализа крови не было выявлено достоверной отрицательной динамики по всем исследованным параметрам (гемоглобин, эритроциты, лейкоциты, нейтрофилы, лимфоциты, тромбоциты и скорости оседания эритроцитов), за исключением увеличения процентного соотношения лимфоцитов, не выходящего по значению медиан за пределы нормы. От скрининга к визиту 2 (6–7 день исследования) прослеживалась тенденция к увеличению числа пациентов с нормализацией показателей клинического анализа крови. Различий между группой препарата Генферон® лайт и группой препарата сравнения на протяжении исследования не было (р > 0,05).
Безопасность исследуемой терапии
В ходе исследования установлено, что ректальное введение суппозиториев не вызывает местных и общих патологических реакций. Зарегистрированные нежелательные лекарственные реакции в основном представляли собой незначительные отклонения от возрастной нормы показателей гемограммы, которые, по мнению исследователей, отражали закономерные гематологические изменения при имеющейся вирусной инфекции и не были связаны с применением исследуемой терапии.
Заключение
Терапия острых инфекционных заболеваний у новорожденных и детей раннего возраста является актуальной проблемой, используемые в данной возрастной группе лекарственные средства должны обладать клинически установленной эффективностью и не оказывать негативного влияния на организм ребенка. Также крайне важно избегать полипрагмазии и учитывать степень лекарственной нагрузки при лечении детей первого года жизни.
В приведенном исследовании производилась сравнительная оценка препарата в лекарственной форме суппозиториев, содержащих комбинацию ИФН a-2b в дозе 125 000 МЕ и таурина, и препарата ИФН a-2b в дозе 150 000 МЕ в суппозиториях.
По результатам исследования установлено, что использование комбинации низкой дозы ИФН с таурином позволяет достигать как минимум не меньшей эффективности в купировании основных признаков ОРВИ по сравнению с препаратом, содержащим ИФН в большей дозе, но без высокоактивного антиоксиданта таурина.
После лечения в основной группе наблюдалась тенденция к более высокой элиминационной активности — элиминация достигнута у 60% больных, по сравнению с группой сравнения (30%).
Данные проведенного клинического исследования показали, что Генферон® лайт характеризуется хорошей переносимостью и безопасностью при применении у детей в возрасте 0–6 месяцев, страдающих ОРВИ, что обеспечивает возможность применения данного препарата в педиатрической практике у новорожденных и детей грудного возраста.
Таким образом, полученные данные позволяют заключить, что использование меньшей дозировки интерферона альфа в препарате Генферон® лайт в дозе 125 000 МЕ в комбинации с антиоксидантом таурином по сравнению с препаратом рекомбинантного интерферона в дозе 150 000 МЕ позволяет достичь одинакового терапевтического действия, что уменьшает лекарственную нагрузку на организм ребенка.
Литература
А. В. Горелов*, доктор медицинских наук, профессор
И. Л. Алимова**, доктор медицинских наук, профессор
Л. В. Феклисова***, доктор медицинских наук, профессор
Е. Е. Целипанова***, кандидат медицинских наук
Е. В. Михайлова#, доктор медицинских наук, профессор
Н. М. Шведова#, кандидат медицинских наук
А. В. Романовская#, кандидат медицинских наук
Т. И. Антонова##, кандидат медицинских наук
* ФБУН ЦНИИЭ Роспотребнадзора, Москва
** ГБОУ ВПО СГМА МЗ РФ, Смоленск
*** ГУЗ ДГКБ Св. Владимира, Москва
# ГБОУ ВПО СГМУ им. В. И. Разумовского МЗ РФ, Саратов
## ГУЗ «Детская городская поликлиника № 35», Санкт-Петербург



.gif)
_575.gif)
.gif)