какие свойства характерны для алканов
Алканы
Органическая химия
По мере изучения вы поймете, что свойства вещества определяются его строением, и научитесь легко предсказывать ход реакций 😉
Номенклатура алканов
Гомологами называют вещества, сходные по строению и свойствам, отличающиеся на одну или более групп CH2
Названия алканов формируются по нескольким правилам. Если вы знаете их, можете пропустить этот пункт, однако я должен познакомить читателя с ними. Итак, алгоритм составления названий следующий:
Внимательно изучите составленные для различных веществ названия ниже.
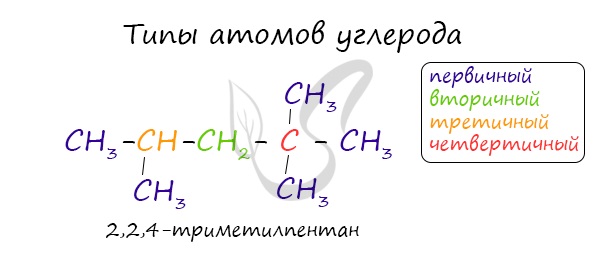
В углеводородной цепочке различают несколько типов атомов углерода, в зависимости от того, с каким числом других атомов углерода соединен данный атом. Различают первичные, вторичные, третичные и четвертичные атомы углерода.
Изомерия бывает структурной (межклассовая, углеродного скелета, положения функциональной группы или связи) и пространственной (геометрической, оптической). По мере изучения классов органических веществ вы узнаете о всех этих видах.
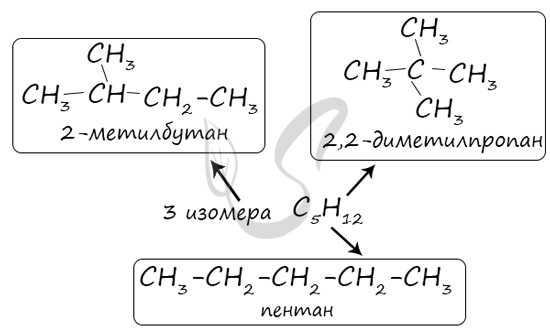
В молекулах алканов отсутствуют функциональные группы, кратные связи. Для алканов возможна изомерия только углеродного скелета. Так у пентана C5H12 существует 3 структурных изомера.
Природный газ и нефть
В состав нефти входят алканы с длинными углеродными цепочками, например: C8H18, C12H26. Путем крекинга из нефти получают алканы.
Получение алканов
В ходе крекинга нефти получается один алкан и один алкен.
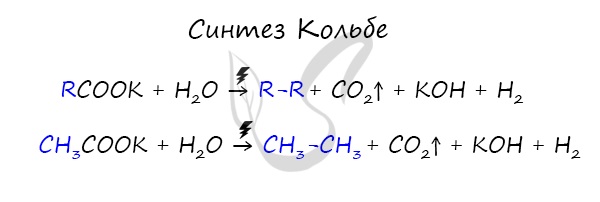
Данный синтез заключается в сплавлении соли карбоновой кислоты с щелочью, в результате образуется алкан.
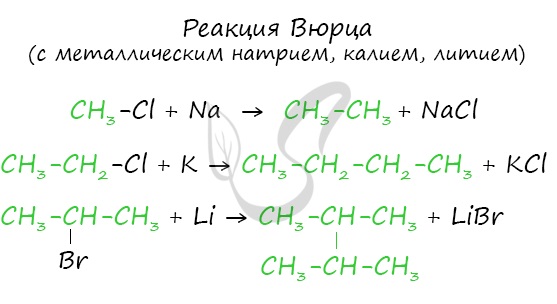
Эта реакция заключается во взаимодействии галогеналкана с металлическим натрием, калием или литием. В результате происходит удвоение углеводородного радикала, рост цепи осуществляется зеркально: в том месте, где находился атом галогена.
В ходе синтеза Гриньяра с помощью реактива Гриньяра (алкилмагнийгалогенида) получают различные органические соединения, в том числе несимметричные (в отличие от реакции Вюрца).
На схеме выше мы сначала получили реактив Гриньяра, а потом использовали его для синтеза. Однако можно записать получение реактива Гриньяра и сам синтез в одну реакцию, как показано на примерах ниже.
В результате электролиза солей карбоновых кислот может происходить образование алканов.
Химические свойства алканов
Реакции с хлором на свету происходят по свободнорадикальному механизму. На свету молекула хлора распадается на свободные радикалы, которые и осуществляют атаку на молекулу углеводорода.
Реакция Коновалова заключается в нитровании алифатических (а также ароматических) соединений разбавленной азотной кислотой. Реакция идет при повышенном давлении, по свободнорадикальному механизму.
Все органические вещества, в их числе алканы, сгорают с образованием углекислого газа и воды.
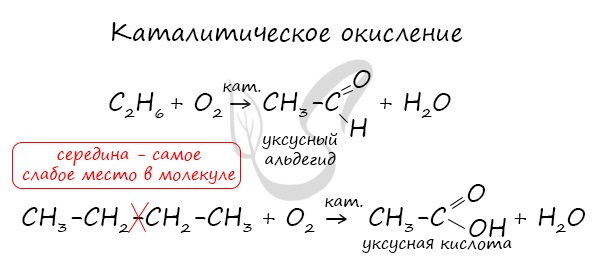
В ходе каталитического, управляемого окисления, возможна остановка на стадии спирта, альдегида, кислоты.
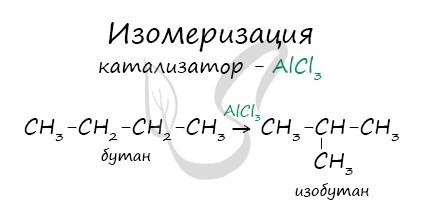
В реакциях, по итогам которых образуются изомеры, используется характерный катализатор AlCl3.
Вам уже известно, что в результате крекинга образуется один алкан и один алкен. Это не только способ получения алканов, но и их химическое свойство.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Алканы. Свойства алканов.
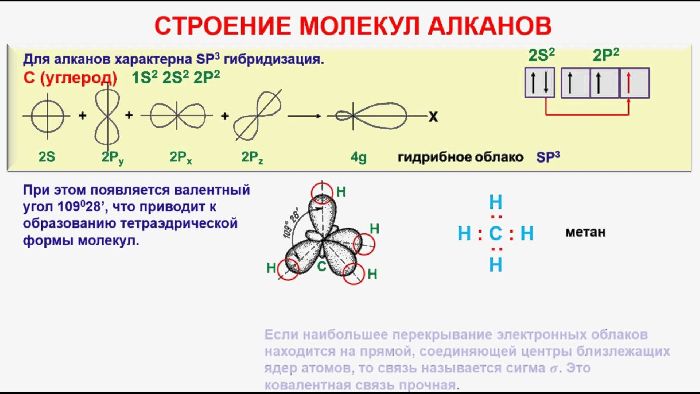
Строение алканов.
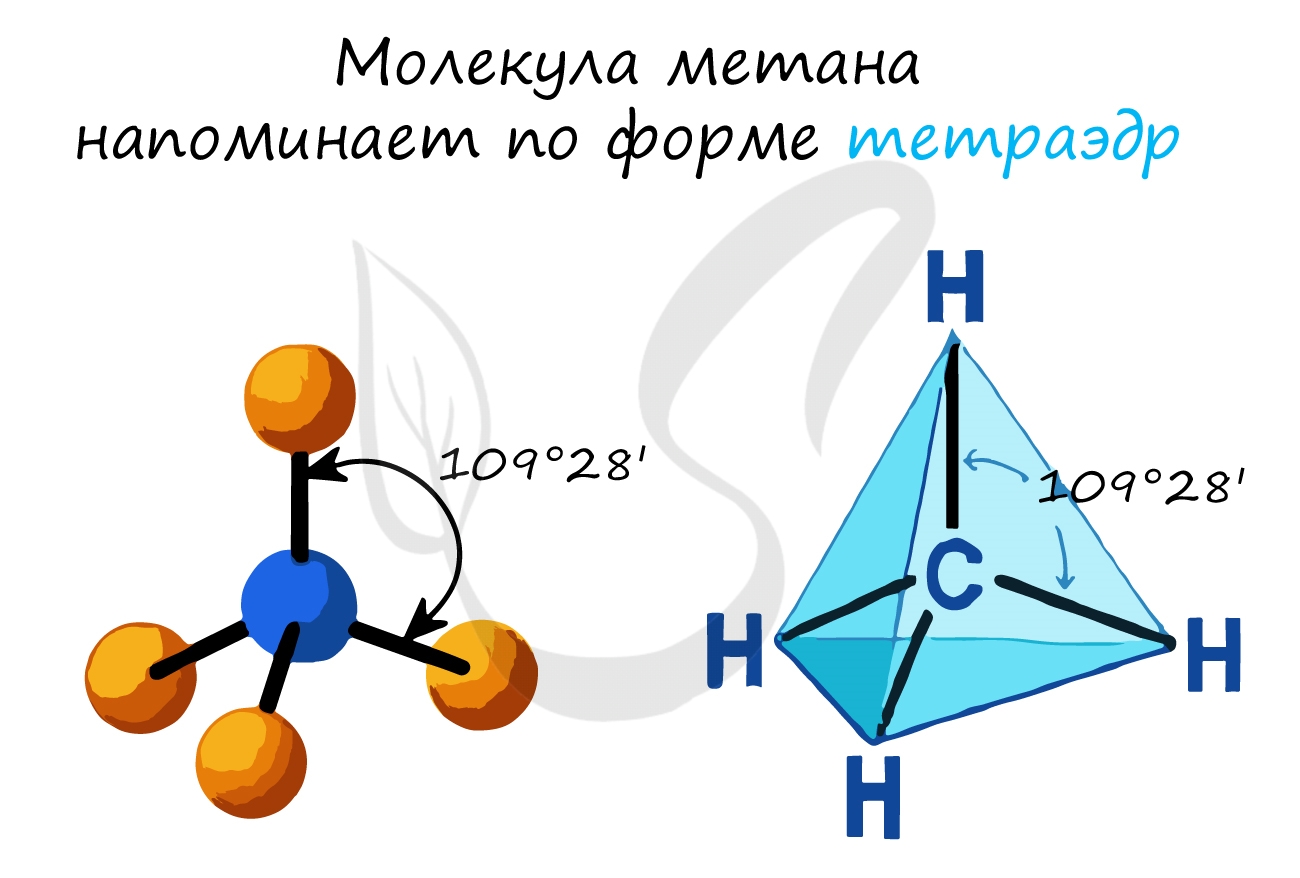
Каждый атом углерода находится в sp 3 – гибридизации, образует 4 σ— связи (1 С-С и 3 С-Н). Форма молекулы в виде тетраэдра с углом 109,5°.
Связь образуется посредством перекрывания гибридных орбиталей, причем максимальная область перекрывания лежит в пространстве на прямой, соединяющей ядра атомов. Это наиболее эффективное перекрывание, поэтому σ-связь считается наиболее прочной.
Изомерия алканов.
Для алканов свойственна изомерия углеродного скелета. Предельные соединения могут принимать различные геометрические формы, сохраняя при этом угол между связями. Например,
Различные положения углеродной цепи называются конформациями. В нормальных условиях конформации алканов свободно переходят друг в друга с помощью вращения С-С связей, поэтому их часто называют поворотными изомерами. Существует 2 основные конформации – «заторможенное» и «заслоненное»:
Изомерия углеродного скелета алканов.
Количество изомеров возрастает с увеличением роста углеродной цепи. Например у бутана известно 2 изомера:
Для пентана – 3, для гептана – 9 и т.д.
Если у молекулы алкана отнять один протон (атом водорода), то получится радикал:
Физические свойства алканов.
В нормальных условиях – С1-С4 – газы, С5-С17 – жидкости, а углеводороды с количеством атомов углерода больше 18 – твердые вещества.
С ростом цепи повышается температура кипения и плавления. Разветвленные алканы имеют более низкие температуры кипения, чем нормальные.
Алканы нерастворимы в воде, но хорошо растворяются в неполярных органических растворителях. Легко смешиваются друг с другом.
Получение алканов.
Синтетические методы получения алканов:
2. Из галогенпроизводных – реакция Вюрца: взаимодействие моногалогенаклканов с металлическим натрием, в результате чего получаются алканы с удвоенным числом углеродных атомов в цепи:
3. Из солей карбоновых кислот. При взаимодействии соли с щелочи, получаются алканы, которые содержат на 1 атом углерод меньше по сравнению с исходной карбоновой кислотой:
4. Получение метана. В электрической дуге в атмосфере водорода:
Химические свойства алканов.
В нормальных условиях алканы – химически инертные соединения, они не реагируют с концентрированной серной и азотной кислотой, с концентрированной щелочью, с перманганатом калия.
Устойчивость объясняется прочностью связей и их неполярностью.
Соединения не склонны к реакциях разрыва связи (реакция присоединения), для них свойственно замещение.
1. Галогенирование алканов. Под воздействием кванта света начинается радикальное замещение (хлорирование) алкана. Общая схема:
Реакция идет по цепному механизму, в которой различают:
А) Инициирование цепи:
Суммарно можно представить в виде:
2. Нитрование (реакция Коновалова) алканов. Реакция протекает при 140 °С:
Легче всего реакция протекает с третитичным атомом углерода, чем с первичным и вторичным.
3. Изомризация алканов. При конкретных условиях алканы нормального строения могут превращаться в разветвленные:
4. Крекинг алканов. При дейсвии высоких температур и катализаторов высшие алканы могут рвать свои связи, образуя алкены и алканы более низшие:
5. Окисление алканов. В различных условиях и при разных катализаторах окисление алкана может привести к образованию спирта, альдегида (кетона) и уксусной кислоты. В условиях полного окисления реакция протекает до конца – до образования воды и углекислого газа:
Применение алканов.
Алканы нашли широкое применение в промышленности, в синтезе нефти, топлива и т.д.
Химические свойства алканов

Всего получено оценок: 660.
Всего получено оценок: 660.
Алканы – соединения гомологического ряда метана. Это насыщенные нециклические углеводороды. Химические свойства алканов зависят от строения молекулы и физического состояния веществ.
Строение алканов
Соединения реагируют на свету или при нагревании. Реакции протекают по цепному (свободно-радикальному) механизму. Таким образом, связи способны расщепляться только под действием свободных радикалов. В результате замещения водорода образуются галогеналканы, соли, циклоалканы.
Алканы относятся к предельным или насыщенным углеродам. Это значит, что молекулы содержат максимальное количество атомов водорода. Из-за отсутствия свободных связей реакции присоединения для алканов не характерны.
Химические свойства
Общие свойства алканов приведены в таблице.
Типы химических реакций
Описание
Уравнение
Реагируют с F2, Cl2, Br2. Реакция с йодом не идёт. Галогены замещают атом водорода. Реакция с фтором сопровождается взрывом. Хлорирование и бромирование происходит при температуре 300-400°C. В результате образуются галогеналканы
Нитрование (реакция Коновалова)
Взаимодействие с разбавленной азотной кислотой при температуре 140°C. Атом водорода замещается нитрогруппой NO2. В результате образуются нитроалканы
Сопровождается окислением с образованием алкансульфонилхлоридов
Образование алкансульфоновых кислот в избытке кислорода. Атом водорода замещается группой SO3H
Происходит в присутствии катализатора при высоких температурах. В результате разрыва связей С-С образуются алканы и алкены
В избытке кислорода происходит полное окисление до углекислого газа. При недостатке кислорода происходит неполное окисление с образованием угарного газа, сажи
Происходит частичное окисление алканов при небольшой температуре и в присутствии катализаторов. Могут образовываться кетоны, альдегиды, спирты, карбоновые кислоты
Отщепление водорода в результате разрыва связей С-Н в присутствии катализатора (платины, оксида алюминия, оксида хрома) при температуре 400-600°С. Образуются алкены
Реакция дегидрирования с образованием циклоалканов
Образование изомеров под действием температуры и катализаторов
Чтобы понимать, как проходит реакция и какие радикалы замещаются, рекомендуется записывать структурные формулы.
Применение
Алканы широко применяются в промышленной химии, косметологии, строительстве. Из соединений изготавливают:
Что мы узнали?
Узнали о химических свойствах и применении алканов. Из-за прочных ковалентных связей между атомами углерода, а также между атомами углерода и водорода, алканы проявляют инертность. Возможны реакции замещения и разложения в присутствии катализатора при высоких температурах. Алканы – предельные углеводороды, поэтому реакции присоединения невозможны. Алканы используются для производства материалов, моющих средств, органических соединений.
Химические свойства алканов
Алканы – это предельные углеводороды, содержащие только одинарные связи между атомами С–С в молекуле, т.е. содержащие максимальное количество водорода.
Алканы – предельные углеводороды, поэтому они не могут вступать в реакции присоединения.
Для предельных углеводородов характерны реакции:
Разрыв слабо-полярных связей С – Н протекает только по гомолитическому механизму с образованием свободных радикалов.
Поэтому для алканов характерны только радикальные реакции.
Алканы устойчивы к действию сильных окислителей (KMnO4, K2Cr2O7 и др.), не реагируют с концентрированными кислотами, щелочами, бромной водой.
1. Реакции замещения.
В молекулах алканов связи С–Н более доступны для атаки другими частицами, чем менее прочные связи С–С.
1.1. Галогенирование.
Алканы реагируют с хлором и бромом на свету или при нагревании.
При хлорировании метана сначала образуется хлорметан:

| Химическая активность хлора выше, чем активность брома, поэтому хлорирование протекает быстро и неизбирательно. |
При хлорировании алканов с углеродным скелетом, содержащим более 3 атомов углерода, образуется смесь хлорпроизводных.
Например, при хлорировании пропана образуются 1-хлорпропан и 2-хлопропан: |
Бромирование протекает более медленно и избирательно.
| Избирательность бромирования: сначала замещается атом водорода у третичного атома углерода, затем атом водорода у вторичного атома углерода, и только затем первичный атом. С третичный–Н > С вторичный–Н > С первичный–Н |