какие свойства микроорганизмов определяются на кровяном агаре
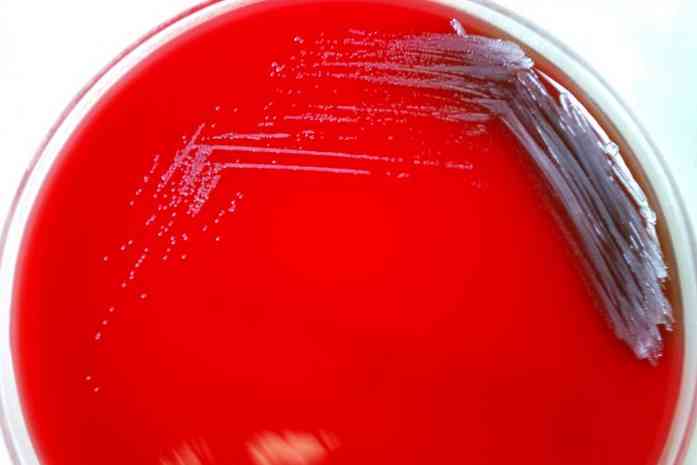
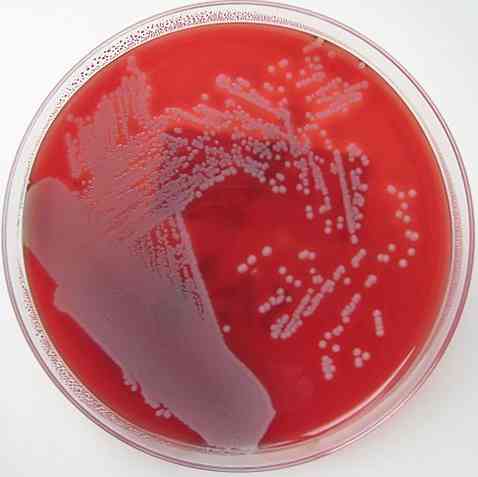
Рост стафилококка на кровяном агаре
Методическое пособие для студентов
Макропрепараты
Иллюстрации и описание
План ответа макропрепарата.
4. Наблюдаемый результат
Содержание:
1. Рост кишечных палочек на среде Эндо
2. Рост кишечных палочек и дизентерийных палочек на среде Плоскирева
3. Рост стафилококка на кровяном агаре
4. Реакция преципитации в агаре для определения токсигенности дифтерийной палочки
5. Определение фаготипов брюшнотифозных палочек
7. Реакция связывания комплемента
8. Реакция задержки гемагглютинации
9. Реакция непрямой (пассивной) гемагглютинации (РНГА)
10. Определения чувствительности бактерий к антибиотикам методом индикаторных дисков
11. Рост стафилококка на желточно-солевом агаре
12. Персистентные свойства микроорганизмов – антилизоцимная активность (АЛА)
13. Лизоцимная активность
14. Иммуноферментный метод
15. Среда Китта-Тароцци
16. Среда контроля стерильности (СКС)
Рост кишечных палочек на среде Эндо
Среда Эндо – дифференциально-диагностическая среда.
Лактозоотрицательные микроорганизмы (некоторые патогенные кишечные палочки, шигеллы, сальмонеллы) растут колониями белого или светло-розового цвета.
Рост кишечных и дизентерийных палочек
На среде Плоскирева
Среда Плоскирева – дифференциально-диагностическая среда. Это селективная среда для выделения шигелл и сальмонелл. Готовая среда прозрачна, имеет розовато-желтоватый цвет. Среда Плоскирева относится к плотным средам для выделения чистых культур.
В состав среды Плоскирева входят ингибирующие вещества (желчные соли, бриллиантовый зеленый, йод), вследствие чего она должна полностью подавлять рост грамположительной флоры, значительно задерживать (первые 24 ч) рост эшерихий и другой сопутствующей микрофлоры, подавлять роение протея. Дифференцирующие свойства агара Плоскирева основаны на изменении рН в кислую сторону при росте лактозоферментирующих бактерий, которые образуют колонии брусничного цвета (индикатор нейтральный красный). Лактозоотрицательные бактерии вырастают в виде бесцветных или слабоокрашенных колоний.
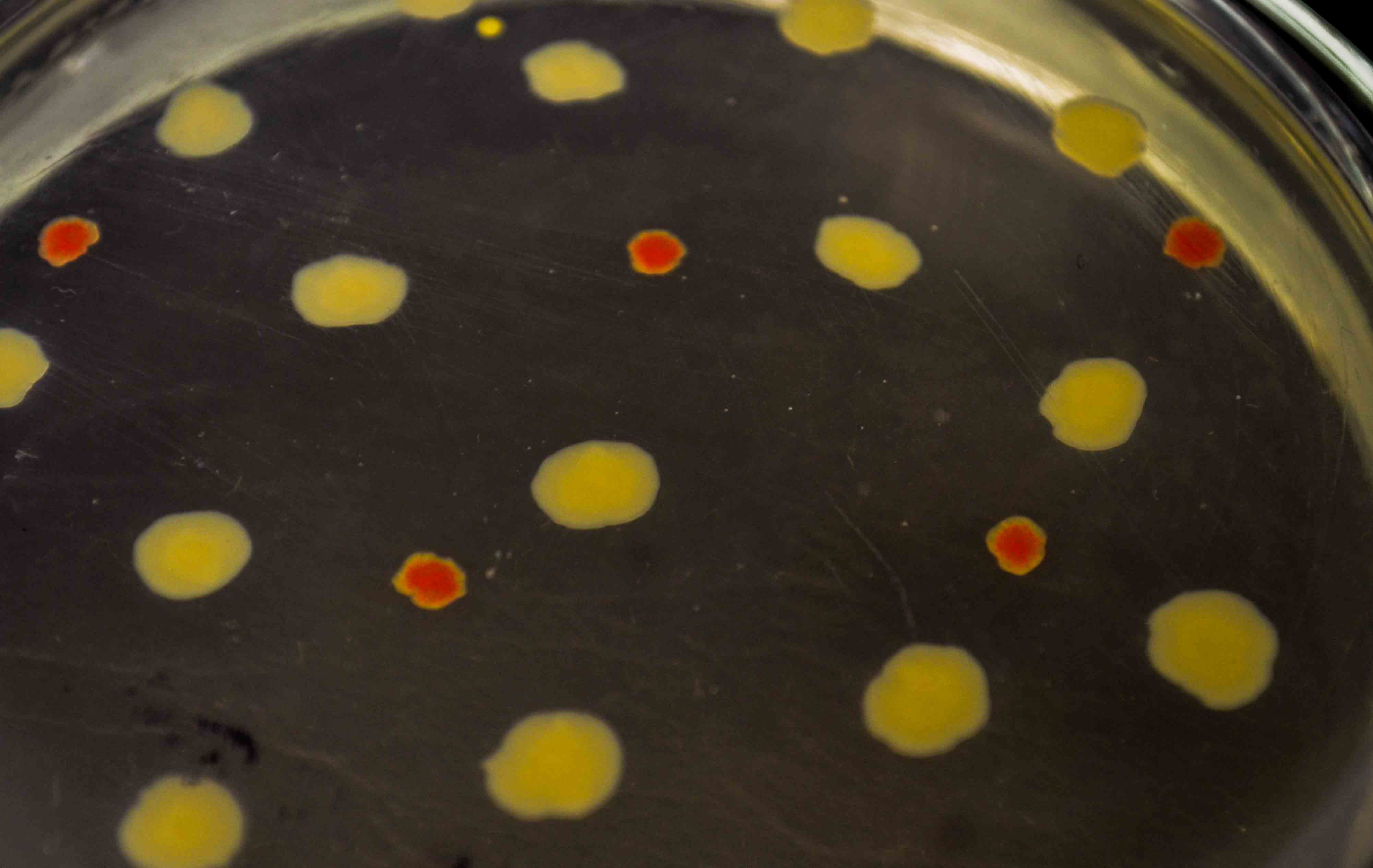
Рост стафилококка на кровяном агаре
Кровяной агар (КА) – сложная плотная питательная среда для культивирования прихотливых видов микроорганизмов и выявления гемолизинов (определения у микроорганизмов одного из факторов вирулентности – гемолитической активности). На 100 мл расплавленный и остуженный до 45 0 С мясо-пептонный агар (МПА) добавляют 5 мл отмытых эритроцитов барана или эритроцитарной массы крови человека (I группы), аккуратно перемешивают, разливают в чашки Петри. На поверхность застывшего и подсушенного КА засевают чистую культуру исследуемых микроорганизмов, после суточной инкубации при 37 0 С определяют зоны гемолиза вокруг выросших колоний. Зоны гемолиза виды в виде полного (β-гемолиз) или частичного (α-гемолиз) просветления вокруг колоний.
На данной чашке видны колонии стафилококков бело-серого цвета с зонами полного просветления вокруг, что свидетельствует о наличии у этих микроорганизмов гемолитической активности.
Агаровая основа крови, использование и подготовка
кровяной агар это обогащенная твердая среда, дифференциальная, но не селективная. Он используется для восстановления и роста большого разнообразия микроорганизмов из клинических образцов или субкультур..
Классический кровяной агар должен быть включен для посева большинства клинических образцов, полученных в лаборатории; за исключением образцов кала, где это бесполезно, если только они не подготовлены с определенными модификациями.
Эта культуральная среда в основном состоит из обогащенного базового агара и 5% крови. Основа агара может варьироваться в зависимости от потребностей, но в основном будет состоять из пептонов, аминокислот, витаминов, мясного экстракта, хлорида натрия, агара и других..
Что касается крови, обычно требуется контакт с биотерием для получения крови от животных, таких как овцы, кролики или лошади. Однако это не всегда возможно, и иногда используется человеческая кровь.
Среда с кровяным агаром может быть приготовлена в лаборатории или приобретена для компаний, которые ей посвящены. Приготовление этой среды является одним из самых деликатных, любая небрежность при ее приготовлении приведет к загрязнению партии.
Вот почему должны быть приняты все возможные меры предосторожности, и, в конце концов, должен быть проведен контроль качества инкубирования при 37 ° С на 1 чашку на каждые 100 приготовленных.
фундамент
Кровяной агар является обогащенной средой, поскольку он содержит в качестве основной добавки 5-10% крови на основе агара. Оба соединения содержат много питательных веществ, и это свойство позволяет большинству пригодных для культивирования бактерий расти в нем..
Этот рост происходит без ограничений; по этой причине это неселективно. Однако, если в эту среду добавляются соединения, которые предотвращают рост некоторых микроорганизмов и способствуют росту других, он становится селективным. Это тот случай, если определенные типы антибиотиков или противогрибковых добавляются.
Точно так же кровяной агар является дифференциальной средой, поскольку он позволяет различать 3 типа бактерий: бета-гемолитические, альфа-гемолитические и гамма-гемолитические..
Примерами ß-гемолитических бактерий являются Streptococcus pyogenes и Streptococcus agalactiae.
Примером α-гемолитических бактерий являются Streptococcus pneumoniae и стрептококк группы viridans.
Наконец, существуют бактерии, называемые гамма-гемолитическими или негемолитическими. Они растут на агаре, не вызывая изменений на нем, эффект, известный как γ-гемолиз, а микроорганизмы являются γ-гемолитическими..
Пример γ-гемолитических бактерий: некоторые штаммы Streptococcus группы D (Streptococcus bovis и Enterococcus faecalis).
приложений
Культуральная среда с агаром крови является одной из наиболее часто используемых в лаборатории микробиологии..
Среди микроорганизмов, способных расти на агаризованной среде крови: строгие, факультативные, микроаэрофильные, анаэробные, грамположительные или грамотрицательные аэробные бактерии, быстрорастущие или медленнорастущие бактерии..
Некоторые бактерии, которые требуют или мешают с точки зрения питания, а также грибки и дрожжи, также растут. Аналогично, это полезно для субкультуры или реактивации штаммов, которые очень слабо метаболически.
Однако выбор типа крови и основного агара будет варьироваться в зависимости от вероятного микроорганизма, который подозревается в выздоровлении, и от использования бляшки (культура или антибиограмма)..
Выбор группы крови
Кровь может быть ягнёнком, кроликом, лошадью или человеком.
Наиболее рекомендуемой является кровь ягненка, за некоторыми исключениями. Например, для выделения видов Haemophilus, где рекомендуемой кровью является лошадь или кролик, поскольку в крови ягненка содержатся ферменты, которые ингибируют фактор V.
Наименее рекомендуемым является человек, однако он наиболее часто используется, возможно, потому, что его легче всего получить..
Кровь должна быть дефибринирована, получена без каких-либо добавок и от здоровых животных. Для использования человеческой крови необходимо учитывать несколько факторов:
Если кровь поступает от людей, перенесших бактериальные инфекции, у них будут специфические антитела. В этих условиях рост некоторых бактерий, вероятно, будет подавлен.
Если он получен из банка крови, он содержит цитрат, и возможно, что некоторые бактерии не развиваются в его присутствии. С другой стороны, если кровь поступает от пациентов, принимающих антибиотики, рост чувствительных бактерий может быть замедлен.
И если кровь от диабетика, избыток глюкозы мешает правильному развитию паттернов гемолиза..
Выбор типа базового агара
Базовый агар, используемый для приготовления кровяного агара, может быть очень широким. Среди них: питательный агар, агар для инфузии мозга, соевый агар с триптиказой, агар Müeller Hinton, агар Thayer Martin, агар Columbia, агар Brucella, агар Campylobacter и т. Д..
Использование кровяного агара в соответствии с базовой средой, используемой для его приготовления
Питательный агар
Эта база используется реже всего, потому что на ней будут расти в основном нетребовательные бактерии, такие как кишечные палочки, Pseudomonas sp, S. aureus, Bacillus sp., среди других. Не рекомендуется выделять стрептококк.
Инфузионный агар для сердца (BHI)
Он является одним из наиболее используемых в качестве основы кровяного агара, поскольку в нем содержатся необходимые питательные вещества для роста большинства бактерий, в том числе Streptococcus sp и другие требовательные бактерии. Хотя не следует соблюдать закономерности гемолиза.
Кровь ягненка обычно используется с этой основой.
Также могут быть приготовлены варианты с кровяным агаром, где добавляются другие соединения для выделения определенных микроорганизмов. Например, инфузионный агар мозга с добавлением кроличьей крови, цистина и глюкозы служит для выделения Francisella tularensis.
Принимая во внимание, что с цистином теллурит полезен для выделения Corynebacterium diphteriae. Вы можете использовать кровь человека или ягненка.
В первом случае бета-гемолиз будет выглядеть как узкое гало, а во втором гало будет гораздо шире.
Аналогично, эта основа вместе с бацитрацином, кукурузным крахмалом, лошадиной кровью и другими добавками для обогащения (IsoVitaleX), используется для выделения рода Haemophilus sp из дыхательных проб.
Триптивная соя
Эта база является наиболее рекомендуемой для лучшего наблюдения за характером гемолиза и выполнения диагностических тестов, таких как таксоны оптохина и бацитрацина. Это классический кровяной агар, который обычно используется.
С помощью этой базы вы также можете приготовить специальный кровяной агар для Corynebacterium diphteriae, с теллур цистином и кровь ягненка.
Аналогично, комбинация этого агара с кровью ягненка плюс канамицин-ванкомицин идеальна для роста анаэробов, особенно Bacteroides sp.
Агар Мюллер Хинтон
Эта основа с добавлением крови используется для выполнения антибиограммы требовательных микроорганизмов, таких как Streptococcus sp.
Это также полезно для выделения таких бактерий, как Legionella pneumophila.
Агар Тайер Мартин
Эта среда идеально подходит в качестве основы для кровяного агара, когда подозревается род Neisseria, особенно Neisseria meningitidis, в качестве N. gonorrhoeae не растет на кровяном агаре.
Он также служит для проведения тестов на чувствительность к Neisseria meningitidis.
Агар Колумбия
Эта база отлично подходит для посева образцов желудочной биопсии в поисках Helicobacter pylori.
Среду готовят путем добавления 7% крови ягненка, дефибринированной антибиотиками (ванкомицин, триметоприм, амфотерицин В и цефсулодин), чтобы ограничить рост других типов бактерий, которые могут присутствовать.
Эта же основа с добавлением крови человека или ягненка, налидиксовой кислоты и колистина полезна для выделения Gardnerella vaginalis. Он также идеально подходит для оценки чувствительности к антимикробным препаратам к антибиотикам того же микроорганизма..
Кроме того, он используется для приготовления кровяного агара для выращивания анаэробов, добавления аминогликозидов и ванкомицина.
Эта база позволяет нам правильно наблюдать закономерности гемолиза.
Бруцелла Агар
Эта среда, используемая в качестве основы кровяного агара вместе с добавлением витамина К, идеально подходит для выращивания анаэробных бактерий. В этом случае рекомендуется использовать кровь ягненка.
Кампилобактер агар
Агар Кампилобактер, дополненный 5% овечьей крови и 5 антибиотиками (цефалотин, амфотерицин В, триметоприм, полимиксин В и ванкомицин), является средой, используемой для выделения Campylobacter jejuni в образцах стула.
подготовка
Каждый коммерческий дом несет на обратной стороне упаковки инструкции по приготовлению литра питательной среды. Соответствующие расчеты могут быть сделаны для приготовления желаемого количества, в соответствии с выбранным базовым агаром.
Взвесьте и растворите
Базовый агар поставляется обезвоженным (порошок), поэтому его необходимо растворить в дистиллированной воде, доведенной до pH 7,3.
Количество, указанное выбранным базовым агаром, взвешивают и растворяют в соответствующем количестве воды в фиоле, затем нагревают до умеренного нагрева и перемешивают вращательными движениями до тех пор, пока весь порошок не растворится..
стерилизовать
После растворения стерилизовать в автоклаве при 121 ° С в течение 20 минут..
Агрегат крови
Покидая автоклав, дайте фиоле остыть, пока температура не будет колебаться между 40 и 50 ° C; температура, которую поддерживает человеческая кожа, и в то же время агар еще не затвердел.
Для этого к фиолле прикасаются рукой, и если тепло терпимо, это идеальная температура для добавления соответствующего количества дефибринированной крови (50 мл на литр агара). Аккуратно перемешать до гомогенизации.
Прохождение скопления крови имеет решающее значение, потому что, если это происходит, когда среда очень горячая, красные кровяные клетки будут разрушаться, и среда не будет служить для наблюдения гемолиза..
Если его добавить слишком холодным, образуются комочки, и поверхность среды не будет гладкой, чтобы сделать флейту правильно.
Разлить в чашки Петри
Подавать в стерильных чашках Петри сразу после гомогенизации крови. Приблизительно 20 мл наливают в каждую чашку Петри. Эта процедура выполняется в вытяжном шкафу или рядом с горелкой..
При подаче кровяного агара в чашки Петри на поверхности тарелки не должно оставаться пузырьков воздуха. Если это происходит, пламя горелки Бунзена быстро проходит над пластиной, чтобы устранить их..
Пластинам дают затвердеть и хранят в холодильнике (2-8 ° С) в перевернутом виде до использования. Перед использованием кровяного агара пластины следует закалить (дать им принять комнатную температуру) для посева.
Современные методы биохимической идентификации бактерий
ЗАНЯТИЕ № 9 (Практическое занятие)
Тема: ФЕРМЕНТЫ МИКРООРГАНИЗМОВ. ИДЕНТИФИКАЦИЯ ЧИСТОЙ КУЛЬТУРЫ ПО БИОХИМИЧЕСКИМ СВОЙСТВАМ.
Цель занятия:изучить ферментативные (сахаролитические и протеолитические, гемолитические и редуцирующие) свойства микробов и другие методы обязательные для идентификации возбудителя; продолжить выделение чистой культуры аэробов и анаэробов (3 и 4 день)
Вопросы для обсуждения
1. Ферменты микроорганизмов. Классы ферментов.
2. Секреция продуктов жизнедеятельности микробной клетки: пигменты, аромат, газообразование, светящиеся микроорганизмы, микробные токсины.
3. Идентификация бактерий по биохимическим свойствам: сахаролитические, протеолитические, гемолитические, липолитические свойства. Редуцирующие (окислительно-восстановительные) свойства микробов.
4. Современные методы биохимической идентификации бактерий.
5. Выделение чистой культуры (3-4 дни: аэробы; 3-5 дни: анаэробы).
Оформление протокола практического занятия (сделать дома)
1) Проверить записи по самостоятельной работе, выполненной на занятиях № 7 и 8. Сделать описание хода и результатов самостоятельной работы (первый день микробиологического исследования:…; второй день микробиологического исследования:…).
3) Записать понятия и зарисовать примеры определения следующих свойств:
— сахаролитических свойств на жидких средах Гисса (рис 9.1) и среде Олькеницкого (рис 9.3) (какие свойства и по изменению какой части среды определяются на среде Олькеницкого);
— протеолитических свойств – определение образования индола, сероводорода и аммиака, и формы разжижения желатина (рис 9.4 и 9.5);
3) Подготовить Таблицу 9.1. для заполнения на занятии.
Задания для выполнения практической работы
1. По демонстрационным препаратам:
— определить сахаролитические и протеолитические ферменты микробов кишечной группы при посеве на «пестрый» ряд и МПБ с индикаторами;
— определить способность микроорганизмов вырабатывать ферменты: каталазу, оксидазу, плазмокоагулазу, гиалуронидазу;
— заполнить таблицу 9.1
2. Сделать фото всех демонстрационных препаратов для оформления в протокол самостоятельной работы.
МАТЕРИАЛ К ИЗУЧЕНИЮ.
Ферменты микробов.Ферменты состоят из белковой (апофермент) и небелковой частей (простетическая группа). Простетическая группа обеспечивает специфичность действия каждому ферменту, поэтому он взаимодействует только с одним субстратом.
Ферменты классифицируются:
а) по характеру вызываемых превращений: гидролазы, оксидоредуктазы, трансферазы, лиазы, изомеразы, лигазы;
б) по локализации и месту действия: эндо- и экзоферменты;
в) по времени образования: конститутивные, индуцибельные;
г) по расщепляемому субстрату: сахаролитические, протеолитические, липолитические.
При биохимической дифференциации микробов определяют их свойства:
3- гемолитические – способность лизировать эритроциты на кровяном агаре (КА) или на бульоне с отмытыми эритроцитами;
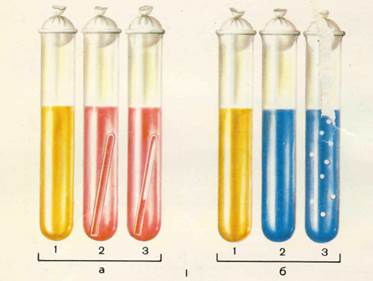
Сахаролитические свойства микробовопределяют путем посева чистой культуры на специальные дифференциально-диагностические питательные среды, содержащие различные углеводы (лактозу, сахарозу, глюкозу, мальтозу, маннит и др.) и индикатор (реактив Андреде или др.). Наиболее распространенной является среда Гисса, которая представляет собой смесь сахара и индикатора в пептонной воде. Для улавливания газа на дно пробирки со средой опускают «газовки» – поплавки для улавливания газа. Образовавшийся в процессе ферментации газ вытесняет часть среды и скапливается вверху «газовки». Под действием образующейся при расщеплении углевода кислоты индикатор изменяет окраску среды. Поэтому эти среды названы «пестрый ряд».Короткий «пестрый ряд» включает жидкие среды Гисса с моно- и дисахаридами: глюкозой, лактозой, сахарозой, мальтозой и с 6-атомным спиртом – маннитом. В длинный «пестрый ряд» наряду с перечисленными углеводами вводят среды с разнообразными моносахаридами (арабиноза, ксилоза, рамноза, галактоза и др.) и спиртами (глицерин, дульцит, инозит и др.).
Методика определения сахаролитических свойств. Культуру микроорганизмов высевают на жидкие среды Гисса с поплавками (5 пробирок с глюкозой, лактозой, сахарозой, мальтозой и маннитом). Помещают в термостат при температуре 37 о С на 24 часа. Определяют в каждой пробирке происшедшие изменения, указывают наличие кислотообразования буквой «К», что видно по покраснению среды, и газообразования буквой «Г», в том случае, если поплавок заполнен газом.
Рис. 9.1. Изучение сахаролитической активности микроорганизмов.
I – «пестрый ряд»: а – жидкая среда с углеводами и индикатором Андреде; б – полужидкая среда с индикатором ВР: 1 – микроорганизмы не ферментируют углевод; 2 – микроорганизмы ферментируют углевод с образованием кислоты; 3 – микроорганизмы ферментируют углевод с образованием кислоты и газа.
Кроме того, сахаролитическую активность изучают на средах Эндо, Левина, Плоскирева. Микроорганизмы, сбраживая до кислоты находящийся в этих средах молочный сахар (лактозу), образуют окрашенные колонии — кислота изменяет цвет имеющегося в среде индикатора. Колонии микробов, не ферментирующих лактозу, бесцветны.
Рис.9.2. Рост энтнробактерий на среде Эндо: 1 – лактозонегативные; 2 – лактозопозитивные.
Рис 9.3. Рост на трехсахарном железосодержащем агаре (среде Олькеницкого):
1. Контроль (незасеянная среда)
Молоко при росте микробов, сбраживающих лактозу, свертывается.
При росте микроорганизмов, образующих амилазу, на средах с растворимым крахмалом происходит его расщепление. Об этом узнают, прибавив к культуре несколько капель раствора Люголя — цвет среды не изменяется. Нерасщепленный крахмал дает с этим раствором синее окрашивание.
Определение протеолитических свойств микробов проводят на средах с желатином, молоком, сывороткой, пептоном.
Пептон – промежуточный продукт распада белков, представляет собой смесь полипептидов и аминокислот. Хорошо растворяется в воде и не свертывается при нагревании. Получают пептон из рубцов крупного и мелкого рогатого скота.
Желатин – животный клей, состоящий из белка сухожилий, костей, хрящей. Светло-коричневого цвета, без запаха и вкуса. Плавится при температуре 32–34 о С, застывает при температуре 16 о С. При посеве уколом в столбик желатиновой среды микробы, разлагающие желатин, разжижают среду.
Действие микроорганизмов, разлагающих казеин (молочный белок), проявляется в пептонизации молока, которое приобретает вид молочной сыворотки.
В процессе ферментации пептонов микроорганизмы образуют индол (С8Н7N), сероводород (Н2S), аммиак (NH3) и другие соединения.
Методика определения сероводорода.Над культурой исследуемых микробов помещают полоску фильтровальной бумаги, смоченную раствором уксуснокислого свинца или сульфатом железа (бумага закрепляется между пробкой и стенкой пробирки). Пробирки помещают до трех суток в термостат. Почернение бумаги происходит при выделении сероводорода, который превращает уксуснокислый свинец в сернокислый или в нерастворимый сульфид железа. Продукцию сероводорода можно определить также путем посева исследуемой культуры микробов уколом в столбик с питательной средой, содержащей различные соли (сульфат железа, тиосульфат натрия, сульфит натрия). При образовании Н2S среда окрашивается в черный цвет за счет образования сульфида железа (FeS).
Методика определения индола.Определение индола по методу Морелли осуществляют с помощью полоски фильтровальной бумаги, обработанной горячим насыщенным 12 % водным раствором щавелевой кислоты и высушенной в термостате. Бумагу закрепляют между пробкой и стенкой пробирки. Пробирки с исследуемой культурой помещают в термостат на трое суток. Порозовение нижней части индикаторной бумаги указывает на наличие индола. Также индол можно определить по методу Эрлиха. Для этого в пробирку с исследуемой культурой микробов добавляют 2-3 мл эрифа, энергично перемешивают и прибавляют несколько капель реактива Эрлиха (спиртовой раствор параметиламидобензальдегид с хлористоводородной кислотой). При наличии индола наблюдается розовое окрашивание или розовое кольцо.
Методика определения аммиака. Над культурой исследуемых микробов помещают полоску увлажненной красной лакмусовой бумаги (бумага закрепляется между пробкой и стенкой пробирки). Пробирки помещают в термостат. В присутствии аммиака бумага синеет.
В бактериологической практике иногда ограничиваются изучением сахаролитических и протеолитических свойств исследуемых бактерий, если этого достаточно для их идентификации.
Редуцирующие свойства микробов.Редукцией или восстановлением того или иного вещества называется химический процесс, состоящий в отнятии кислорода от данного вещества или замене его водородом. Имеются вещества, которые при редукции легко обесцвечиваются.
Оксидазный тест проводят путем снятия микробной колонии и растирания ее по оксидазному диску. Учет реакции ведут в течение 5–10 секунд при 25–30°С. Замедленные положительные реакции появляются через 10–60 секунд. Отсутствие изменения цвета на диске или развитие окраски через 60 и более секунд расценивают, как отрицательную реакцию.
Важным признаком у микробов является способность к образованию фермента каталазы. Для ее обнаружения на предметное стекло наносят каплю 1-3% раствора перекиси водорода и в нее вносят бактериологической петлей исследуемую культуру микробов. При положительном результате наблюдают выделение пузырьков газа в результате разложения Н2О2 на кислород и воду.
При необходимости исследуют другие признаки, например способность восстанавливать нитраты в нитриты, карбоксилировать аминокилоты, образовывать оксидазу, плазмокоагулазу, фибринолизин и другие ферменты.
Ряд ферментов (нейраминидаза, гиалуронидаза, коагулаза и др.) способствуют проявлению патогенных свойств у возбудителей некоторых инфекционных заболеваний, поскольку субстратом их действия являются вещества, входящие в состав клеток и тканей организма человека.
Плазмокоагулаза — выявляется в пробирочном опыте путем определения скорости свертывания испытуемым микробом цитратной кроличьей или человеческой плазмы.
Коагулазний тест «+» Staphylococcus aureus Коагулазний тест «-» Staphylococcus epidermidis
Гемотоксин— вызывает лизис эритроцитов. Определяется при посеве испытуемых микробов на кровяной агар. Вокруг колонии наблюдается зона просветления среды.
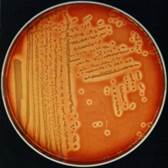
Лецитиназа— разрушает лецитовителлин яичного желтка. Обнаруживается при посеве испытуемых микробов на желточно-солевой агар (ЖСА) по образованию вокруг колоний зоны помутнения с радужным венчиком.
Гиалуронидаза — расщепляет гиалуроновую кислоту, входящую в состав соединительной ткани. В пробирку с испытуемой культурой вносится гиалуроновая кислота и после 30-минутной экспозиции при 37 °С добавляется 2 капли крепкой уксусной кислоты. При наличии фермента гиалуроновая кислота утрачивает способность образовывать сгусток.
Фибринолизин — растворяет фибрин плазмы крови, добавленной к питательной среде.
Современные методы биохимической идентификации бактерий
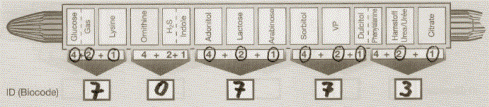
Для ускоренной идентификации выделенных чистых культур применяются наборы коммерческих тест-систем. Они позволяют быстро и надежно определить ферментативные свойства микроорганизмов. Тест-системы представляют собой наборы микропробирок или микроконтейнеров с определенными субстратами, дисками или полосками бумаги, пропитанными различными ингредиентами, наборы индикаторных карандашей и др. Такие системы значительно сокращает время анализа. Ниже приводятся некоторые из наиболее часто используемых в практике микробиологических исследований микросистем.
1. Система «Enterotub» позволяет определить 9 признаков (сбраживание лактозы, глюкозы, дульцита, образование индола и сероводорода, утилизация цитрата, мочевины, фенилаланина, декарбоксилирование лизина). Система представляет собой пластиковую трубку, разделенную на 8 камер с питательными средами, содержащими индикаторы. Посевным материалом является изолированная колония бактерий с чашки первичного посева.
2. Система АР1-20Е — пластиковая полоска с 20 микроконтейнерами, в которых имеется набор сухих индикаторных питательных сред. В их составе дифференцирующие аминокислоты, углеводы, желатин, мочевина, реактивы на сероводород, индол, ацетоин и др.
3. Система Micro Id включает 15 биохимических тестов для дифференциации бактерий семейства Enterobacteriaceae и представляет собой набор бумажных индикаторных дисков,размещенных в лунках пластикового лотка.
4. Набор Patho Tec Rapid ID состоит из бумажных полосок, снабженных индикаторными поясками для выявления ферментов или конечных продуктов обмена веществ. Этот набор позволяет определить до 10 признаков в течение 1-4 ч.
5.