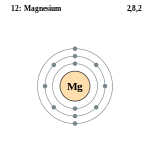
какие свойства проявляет магний
Магний: способы получения и химические свойства
Магний Mg — это щелочной металл. Серебристо-белый, относительно мягкий, пластичный, ковкий металл. На воздухе покрыт оксидной пленкой. Сильный восстановитель.
Относительная молекулярная масса Mr = 24,305; относительная плотность для твердого и жидкого состояния d = 1,737; tпл = 648º C; tкип = 1095º C.
Способ получения
1. В результате электролиза расплава хлорида магния образуются магний и хлор :
2. Нитрид магния разлагается при 700 — 1500º С образуя магний и азот:
3. Оксид магния легко восстанавливается углеродом при температуре выше 2000º С, образуя магний и угарный газ:
MgO + C = Mg + CO
4. Оксид магния также легко восстанавливается кальцием при 1300º С с образованием магния и оксида кальция:
MgO + Ca = CaO + Mg
Качественная реакция
Качественной реакцией для магния является взаимодействие соли магния с любой сильной щелочью, в результате которой происходит выпадение студенистого осадка:
1. Хлорид магния взаимодействует с гидроксидом калия и образует гидроксид магния и хлорид калия:
MgCl2 + 2KOH = Mg(OH)2 + 2KCI
Химические свойства
1.1. Магний взаимодействует с азотом при 780 — 800º С образуя нитрид магния:
1.2. Магний сгорает в кислороде (воздухе) при 600 — 650º С с образованием оксида магния:
2Mg + O2 = 2MgO
1.4. С водородом магний реагирует при температуре 175º C, избыточном давлении и в присутствии катализатора MgI2 с образованием гидрида магния:
2. Магний активно взаимодействует со сложными веществами:
2.2. Магний взаимодействует с кислотами:
2.2.1. Магний реагирует с разбавленной соляной кислотой, при этом образуются хлорид магния и водород :
Mg + 2HCl = MgCl2 + H2 ↑
2.2.2. Реагируя с разбавленной азотной кислотой магний образует нитрат магния, оксид азота (I) и воду:
2.2.3. В результате реакции сероводородной кислоты и магния при 500º С образуется сульфид магния и водород:
Mg + H2S = MgS + H2
2.3. Магний вступает в реакцию с газом аммиаком при 600 — 850º С. В результате данной реакции образуется нитрид магния и водород:
2.4. Магний может вступать в реакцию с оксидами :
2.4.1. В результате взаимодействия магния и оксида азота (IV) при температуре 150º С в вакууме, в этилацетилене образуется нитрат магния и оксид азота (II):
2.4.2. Магний взаимодействует с оксидом кремния при температуре ниже 800º С в атмосфере водорода образуя силицид магния и оксид магния:
4Mg + SiO2 = Mg2Si + MgO,
а если температуру поднять до 1000º С, то в результате реакции образуется кремний и оксид магния:
2Mg + SiO2 = Si + 2MgO
Для чего человеку магний?
Казалось бы, один из элементов периодической системы Менделеева.
Насколько важен магний для здоровья можно понять, если только представить, что он занимает четвертое место среди всех элементов в организме, и второе – по содержанию в клетке (опережает его калий).
Магний в организме человека распределен следующим образом: – около 60% его находится в костях и зубах; – 20% – в мышцах и внутренних органах; – 20% приходится на нервы и мозг. Уровень магния в организме примерно 25 мг, в крови колеблется в пределах 0,7–1,1 ммоль/л.
Для чего нужен магний организму?
Для понимания значимости этого элемента, необходимо представить, что в основе работы каждой клетки лежит переход ионов через ее мембрану. Как раз он и является одним из тех ионов, которые обеспечивают работу целого организма на клеточном уровне.
Роль магния в организме велика.
Без него не обходится практически ни один процесс.
Чем полезен магний для организма
в сокращении гладких и скелетных мышц
в процессе свертывания крови
в формировании костной ткани
в формировании соединительной ткани.
На ее долю приходится 50% массы тела. Она формирует кожу, костный мозг, сухожилия, связки, мозговые оболочки, лимфоузлы, жировую ткань и т.д.
в передаче нервных импульсов
в обмене углеводов, белков, жиров, ферментов
во всех процессах потребления и образования энергии
Низкий уровень магния в организме вызывает
На фоне длительного низкого уровня магния могут формироваться такие серьезные заболевания, как сахарный диабет 2 типа, заболевания сердца и головного мозга, остеопороз, ожирение, невынашивание беременности.
Магний для нас
Магний для детей играет огромную роль еще на этапе их внутриутробного развития.
При его нехватке в организме беременной женщины развивается фето-плацентарная недостаточность, когда нарушаются процессы доставки питательных веществ к ребенку от матери. В результате этого возможно развитие гипоксии (кислородного голодания) с поражением центральной нервной системы малыша, а также других систем.
Магний для организма развивающегося плода необходим и для профилактики синдрома внезапной смерти новорожденного. Это грозное состояние имеет в основе нарушение температурного обмена, который так важен для только что родившегося ребенка.
Весьма часто у младенцев встречаются врожденные пороки развития, связанные с дефицитом Mg. В основе их лежит неполноценное развитие соединительной ткани – составляющей практически всех органов. Поэтому данная патология многогранна и приводит к нарушению развития опорно-двигательного аппарата, сердца и сосудов, кожи, глаз, зубов, желудочно-кишечного тракта, мочеполовой системы и т.д.
Низкий уровень Mg негативно сказывается на эмоциональном фоне ребенка – ухудшается память, внимание, сон, переносимость нагрузок, появляется слабость, раздражительность, переутомление, мышечные, головные боли, появление болей в сердце, нарушение сердечного ритма, болей в животе, перепады артериального давления, метеочувствительность. Все эти симптомы могут объединяться в один диагноз – вегето-сосудистая (или нейро-циркуляторная) дистония.
Магний для женщин в достаточном количестве необходим в различные периоды жизни.
Особое влияние магния отмечено во время беременности. При его недостатке чаще возникают гестозы (в первой половине беременности – рвота и тошнота, затем повышение АД, появление белка в моче, отеки), выкидыши, преждевременные роды, изменение течения нормальных родов, мышечные судороги, симфизиты (расхождение костей таза во время беременности, сопровождающееся дискомфортом, хрустом, болью в области сочленения лонных костей, в родах может осложняться разрывом тазового кольца).
Чем полезен магний для организма женщины?
Mg уменьшает проявления предменструального синдрома, устраняя болезненность груди, раздражительность, отеки.
Магний укрепляет слабый связочный аппарат и способствует предотвращению пролапса гениталий (опущение и выпадение матки).
Он также улучшает обмен углеводов и жиров, позволяет предотвратить развитие метаболического синдрома, ожирения, сахарного диабета.
Женщины подвержены развитию остеопороза в большей степени по сравнению с мужчинами.Оптимальное поступление Mg препятствует разрушению костей, поддерживает нормальную минеральную плотность костной ткани.
Известно положительное влияние Mg в период менопаузы. Он уменьшает проявления климакса – приливы, головную боль, потливость, головокружение.
Нужен ли магний для мужчин
Польза для организма мужчин огромна. Он помогает формированию прочного скелета в период роста, поддержанию его целостности на протяжении всей жизни, формирует характерный для мужчин мышечный рельеф и ускоряет рост мышечной массы во время тренировок. Снижает избыточное количество молочной кислоты в мышцах после физических нагрузок или активных тренировок, предотвращая появление болей.
Mg благотворно влияет на сохранение способности к размножению (показал свою эффективность в улучшении подвижности сперматозоидов), на повышение либидо, предотвращает возникновение заболеваний простаты.
Также он стимулирует выработку основного мужского гормона тестостерона.
Почему же возникает дефицит магния?
Причин дефицита Mg несколько:
Экологический фактор – обеднение почв в результате активного земледелия, загрязнение промышленными отходами.
Употребление в пищу обработанной, рафинированной пищи, в которой потеря магния достигает 80%.
Нарушение усвоения магния в кишечнике из-за высокого потребления кальция, белковой и жирной пищи, алкоголя.
Большие потери магния вследствие употребления ряда лекарств и наличия заболеваний почек, желудочно-кишечного тракта, эндокринной системы.
Потребность человека в магнии значительно повышается при физической активности, беременности и лактации, у детей в период роста.Это отдельная группа риска людей по дефициту Mg.
Из чего поступает Mg?
Магний поступает в организм извне с продуктами питания.
Он содержится в зеленых овощах, орехах, семенах, бобовых, крупах, фруктах, рыбе и морепродуктах, а также в молоке и твороге.
Недостаточное содержания магния в еде приводит к тяжелому расстройству обмена веществ.
Суточная потребность в магнии варьирует для разных групп лиц:
300-400 мг в сутки
(это примерно 300 грамм орехов, около килограмма рыбы или сыра, около трех литров молока).
у молодых активных людей, беременных и кормящих женщин
Недостающее количество необходимо компенсировать приемом препаратов магния.
Установлено, что лучшая переносимость и усвоение наступает при приеме таблетированных форм солей магния.
Лучше элемент усваивается в составе соли оротовой кислоты, из-за более качественного переноса ионов магния непосредственно в клетку.
Дистрибьютор в РФ и организация, принимающая претензии потребителей:
Если Вам стало известно о побочном действии при использовании лекарственного препарата «Верваг Фарма» или о претензии к качеству, пожалуйста, сообщите нам эту информацию по электронной почте: adr@woerwagpharma.ru

ООО «Верваг Фарма» использует файлы cookies для анализа пользования сайтом, подбора для вас релевантного контента и рекламы, персонализации сайта. Дополнительную информацию о файлах cookies можно найти в Политике ООО «Верваг Фарма» в отношении файлов cookies и в Официальном уведомлении. Нажав «Согласен» или оставаясь на сайте, вы разрешаете использовать файлы cookies на этом сайте. Если вы не согласны с тем, чтобы ООО «Верваг Фарма» использовало файлы cookies, вы можете соответствующим образом установить настройки вашего браузера или покинуть сайт.
Магний
лёгкий, ковкий, серебристо-белый металл
История
Происхождение названия
В 1695 году из минеральной воды Эпсомского источника в Англии выделили соль, обладавшую горьким вкусом и слабительным действием. Аптекари называли её горькой солью, а также английской, или эпсомской солью. Минерал эпсомит имеет состав MgSO4 · 7H2O.
Впервые был выделен в чистом виде сэром Хемфри Дэви в 1808 году.
Получение
Обычный промышленный метод получения металлического магния — это электролиз расплава смеси безводных хлоридов магния MgCl2 (бишофит), натрия NaCl и калия KCl. В этом расплаве электрохимическому восстановлению подвергается хлорид магния:
Расплавленный металл периодически отбирают из электролизной ванны, а в нее добавляют новые порции магнийсодержащего сырья. Так как полученный таким способом магний содержит сравнительно много — около 0,1 % примесей, при необходимости «сырой» магний подвергают дополнительной очистке. С этой целью используют электролитическое рафинирование, переплавку в вакууме с использованием специальных добавок — флюсов, которые «отнимают» примеси от магния, или перегонку (сублимацию) металла в вакууме. Чистота рафинированного магния достигает 99,999 % и выше.
Разработан и другой способ получения магния — термический. В этом случае для восстановления оксида магния при высокой температуре используют кокс:
или кремний. Применение кремния позволяет получать магний из такого сырья, как доломит CaCO3·MgCO3, не проводя предварительного разделения магния и кальция. С участием доломита протекают реакции:
2MgO + CaO + Si = Ca2SiO4 + 2Mg.
Преимущество термического способа состоит в том, что он позволяет получать магний более высокой чистоты. Для получения магния используют не только минеральное сырье, но и морскую воду.
Физические свойства
Магний — очень легкий, довольно хрупкий металл, постепенно окисляется на воздухе, превращаясь в белый оксид магния. Кристаллическая решетка α-формы Ca (устойчивой при обычной температуре) гранецентрированная кубическая, а = 5,56Å. Атомный радиус 1,97Å, ионный радиус Ca2+, 1,04Å. Плотность 1,74 г/см³(20 °C). Выше 464 °C устойчива гексагональная β-форма. tпл = 650 °C, tкип = 1105 °C; температурный коэффициент линейного расширения 22•10-6 (0-300 °C); теплопроводность при 20 °C 125,6 Вт/(м•К) или 0,3 кал/(см•сек•°C); удельная теплоемкость (0-100 °C) 623,9 дж/(кг•К) или 0,149 кал/(г•°C); удельное электросопротивление при 20 °C 4,6•10-8 ом•м или 4,6•10-6ом•см; температурный коэффициент электросопротивления 4,57•10-3 (20 °C). Модуль упругости 26 Гн/м² (2600 кгс/мм²); предел прочности при растяжении 60 Мн/м² (6 кгс/мм²); предел упругости 4 Мн/м² (0,4 кгс/мм²), предел текучести 38 Мн/м² (3,8 кгс/мм²); относительное удлинение 50 %; твердость по Бринеллю 200—300 Мн/м² (20-30 кгс/мм²). Магний достаточно высокой чистоты пластичен, хорошо прессуется, прокатывается и поддается обработке резанием.
Химические свойства
Смесь порошкового магния с перманганатом калия KMnO4 — взрывчатое вещество! Раскаленный магний реагирует с водой:
Mg (раск.) + Н2О = MgO + H2;
Щелочи на магний не действуют, в кислотах он растворяется легко с выделением водорода:
Mg + 2HCl = MgCl2 + H2;
При нагревании на воздухе магний сгорает, с образованием оксида, также с азотом может образовываться небольшое количество нитрида:
2Mg + О2 = 2MgO;
3Mg + N2 = Mg3N2
Определение
Серебристо-белый, средний по твердости металл. Средне распространен в природе. При горении выделяется большое количество света и тепла.
Применение
Сплавы
Сплавы на основе магния являются важным конструкционным материалом в авиационной и автомобильной промышленности благодаря их лёгкости и прочности. Цены на магний в слитках в 2006 году составили в среднем 3 долл/кг.
Химические источники тока
Магний в виде чистого металла, а так же его химические соединения (бромид, перхлорат) применяются для производства очень мощных резервных электрических батарей (например магний-перхлоратный элемент, серно-магниевый элемент, хлористосвинцово-магниевый элемент, хлорсеребряно-магниевый элемент, хлористомедно-магниевый элемент, магний-ванадиевый элемент и др), и сухих элементов (марганцево-магниевый элемент, висмутисто-магниевый элемент, магний-м-ДНБ элемент и др). ХИТ на основе магния отличаются очень высокими значениями удельных энергетических характеристик и высоким разрядным напряжением. В последние годы в ряде стран обострилась проблема разработки аккумулятора с большим сроком службы, так как теоретические данные позволяют утверждать очень большие перспективы его широкого использования (высокая энергия, экологичность, доступность сырья).
Соединения
Гидрид магния — один из наиболее емких аккумуляторов водорода, применяемых для его хранения.
Огнеупорные материалы
Оксид магния MgO применяется в качестве огнеупорного материала для производства тиглей и специальной футеровки металлургических печей.
Перхлорат магния, Mg(ClO4)2 — (ангидрон) применяется для глубокой осушки газов в лабораториях, и в качестве электролита для химических источников тока с участием магния.
Фторид магния MgF2 — в виде синтетических монокристаллов применяется в оптике (линзы, призмы).
Бромид магния MgBr2 — в качестве электролита для химических резервных источников тока.
Медицина
Оксид и соли магния применяется в медицине (аспаркам, сульфат магния, цитрат магния, минерал бишофит). Бишофитотерапия использует биологические эффекты природного магния в лечении и реабилитации широкого круга заболеваний, в первую очередь — опорно-двигательного аппарата, нервной и сердечно-сосудистой систем.
Фотография
Магниевый порошок с окисляющими добавками (нитрат бария, нитрат аммония, перманганат калия, гипохлорит натрия, хлорат калия и т. д.) применялся (и применяется сейчас в редких случаях) в фотоделе в химических фотовспышках (магниевая фотовспышка).
Биологическая роль и токсикология
Магний — один из важных биогенных элементов, в значительных количествах содержится в тканях животных и растений. Магний является кофактором многих ферментативных реакций. Магний необходим для превращения креатина фосфата в АТФ — нуклеотид, являющийся универсальным поставщиком энергии в живых клетках организма. Поэтому магний является тем элементом, который контролирует энергетику организма. Магний необходим на всех этапах синтеза белка. Установлено также, что 80—90 % современных людей страдают от дефицита магния. Это может проявляться по-разному: бессоница, хроническая усталость, остеопороз, артрит, фибромиалгия, мигрень, мышечные судороги и спазмы, сердечная аритмия, запоры, предменструальный синдром (ПМС) и прочие симптомы и болезни. А при частом употреблении слабительных, алкоголя, больших психических и физических нагрузках потребность в магнии увеличивается.
К пище, богатой магнием, относятся: кунжут, отруби, орехи. Магния совсем мало в хлебе, молочных, мясных и других повседневных продуктах питания современного человека. Для получения суточной нормы магния, порядка 300 мг для женщин и 400 мг для мужчин, необходимо выпивать 2—3 литра молока или съедать 1,5—2 кг мяса.
По результатам последних исследований обнаружено, что цитрат магния является наиболее усваиваемым магниесодержащим продуктом.
Установлено, что чтобы усвоить кальций, организму необходим магний. Одним из наиболее биологически целесообразных источников магния при транскутанном (чрезкожном) всасывании является минерал бишофит, широко использующийся в целях медицинской реабилитации, физиотерапии и санаторно-курортного лечения.
Магний, Magnesium, Mg (12)
Название магнезия встречается уже в Лейденском папирусе-Х (Ш в.). Оно происходит, вероятно, от названия города в гористой местности Фессалии — Магнисия. Магнесийским камнем в древности назывались магнитная окись железа, а магнесом — магнит. Эти названия перешли в латинский и другие языки.
Внешнее сходство магнитной окиси железа с пиролизитом (двуокисью марганца) привело к тому, что магнезийским камнем, магнетисом и магне стали называть минералы и руды темной и темно-коричневой окраски, а в дальнейшем и другие минералы. В алхимической литературе слово магнес (Magnes) обозначало многие вещества, например ртуть, эфиопский камень, гераклийский камень. Минералы, rдержащие магний, тоже были известны с глубокой древности (доломит, тальк, асбест, нефрит и др.) и уже тогда находили широкое применение. Однако их считали не индивидуальными веществами, а видоизменениями других, более известных минералов, чаще всего извести.
Установить тот факт, что в магнийсодержащих минералах и солях присутствует особое металлическое основание, помогли исследования минеральной воды Эпсомского источника в Англии, открытого в 1618 г. Твердую соль из горькой эпсомской воды выделил в 1695 г. Грю, указав при этом, что по своей природе эта соль заметно отличается от всех других солей. В XVIII в. эпсомской солью занимались многие видные химики-аналитики — Бергман, Нейман, Блэк и др. Когда в континентальной Европе были открыты источники воды, подобной эпсомской, эти исследования расширились еще больше. По-видимому, Нейман первым предложил называть эпсомскую соль (карбонат магния) белой магнезией в отличие от черной магнезии (пиролюзита). Земля белой магнезии (Magnesia alba) под названием магнезия фигурирует в списке простых тел Лавуазье, причем синонимом этой земли Лавуазье считает «основание эпсомской соли» (base de sel d’Epsom).
В русской литературе начала XIX в. магнезия именовалась иногда горькоземом. В 1808 г. Дэви, подвергая белую магнезию электролизу, получил немного нечистого металлического магния; в чистом виде этот металл был получен Бусси в 1829 г. Вначале Дэви предложил назвать новый металл магнием (Magnium) в отличие от магнезии, которая в то время обозначала металлическое основание пиролюзита (Magnesium). Однако, когда название черной магнезии было изменено, Дэви предпочел называть металл магнезием. Интересно, что первоначальное название магний уцелело только в русском языке благодаря учебнику Гесса. В начале XIX в. предлагались и другие названия — магнезь (Страхов), магнезий, горькоземий (Щеглов).
Периодическая система химических элементов Менделеева
Классификация хим. элементов, устанавливающая зависимость различных свойств элементов от заряда атомного ядра. Система является графическим выражением периодического закона/
| IA | IIA | IIIB | IVB | VB | VIB | VIIB | —- | VIIIB | —- | IB | IIB | IIIA | IVA | VA | VIA | VIIA | VIIIA | |
| Период | ||||||||||||||||||
| 1 | 1 H Водород | 2 He Гелий | ||||||||||||||||
| 2 | 3 Li Литий | 4 Be Бериллий | 5 B Бор | 6 C Углерод | 7 N Азот | 8 O Кислород | 9 F Фтор | 10 Ne Неон | ||||||||||
| 3 | 11 Na Натрий | 12 Mg Магний | 13 Al Алюминий | 14 Si Кремний | 15 P Фосфор | 16 S Сера | 17 Cl Хлор | 18 Ar Аргон | ||||||||||
| 4 | 19 K Калий | 20 Ca Кальций | 21 Sc Скандий | 22 Ti Титан | 23 V Ванадий | 24 Cr Хром | 25 Mn Марганец | 26 Fe Железо | 27 Co Кобальт | 28 Ni Никель | 29 Cu Медь | 30 Zn Цинк | 31 Ga Галлий | 32 Ge Германий | 33 As Мышьяк | 34 Se Селен | 35 Br Бром | 36 Kr Криптон |
| 5 | 37 Rb Рубидий | 38 Sr Стронций | 39 Y Иттрий | 40 Zr Цирконий | 41 Nb Ниобий | 42 Mo Молибден | (43) Tc Технеций | 44 Ru Рутений | 45 Rh Родий | 46 Pd Палладий | 47 Ag Серебро | 48 Cd Кадмий | 49 In Индий | 50 Sn Олово | 51 Sb Сурьма | 52 Te Теллур | 53 I Иод | 54 Xe Ксенон |
| 6 | 55 Cs Цезий | 56 Ba Барий | * | 72 Hf Гафний | 73 Ta Тантал | 74 W Вольфрам | 75 Re Рений | 76 Os Осмий | 77 Ir Иридий | 78 Pt Платина | 79 Au Золото | 80 Hg Ртуть | 81 Tl Таллий | 82 Pb Свинец | 83 Bi Висмут | (84) Po Полоний | (85) At Астат | 86 Rn Радон |
| 7 | 87 Fr Франций | 88 Ra Радий | ** | (104) Rf Резерфордий | (105) Db Дубний | (106) Sg Сиборгий | (107) Bh Борий | (108) Hs Хассий | (109) Mt Мейтнерий | (110) Ds Дармштадтий | (111) Rg Рентгений | (112) Cp Коперниций | (113) Uut Унунтрий | (114) Uuq Унунквадий | (115) Uup Унунпентий | (116) Uuh Унунгексий | (117) Uus Унунсептий | (118) Uuo Унуноктий |
| 8 | (119) Uue Унуненний | (120) Ubn Унбинилий | ||||||||||||||||
| Лантаноиды * | 57 La Лантан | 58 Ce Церий | 59 Pr Празеодим | 60 Nd Неодим | (61) Pm Прометий | 62 Sm Самарий | 63 Eu Европий | 64 Gd Гадолиний | 65 Tb Тербий | 66 Dy Диспрозий | 67 Ho Гольмй | 68 Er Эрбий | 69 Tm Тулий | 70 Yb Иттербий | 71 Lu Лютеций | |||
| Актиноиды ** | 89 Ac Актиний | 90 Th Торий | 91 Pa Протактиний | 92 U Уран | (93) Np Нептуний | (94) Pu Плутоний | (95) Am Америций | (96) Cm Кюрий | (97) Bk Берклий | (98) Cf Калифорний | (99) Es Эйнштейний | (100) Fm Фермий | (101) Md Менделевий | (102) No Нобелей | (103) Lr Лоуренсий | |||
| Щелочные металлы | Щёлочноземельные металлы | Лантаноиды | Актиноиды | Переходные металлы |
| Лёгкие металлы | Полуметаллы | Неметаллы | Галогены | Инертные газы |
198095, г.Санкт-Петербург, ул.Швецова, д.23, лит.Б, пом.7-Н, схема проезда