какие связи поддерживают третичную структуру белка
Вторичная, третичная, четвертичная структуры белка. Химические связи, участвующие в образовании структур белка. Биологическая роль структурной организации белковых молекул.



В белках различают 2 основных типа конформации полипептидных цепей: вторичную и третичную структуры.
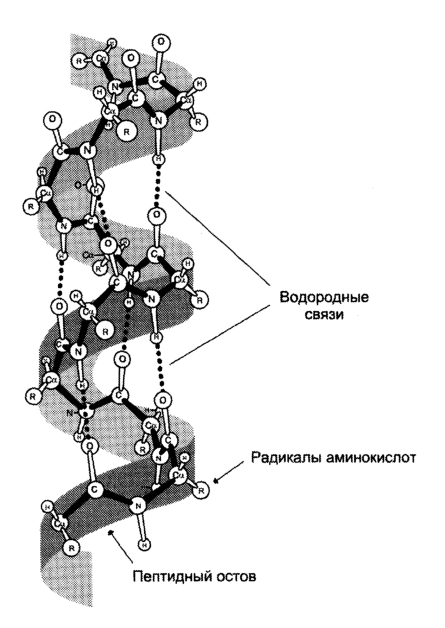
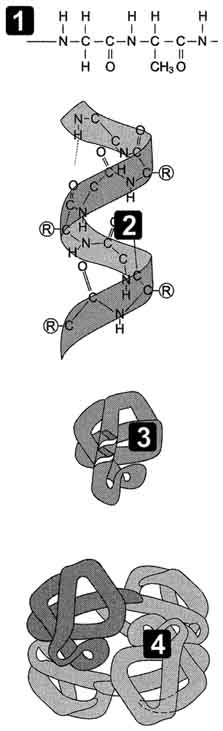
При этом пептидные цепи могут приобретать регулярные структуры двух типов: α-спирали
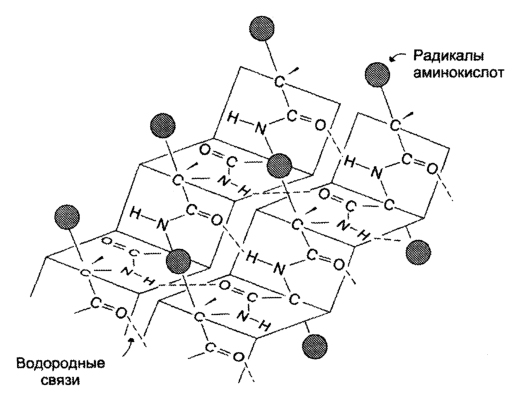
β-структрура Под β-структурой понимают фигуру, подобную листу, сложенному «гармошкой». Фигура формируется за счет образования множества водородных связей между атомами пептидных групп линейных областей одной полипептидной цепи, делающей изгибы, или между разными полипептидными группами.
Структурно состоит из элементов вторичной структуры, стабилизированных различными типами взаимодействий, в которых гидрофобные взаимодействия играют важнейшую роль
стабилизации третичной структуры белка принимают участие:
· ковалентные связи (между двумя остатками цистеина — дисульфидные мостики);
· ионные связи между противоположно заряженными боковыми группами аминокислотных остатков;
· гидрофильно-гидрофобные взаимодействия. При взаимодействии с окружающими молекулами воды белковая молекула «стремится» свернуться так, чтобы неполярные боковые группы аминокислот оказались изолированы от водного раствора; на поверхности молекулы оказываются полярные гидрофильные боковые группы.
4. Четвертичной структурой называют взаимное расположение нескольких полипептидных цепей в составе единого белкового комплекса. Белковые молекулы, входящие в состав белка с четвертичной структурой, образуются на рибосомах по отдельности и лишь после окончания синтеза образуют общую надмолекулярную структуру. В состав белка с четвертичной структурой могут входить как идентичные, так и различающиеся полипептидные цепочки. В стабилизации четвертичной структуры принимают участие те же типы взаимодействий, что и в стабилизации третичной. Надмолекулярные белковые комплексы могут состоять из десятков молекул.
Роль.
Образование пептидов в организме происходит в течение нескольких минут, химический же синтез в условиях лаборатории — достаточно длительный процесс, который может занимать несколько дней, а разработка технологии синтеза – несколько лет. Однако, несмотря на это, существуют довольно весомые аргументы в пользу проведения работ по синтезу аналогов природных пептидов. Во-первых, путём химической модификации пептидов возможно подтвердить гипотезу первичной структуры. Аминокислотные последовательности некоторых гормонов стали известны именно благодаря синтезу их аналогов в лаборатории.
Во-вторых, синтетические пептиды позволяют подробнее изучить связь между структурой аминокислотной последовательности и её активностью. Для выяснения связи между конкретной структурой пептида и его биологической активностью была проведена огромная работа по синтезу не одной тысячи аналогов. В результате удалось выяснить, что замена лишь одной аминокислоты в структуре пептида способна в несколько раз увеличить его биологическую активность или изменить её направленность. А изменение длины аминокислотной последовательности помогает определить расположение активных центров пептида и участка рецепторного взаимодействия.
В-третьих, благодаря модификации исходной аминокислотной последовательности, появилась возможность получать фармакологические препараты. Создание аналогов природных пептидов позволяет выявить более «эффективные» конфигурации молекул, которые усиливают биологическое действие или делают его более продолжительным.
В-четвёртых, химический синтез пептидов экономически выгоден. Большинство терапевтических препаратов стоили бы в десятки раз больше, если бы были сделаны на основе природного продукта.
Зачастую активные пептиды в природе обнаруживаются лишь в нанограммовых количествах. Плюс к этому, методы очистки и выделения пептидов из природных источников не могут полностью разделить искомую аминокислотную последовательность с пептидами противоположного или же иного действия. А в случае специфических пептидов, синтезируемых организмом человека, получить их возможно лишь путём синтеза в лабораторных условиях.
57. Классификация белков: простые и сложные, глобулярные и фибриллярные, мономерные и олигомерные. Функции белков в организме.
Классификация по типу строения
По общему типу строения белки можно разбить на три группы:
1. Фибриллярные белки — образуют полимеры, их структура обычно высокорегулярна и поддерживается, в основном, взаимодействиями между разными цепями. Они образуют микрофиламенты, микротрубочки, фибриллы, поддерживают структуру клеток и тканей. К фибриллярным белкам относятся кератин и коллаген.
2. Глобулярные белки — водорастворимы, общая форма молекулы более или менее сферическая.
3. Мембранные белки — имеют пересекающие клеточную мембрану домены, но части их выступают из мембраны в межклеточное окружение и цитоплазму клетки. Мембранные белки выполняют функцию рецепторов, то есть осуществляют передачу сигналов, а также обеспечивают трансмембранный транспорт различных веществ. Белки-транспортёры специфичны, каждый из них пропускает через мембрану только определённые молекулы или определённый тип сигнала.
Простые белки, Сложные белки
Помимо пептидных цепей, в состав многих белков входят и неаминокислотные группы, и по этому критерию белки делят на две большие группы — простые и сложные белки (протеиды). Простые белки состоят только из полипептидных цепей, сложные белки содержат также неаминокислотные, или простетические, группы.
Простые.
Среди глобулярных белков можно выделить:
1. альбумины — растворимы в воде в широком интервале рН (от 4 до 8,5), осаждаются 70-100%-ным раствором сульфата аммония;
2. полифункциональные глобулины с большей молекулярной массой, труднее растворимы в воде, растворимы в солевых растворах, часто содержат углеводную часть;
3. гистоны — низкомолекулярные белки с высоким содержанием в молекуле остатков аргинина и лизина, что обусловливает их основные свойства;
4. протамины отличаются еще более высоким содержанием аргинина (до 85 %), как и гистоны, образуют устойчивые ассоциаты с нуклеиновыми кислотами, выступают как регуляторные и репрессорные белки — составная часть нуклеопротеинов;
5. проламины характеризуются высоким содержанием глутаминовой кислоты (30-45 %) и пролина (до 15 %), нерастворимы в воде, растворяются в 50-90 % этаноле;
6. глутелины содержат около 45 % глутаминовой кислоты, как и проламины, чаще содержатся в белках злаков.
Фибриллярные белки характеризуются волокнистой структурой, практически нерастворимы в воде и солевых растворах. Полипептидные цепи в молекулах расположены параллельно одна другой. Участвуют в образовании структурных элементов соединительной ткани (коллагены, кератины, эластины).
Сло?жные белки?
(протеиды, холопротеины) — двухкомпонентные белки, в которых помимо пептидных цепей (простого белка) содержится компонент неаминокислотной природы — простетическая группа. При гидролизе сложных белков, кроме аминокислот, освобождается небелковая часть или продукты её распада.
В качестве простетической группы могут выступать различные органические (липиды, углеводы) и неорганические (металлы) вещества.
В зависимости от химической природы простетических групп среди сложных белков выделяют следующие классы [1] :
· Гликопротеиды, содержащие в качестве простетической группы ковалентно связанные углеводные остатки и их подкласс — протеогликаны, с мукополисахаридными простетическими группами. В образовании связи с углеводными остатками обычно участвуют гидроксильные группы серина или треонина. Большая часть внеклеточных белков, в частности, иммуноглобулины — гликопротеиды. В протеогликанах углеводная часть составляет
95 %, они являются основным компонентом межклеточного матрикса.
· Липопротеиды, содержащие в качестве простетической части нековалентно связанные липиды. Липопротеиды, образованные белками-аполипопротеинами связывающимися с ними липидами и выполняют функцию транспорта липидов.
· Металлопротеиды, содержащие негемовые координационно связанные ионы металлов. Среди металлопротеидов есть белки, выполняющие депонирующие и транспортные функции (например, железосодержащие ферритин и трансферрин) и ферменты (например, цинксодержащая карбоангидраза и различные супероксиддисмутазы, содержащие в качестве активных центров ионы меди, марганца, железа и других металлов)
· Фосфопротеиды, содержащие в качестве простетической группы ковалентно связанные остатки фосфорной кислоты. В образовании сложноэфирной связи с фосфатом участвуют гидроксильные группы серина или треонина, фосфопротеинами являются, в частности, казеин молока [3] :
· Хромопротеиды — собирательное название сложных белков с окрашенными простетическими группами различной химической природы. К ним относится множество белков с металлсодержащейпорфириновой простетической группой, выполняющие разнообразные функции — гемопротеины (белки, содержащие в качестве простетической группы гем — гемоглобин, цитохромы и др.), хлорофиллы;флавопротеиды с флавиновой группой, и др.
Фиброин
Свойства
Фиброин является гетеродимером, образованным двумя белковыми цепями. Его первичная структура состоит из повторяющейся аминокислотной последовательности (Gly-Ser-Gly-Ala-Gly-Ala) n.
В свою очередь, повторяющиеся аминокислотные последовательности образуют антипараллельные складчатые β-слои, связанные водородными связями. Эта структура обуславливает высокий предел прочности нитей паутин и шелка. Более прочный, чем кевлар, фиброин вдобавок ещё и высоко эластичен. Эти качества делают его материалом, применяемым в различных областях, включая биомедицину и текстильное производство.
Структуры
Структура белка
По вторичной структуре белка семейство кератинов разделяется на две группы:
Для первичной структуры α-кератинов характерно большое содержание цистеина и множество дисульфидных связей.
В отличие от α-кератинов поперечные дисульфидные связи между соседними полипептидными цепями у β-кератинов отсутствуют. В полипептидной цепи каждый второй элемент — глицин. Характерно повторение последовательности «GSGAGA».
Для α-кератинов основным структурным компонентом являются цилиндрические микрофибриллы диаметром 75 А, состоящие из спирализованных, скрученных попарно протофибрилл.
Какие связи поддерживают третичную структуру белка
У большинства белков полипептидные цепи свернуты особым образом в компактную глобулу. Способ свертывания полипептидных цепей глобулярных белков называется третичной структурой. Третичная структура поддерживается уже обсуждавшимися выше связями трех типов — ионными, водородными и дисульфидными, а также гидрофобными взаимодействиями.
В количественном отношении наиболее важны именно гидрофобные взаимодействия; белок при этом свертывается таким образом, чтобы его гидрофобные боковые цепи были скрыты внутри молекулы, а гидрофильные, наоборот, выставлены наружу.
Для определения третичной структуры белков можно использовать метод рентгеновского анализа. В результате исследований, растянувшихся на несколько лет, Джон Кендрью и Макс Перуц (Kendrew, Perutz) к началу 1959 г. определили этим методом вторичную и третичную структуру миоглобина и предложили модель его молекулы.
За эту работу в 1962 г. они были удостоены Нобелевской премии. Теперь для миоглобина были известны:
первичная структура миоглобина — молекула представляет собой одну полипептидную цепь, построенную из 153 аминокислотных остатков (их последовательность была установлена в начале 60-х годов);
вторичная структура миоглобина — около 75% цепи имеет а-спиральную конформацию (восемь спиральных участков);
третичная структура миоглобина — а-спираль свернута нерегулярным образом в компактную глобулу;
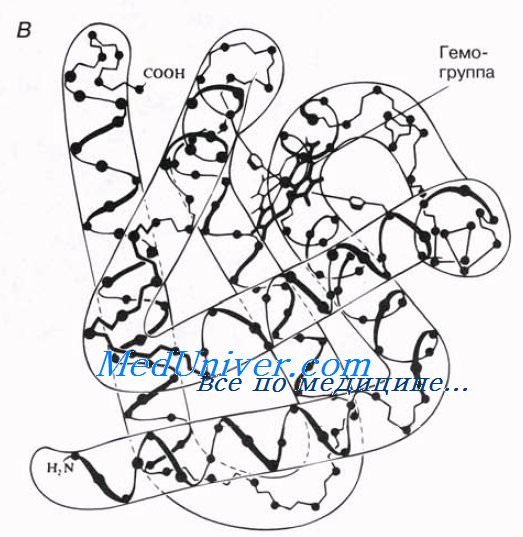
простетинеская группа миоглобина — гемогруппа, или гем (содержит железо).
Миоглобин синтезируется в мышцах, где он служит для запасания кислорода. Как и в гемоглобине, кислород в его молекуле связывается с гемом; от гема зависит красный цвет мышц. Определение третичной структуры белков все еще остается весьма трудоемким процессом. В последнее время в молекулярной биологии все больше усилий затрачивается на попытки использовать компьютеры и прочую технику, которая позволила бы предсказывать третичную структуру белка исходя из его уже известной первичной и вторичной структуры. Это открыло бы возможности для конструирования белков с определенной структурой, предназначенных для определенных функций, что могло бы сыграть очень важную роль и в промышленности, и в медицине.
На рисунке представлено несколько способов изображения третичной структуры белка. Еще один способ показан на рисунке. У белков с третичной структурой функция теснейшим образом зависит от точной формы молекулы. В этом особенно легко убедиться при знакомстве с ферментами.
Третичная структура белка
Под третичной структурой белка подразумевают пространственную ориентацию полипептидной спирали или способ укладки полипептидной цепи в определенном объеме. Поскольку ни первичная структура, ни типы спиралей или сочетания спиральных и линейных участков полипептидной цепи не дают представления об объеме, форме полипептидной цепи, перед исследователем всегда стоит необходимость определения трехмерной или пространственной конфигурации белка. Основную роль в решении этих задач сыграл рентгеноструктурный анализ с высокой разрешающей способностью. Как было отмечено, метод успешно решает две главные проблемы химии белков: закономерность последовательностей аминокислотных остатков в полипептиде и закономерность конфигурации молекулы белка. Межатомные расстояния в молекулах органических веществ составляют 0,1–0,2 нм, а максимальная разрешающая способность современных аппаратов равна 0,2 нм. Это не позволяет установить местоположение каждого атома, хотя вполне могут быть различимы отдельные сочетания атомов, особенно при введении в молекулу белков атомов тяжелых металлов (последние благодаря своей высокой электронной плотности используются в качестве точек отсчета при математической обработке рентгенограмм).
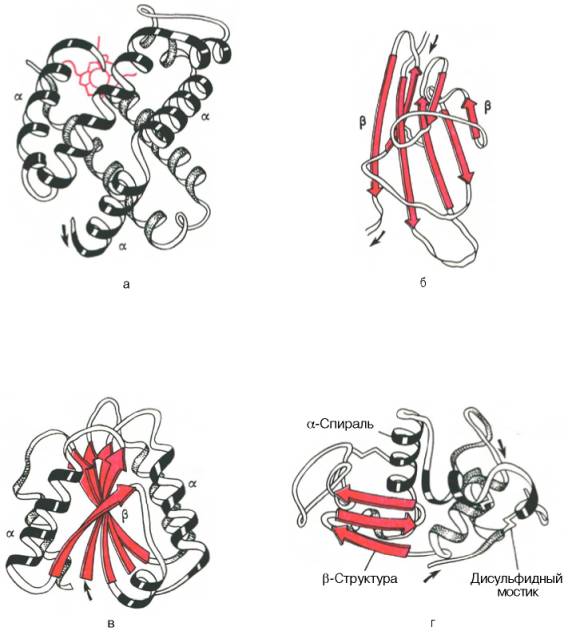
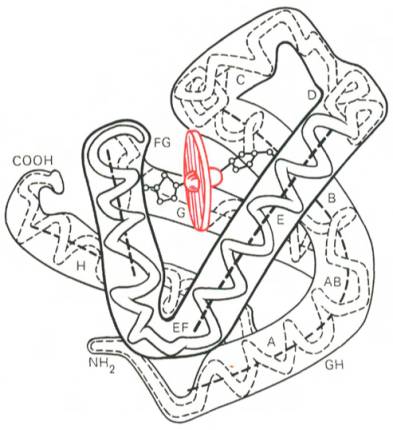
Рис. 1.19. Доменное строение глобулярных белков (по А. А. Болдыреву).
Рис. 1.20. Модель третичной структуры молекулы миоглобина (по Дж. Кендрью). Латинскими буквами обозначены структурные домены, красным цветом – гем.
Первым белком, третичная структура которого была выяснена Дж. Кендрью на основании рентгеноструктурного анализа, оказался мио-глобин кашалота. Это сравнительно небольшой белок с мол. м. 16700, содержащий 153 аминокислотных остатка (полностью выяснена первичная структура), представленный одной полипептидной цепью. Основная функция миоглобина – перенос кислорода в мышцах. Полипептидная цепь мио-глобина (рис. 1.20) представлена в виде изогнутой трубки, компактно уложенной вокруг гема (небелковый компонент, содержащий железо; см. главу 2).
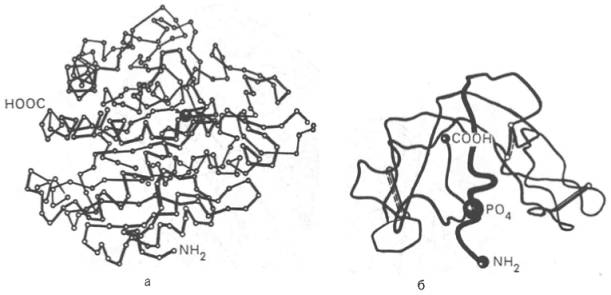
На протяжении последних десятилетий в связи с повышением разрешающей способности рентгеноструктурного метода была расшифрована третичная структура более 1000 белков, в том числе гемоглобина, пепсина, химотрипсина, рибонуклеазы, лизоцима, трипсина и его ингибитора, ряда фрагментов иммуноглобулинов человека, цитохрома С, карбоангидразы человека, аспартатаминотрансферазы, инсулина и др. Примеры трехмерной структуры некоторых из них представлены на рис. 1.21.
Рентгеноструктурный анализ позволяет определить конформацию и ход полипептидной цепи в пространстве, поэтому для каждого белка может быть построена объемная модель, отражающая местоположение линейных и спирализованных участков. При изучении глобулярных белков было показано, что пространственная структура белков в сильной степени зависит от ряда факторов, в частности от ионной силы и рН раствора, температуры и т.д. Новейшие методы дифракции рентгеновских лучей позволили расшифровать кристаллическую структуру более 100 ферментов. Для выяснения трехмерной структуры белков в последнее время успешно применяются также методы низкотемпературной вычислительной техники, а также математические и компьютерные методы определения объемной структуры на основании данных последовательностей аминокислот.
Рис. 1.21. Пространственная конфигурация карбоксипептидазы (а) и рибонуклеазы (б).
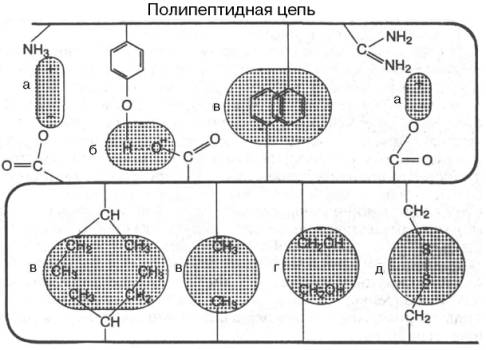
В настоящее время получены бесспорные доказательства, что в стабилизации пространственной структуры белков, помимо ковалентных связей (пептидные и дисульфидные связи), основную роль играют так называемые нековалентные связи (рис. 1.22). К этим связям относятся водородные связи, электростатические взаимодействия заряженных групп, межмолекулярные ван-дер-ваальсовы силы, взаимодействия неполярных боковых радикалов аминокислот, так называемые гидрофобные взаимодействия и т.д.
По современным представлениям, третичная структура белка после завершения его синтеза в рибосомах (см. главу 14) формируется совершенно автоматически, самопроизвольно и полностью предопределяется первичной структурой. Основной движущей силой в возникновении трехмерной структуры является взаимодействие радикалов аминокислот с молекулами воды. При этом неполярные гидрофобные радикалы аминокислот как бы погружаются внутрь белковой молекулы, образуя там сухие зоны, в то время как полярные радикалы оказываются ориентированными в сторону воды. В какой-то момент возникает термодинамически наиболее выгодная стабильная конформация молекулы. В такой форме белковая молекула характеризуется минимальной свободной энергией. Молекулы белков в водных растворах обычно принимают ряд стабильных конформаций, индуцируемых не только изменениями рН и температуры, но и низкомолекулярными соединениями. Различают две основные формы конформаций: Т-форму (от англ. tensed – напряженная) и R-форму (от англ. relaxed – расслабленная). Между этими формами осуществляются переходы, соответственно отражающиеся в биологических свойствах.
Рис. 1.22. Типы нековалентных связей, стабилизирующих третичную структуру белка.
В процессе укладки синтезированной полипептидной цепи, получившем название фолдинга – формирование нативной пространственной структуры, в клетках происходит отбор из множества стерически возможных состояний одной-единственной стабильной и биологически активной кон-формации, определяемой, вероятнее всего, первичной структурой. Описан ряд наследственных заболеваний человека, развитие которых связывают с нарушением вследствие мутаций процесса фолдинга (пигментозы, фиброзы и др.). Поэтому в настоящее время пристальное внимание исследователей приковано к выяснению зависимости между аминокислотной последовательностью синтезированной в клетке полипептидной цепи (первичная структура) и формированием пространственной трехмерной структуры, обеспечивающей белковой молекуле ее нативные свойства. Имеется немало экспериментальных доказательств, что этот процесс не является автоматическим, как предполагалось ранее, и, вероятнее всего, регулируется и контролируется также внутриклеточными молекулярными механизмами, детали которых пока полностью не раскрыты. Из клеток выделено несколько классов белков, названных шаперонами, или белками теплового шока, которые располагаются между N-концевым сигнальным пептидом и матричным белком. Предполагается, что основными функциями шаперонов являются способность предотвращать образование из полипептидной цепи неспецифических (хаотичных) беспорядочных клубков, или агрегатов белков, и обеспечение доставки (транспорта) их к субклеточным мишеням, создавая условия для завершения свертывания белковой молекулы. Эти результаты наводят на мысль о возможности существования «второй половины генетического кода», определяя тем самым повышенный интерес исследователей к проблеме свертывания полипептидной цепи и формирования ее нативной пространственной конформации.
Таким образом, линейная одномерная структура полипептидной цепи (т.е. последовательность аминокислотных остатков, обусловленная кодом белкового синтеза) наделена информацией другого типа – конформацион-ной, которая представляет собой образование белковой молекулы строго заданной формы с определенным пространственным расположением отдельных ее частей. Другими словами, третичная – объемная – структура белковой молекулы детерминирована аминокислотной последовательностью полипептидной цепи, а более конкретно – размером, формой и полярностью радикалов аминокислотных остатков. Эти представления могут служить основой для предсказания конформации белковой молекулы на основании аминокислотной последовательности. Следует указать, однако, что до сих пор представляется интригующей загадкой механизм этой тесной и тонкой связи между аминокислотной последовательностью и трехмерной структурой белковой молекулы. Оказывается, иногда полипептиды почти с одинаковыми последовательностями образуют разные структуры и, наоборот, полипептиды с разными последовательностями формируют одинаковую трехмерную структуру.
В свою очередь трехмерная структура белковой молекулы также содержит информацию, но уже совершенно нового типа, а именно функциональную, которую акад. В.А. Энгельгардт назвал интрамолекулярной информацией. Как будет показано далее, все биологические свойства белков (каталитические, гормональные, антигенные и др.) связаны с сохранностью их третичной структуры, которую принято называть нативной конформацией. Любые воздействия (термические, физические, химические), приводящие к нарушению этой конформации молекулы (разрыв водородных и других нековалентных связей), сопровождаются частичной или полной потерей белком его биологических свойств.
Строение и функции белков
Белки (протеины) составляют 50% от сухой массы живых организмов.
Белки состоят из аминокислот. У каждой аминокислоты есть аминогруппа и кислотная (карбоксильная) группа, при взаимодействии которых получается пептидная связь, поэтому белки еще называют полипептидами.
Структуры белка
Первичная – цепочка из аминокислот, связанных пептидной связью (сильной, ковалентной). Чередуя 20 аминокислот в разном порядке, можно получать миллионы разных белков. Если поменять в цепочке хотя бы одну аминокислоту, строение и функции белка изменятся, поэтому первичная структура считается самой главной в белке.
Вторичная – спираль. Удерживается водородными связями (слабыми).
Третичная – глобула (шарик). Четыре типа связей: дисульфидная (серный мостик) сильная, остальные три (ионные, гидрофобные, водородные) – слабые. Форма глобулы у каждого белка своя, от нее зависят функции. При денатурации форма глобулы меняется, и это сказывается на работе белка.
Четвертичная – имеется не у всех белков. Состоит из нескольких глобул, соединенных между собой теми же связями, что и в третичной структуре. (Например, гемоглобин.)
Денатурация
Это изменение формы глобулы белка, вызванное внешними воздействиями (температура, кислотность, соленость, присоединение других веществ и т.п.)
Функции белков
Их очень много, например:
Еще можно почитать
Задания части 1
Выберите один, наиболее правильный вариант. Вторичная структура молекулы белка имеет форму
1) спирали
2) двойной спирали
3) клубка
4) нити
Выберите один, наиболее правильный вариант. Водородные связи между СО- и NН-группами в молекуле белка придают ей форму спирали, характерную для структуры
1) первичной
2) вторичной
3) третичной
4) четвертичной
Выберите один, наиболее правильный вариант. Четвертичная структура молекулы белка образуется в результате взаимодействия
1) участков одной белковой молекулы по типу связей S-S
2) нескольких полипептидных нитей, образующих клубок
3) участков одной белковой молекулы за счет водородных связей
4) белковой глобулы с мембраной клетки
Выберите один, наиболее правильный вариант. Последовательность и число аминокислот в полипептидной цепи – это
1) первичная структура ДНК
2) первичная структура белка
3) вторичная структура ДНК
4) вторичная структура белка
Выберите один, наиболее правильный вариант. Вторичная структура белка, имеющая форму спирали, удерживается связями
1) пептидными
2) ионными
3) водородными
4) ковалентными
Выберите один, наиболее правильный вариант. Первичная структура белка образована связью
1) водородной
2) макроэргической
3) пептидной
4) ионной
Выберите один, наиболее правильный вариант. В основе образования пептидных связей между аминокислотами в молекуле белка лежит
1) принцип комплементарности
2) нерастворимость аминокислот в воде
3) растворимость аминокислот в воде
4) наличие в них карбоксильной и аминной групп
БЕЛКИ
1. Выберите три варианта. Белки в организме человека и животных
1) составляют бо́льшую часть организма по массе
2) начинают расщепляться в ротовой полости
3) не содержат фосфора в составе молекулы
4) могут откладываться в запас
5) в качестве ферментов ускоряют химические реакции
6) служат основным строительным материалом
2. Выберите три верных ответа из шести и запишите цифры, под которыми они указаны. Выберите только особенности строения белковой молекулы.
1) содержит атомы фосфора
2) состоит из аминокислот
3) мономеры удерживаются пептидными связями
4) состоит из одинаковых по строению мономеров
5) изменяет форму под действием температуры
6) четвертичная структура состоит из нескольких молекул
БЕЛКИ КРОМЕ
1. Все перечисленные признаки, кроме двух, можно использовать при описании яичного белка альбумина. Определите два признака, «выпадающие» из общего списка, и запишите цифры, под которыми они указаны.
1) состоит из аминокислот
2) пищеварительный фермент
3) денатурирует обратимо при варке яйца вкрутую
4) мономеры связаны пептидными связями
5) молекула образует первичную, вторичную и третичную структуры
2. Все перечисленные ниже признаки, кроме двух, можно использовать для описания молекулы белка. Определите два признака, «выпадающих» из общего списка, и запишите цифры, под которыми они указаны.
1) состоит из нуклеотидов
2) может иметь форму глобулы
3) имеет третичную и четвертичную структуры
4) образуется в ядре
5) бывают глобулярные и фибриллярные
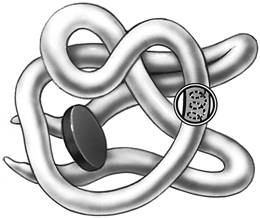
БЕЛКИ КРОМЕ РИС
1. Перечисленные ниже признаки, кроме двух, используются для описания строения, функций изображенного органического вещества. Определите два признака, «выпадающие» из общего списка, и запишите цифры, под которыми они указаны.
1) имеет структурные уровни организации молекулы
2) входит в состав клеточных стенок
3) является биополимером
4) служит матрицей при трансляции
5) состоит из аминокислот

2. Все перечисленные ниже признаки, кроме двух, используются для описания изображённой на рисунке структуры. Определите два признака, «выпадающие» из общего списка, и запишите цифры, под которыми они указаны.
1) вторичная структура молекулы белка
2) удерживается только пептидными связями
3) определяется методом рентгеноструктурного анализа
4) представляет собой глобулу
5) может выполнять ферментативные функции

3. Все перечисленные ниже характеристики, кроме двух, используют для описания изображенной на рисунке молекулы органического вещества клетки. Определите две характеристики, «выпадающие» из общего списка, и запишите цифры, под которыми они указаны.
1) денатурация
2) репликация
3) транскрипция
4) аминокислоты
5) водородные связи
СТРУКТУРЫ БЕЛКА
Установите соответствие между характеристикой и структурой белка: 1) первичная, 2) третичная. Запишите цифры 1 и 2 в порядке, соответствующем буквам.
А) молекула в форме глобулы или фибриллы
Б) строгая последовательность аминокислотных остатков
В) аминокислотные остатки соединены только пептидными связями
Г) имеет дисульфидные мостики между радикалами аминокислот
Д) при ее разрушении наступает необратимая денатурация
Е) пространственная конфигурация полипептидной цепи
ФЕРМЕНТАТИВНАЯ
1. Все приведенные ниже признаки, кроме двух, можно использовать для описания ферментов. Определите два признака, «выпадающих» из общего списка, и запишите цифры, под которыми они указаны.
1) входят в состав клеточных мембран и органоидов клетки
2) играют роль биологических катализаторов
3) имеют активный центр
4) оказывают влияние на обмен веществ, регулируя различные процессы
5) специфические белки
2. Выберите три верных ответа из шести и запишите цифры, под которыми они указаны. Ферменты – это вещества, которые
1) вырабатываются в железах внутренней секреции
2) являются белками
3) поступают в организм, как правило, вместе с пищей
4) являются в организме источником энергии
5) ускоряют протекание химических реакций
6) у человека выполняют свои функции при температуре около 36 градусов
ФУНКЦИИ БЕЛКОВ
Выберите три верных ответа из шести и запишите цифры, под которыми они указаны. Функциями белков в организме человека являются
1) строительная
2) передача наследственных признаков
3) защитная
4) запасающая
5) ферментативно-каталитическая
6) хранение генетической информации
ФУНКЦИИ БЕЛКОВ КРОМЕ
Все перечисленные характеристики используют для описания функций белков. Определите две характеристики, «выпадающие» из общего списка, и запишите цифры, под которыми они указаны.
1) регуляторная
2) двигательная
3) рецепторная
4) образуют клеточные стенки
5) служат коферментами

Рассмотрите рисунок с изображением полипептида и укажите (А) уровень его организации, (Б) форму молекулы и (В) вид взаимодействия, поддерживающий эту структуру. Для каждой буквы выберите соответствующий термин или соответствующее понятие из предложенного списка.
1) первичная структура
2) вторичная структура
3) третичная структура
4) взаимодействия между нуклеотидами
5) металлическая связь
6) гидрофобные взаимодействия
7) фибриллярная
8) глобулярная

Рассмотрите схему химического вещества. Укажите (А) название класса органических веществ, (Б) уровень организации полимерной молекулы и (В) название мономеров, из которых состоит данная молекула. Для каждой буквы выберите соответствующий термин из предложенного списка.
1) ДНК
2) белок
3) альфа-спираль
4) вторичная структура
5) третичная структура
6) аминокислоты
7) нуклеотиды
8) рибоза

Рассмотрите рисунок с изображением полипептида. Укажите (А) уровень его организации, (Б) мономеры, которые его образуют, и (В) вид химических связей между ними. Для каждой буквы выберите соответствующий термин или соответствующее понятие из предложенного списка.
1) первичная структура
2) водородные связи
3) двойная спираль
4) вторичная структура
5) аминокислота
6) альфа-спираль
7) нуклеотид
8) пептидные связи

Проанализируйте таблицу «Уровни организации белка». Для каждой ячейки, обозначенной буквой, выберите соответствующий термин из предложенного списка.
1) глобула
2) двойная спираль
3) эфирные
4) гидрофильные
5) пептидные
6) нитчатая
7) вторичная
8) четвертичная
Известно, что белки – нерегулярные полимеры, имеющие высокую молекулярную массу, строго специфичны для каждого вида организма. Выберите из приведенного ниже текста три утверждения, по смыслу относящиеся к описанию этих признаков, и запишите цифры, под которыми они указаны. (1) В состав белков входит 20 различных аминокислот, соединенных пептидными связями. (2) Белки имеют различное количество аминокислот и порядок их чередования в молекуле. (3) Низкомолекулярные органические вещества имеют молекулярную массу от 100 до 1000. (4) Они являются промежуточными соединениями или структурными звеньями – мономерами. (5) Многие белки характеризуются молекулярной массой от нескольких тысяч до миллиона и выше, в зависимости от количества отдельных полипептидных цепей в составе единой молекулярной структуры белка. (6) Каждый вид живых организмов имеет особый, только ему присущий набор белков, отличающий его от других организмов.