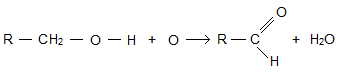какие связи в молекуле формальдегида
Глоссарий. Химия
Строение молекул
Для определения химической формулы органического вещества небольшую его массу сжигают, а затем исследуют продукты сгорания. Так, например, при сжигании 3,75 г формальдегида получили 2,25 г водяного пара и 5,5 г оксида углерода (IV). Установили, что плотность паров формальдегида по водороду 15. Пользуясь этими данными, находят, сколько граммов углерода и водорода содержится в 3,75 г формальдегида: M (CO2 ) = 12 + 32 = 44; M = 44 г / моль 44 г CO2 содержит 12 г 5,5 г CO2 » x1 44 ÷ 5,5 = 12 ÷ x1; x1 = (5,5 · 12) / 44 = 1,5; m (C) = 1,5 г M (H2O) = 2 + 16 = 18; M = 18 г / моль 18 г H2O содержит 2 г 2,25 г H2O » x2 18 ÷ 2,25 = 2 ÷ x2; x2 = (2,25 · 2) / 18 = 0,25; m (H) = 0,25 г Находят общую массу углерода и водорода: x1 + x2 = 1,5 + 0,25 = 1,75
Определяют простейшую формулу: C : H : O = (1,5 ÷ 12) : (0,25 ÷ 1) : (2 ÷ 16) = 0,125 : 0, 25 : 0,125 = 1 : 2 : 1 Следовательно, простейшая формула исследуемого вещества CH2O. Зная плотность паров формальдегида по водороду, вычисляют его молярную массу: M = 2D (H2 ) = 2 · 15 = 30; M = 30 г / моль
Находят молярную массу по простейшей формуле: M (CH2O) = 12 + 2 + 16 = 30; M (CH2O) = 30 г / моль Следовательно, молекулярная формула формальдегида CH2O В молекуле формальдегида между атомами углерода и водорода существуют σ—связь, а между атомами углерода и кислорода — одна σ— и одна π—связь.
Изомерия и номенклатура
Для альдегидов характерна изомерия углеводородного радикала. Он может иметь либо неразветвленную, либо разветвленную цепь. Названия альдегидов происходят от исторических названий соответствующих органических кислот, в которые они превращаются при окислении (муравьиный альдегид, уксусный альдегид, пропионовый альдегид и др.). По международной номенклатуре названия альдегидов производят от названий соответствующих углеводородов с прибавлением суффикса -аль.
Важнейшие представители альдегидов. Метаналь, или формальдегид* Этаналь, или ацетальдегид* Пропаналь Бутаналь 2-Метилпропаналь Пентаналь Гексаналь
Получение
В лаборатории альдегиды получают окислением первичных спиртов. В качестве окислителей применяют оксид меди (II), пероксид водорода и другие вещества, способные отдавать кислород. В общем виде это можно показать так:
В промышленности альдегиды получают различными способами. Экономически наиболее выгодно получать метаналь непосредственным окисление метана кислородом воздуха в специальном реакторе. Чтобы метаналь не успел окислиться, смесь метана с воздухом через зону реакции пропускают с большой скоростью. Метаналь получают также окислением метанола, пропуская его пары вместе с воздухом через реактор с раскаленной медной или серебряной сеткой. Однако этот способ экономически менее выгоден. Этаналь можно получить и гидратацией ацетилена в присутствии солей ртути в качестве катализатора (реакция М. Г. Кучерова). Так как в этой реакции в качестве катализатора используют ядовитые вещества — соли ртути, то в последнее время разработан новый метод получения ацетальдегида: смесь этилена с воздухом пропускают через водный раствор солей меди, железа и палладия.
Физические свойства
Химические свойства
Для альдегидов наиболее характерны реакции окисления и присоединения.
1. Реакции окисления
а) Качественной реакцией на альдегиды является реакция «Серебряного зеркала». Для ее осуществления в чистую пробирку наливают аммиачный раствор оксида серебра (I) (Ag2O в воде практически не растворяется, но с аммиаком образует растворимое соединение [Ag (NH3)2]OH), к нему добавляют раствор альдегида и нагревают. Восстановленное серебро оседает на стенках пробирки в виде блестящего налета, а альдегид окисляется в соответствующую органическую кислоту. б) Другой характерной реакцией является окисление альдегидов гидроксидом меди (II). Если к голубому осадку гидроксида меди (II) прилить раствор альдегида и смесь нагреть, то сначала появляется желтый осадок гидроксида меди (I), который при дальнейшем нагревании превращается в красный оксид меди (I). В этой реакции окислителем является медь со степенью окисления +2, которая восстанавливается до степени окисления +1.
2. Реакции присоединения
Реакции присоединения обусловлены наличием в карбонильной группе π—связи, которая легко разрывается. По месту ее разрыва присоединяются атомы и атомные группы. Так, например, при пропускании смеси метаналя с водородом над нагретым катализатором происходит его восстановление в метанол. Аналогично присоединяют водород и другие альдегиды.
Какие связи в молекуле формальдегида
Органические соединения, в молекуле которых имеется карбонильная группа , называются карбонильными или оксосоединениями. Альдегиды – соединения, в которых карбонильная группа связана с углеводородным радикалом и с атомом водорода, в кетонах карбонил связан с двумя одинаковыми или различными углеводородными группами. Исключение составляет простейший альдегид – метаналь, в формуле которого вместо радикала содержится атом водорода:
. Общая формула предельных альдегидов и кетонов `»C»_»n»»H»_(2″n»)»O»`.
Атом углерода в карбонильной группе находится в состоянии `»sp»^2`-гибридизации и образует три `σ`-связи (одна из них `»C»–»O»`). Эти связи располагаются в одной плоскости под углом `120^@` друг к другу, а `π`-связь образована негибридной `р`-орбиталью атома углерода и `р`-орбиталью атома кислорода.
Двойная связь `»C»=»O»` карбонильной группы является сочетанием `σ`- и `π`-связей; она сильно поляризована за счёт смещения электронной плотности `π`-связи к более электроотрицательному атому кислорода.
Поэтому карбонильный атом углерода приобретает частичный положительный заряд, а атом кислорода – частичный отрицательный заряд. Изогнутая стрелка показывает поляризацию `π`-связи.
альдегидов связана только с изомерией углеродного скелета, изомерия кетонов со строением углеродного скелета и с положением функциональной группы. Альдегиды и кетоны с одинаковым числом атомов углерода изомерны друг другу. Примеры изомерии углеродного скелета:
и положения функциональной группы:
Карбонильные соединения не образуют между собой водородных связей, поскольку в их молекулах нет атомов водорода с частичным положительным зарядом `delta+` на нём. Формальдегид – газ, остальные – жидкости или твёрдые вещества. Формальдегид, ацетальдегид и ацетон хорошо растворимы в воде, что можно объяснить установлением водородных связей между молекулами этих соединений и воды:
Увеличение числа углеродных атомов в углеводородном радикале приводит к снижению растворимости алифатических альдегидов и кетонов.
1. Окисление спиртов (см. «Спирты», химические свойства, мягкое окисление).
2. Гидратация алкинов (см. «Алкины», химические свойства, реакция Кучерова).
3. Простейший кетон – ацетон – получают кумольным методом вместе с фенолом (см. «Фенолы», получение из кумола)
4. Щелочной гидролиз геминальных (содержащих два галогена около одного углеродного атома) дигалогеналканов. Образующиеся неустойчивые диолы претерпевают самопроизвольную дегидратацию с образованием альдегидов, если гидроксильные группы оказались у концевого атома:
и кетонов – в остальных случаях:
5. Каталитическое дегидрирование спиртов (промышленный способ). Процесс осуществляется пропусканием паров спирта над медью, никелем или оксидом цинка. При дегидрировании первичных спиртов получают альдегиды, вторичных – кетоны:
6. Окисление углеводородов кислородом воздуха в присутствии катализаторов (промышленный метод для получения низших альдегидов и кетонов):
`2″CH»_2=»CH»_2+»O»_2->2″CH»_3″CH»=»O» («кат». «PdCl»_2 «и» «CuCl»_2)`
`2″CH»_3-«CH»=»CH»_2+»O»_2->2″CH»_3″COCH»_3 («кат». «PdCl»_2 «и» «CuCl»_2)`.
7. Декарбоксилирование кальциевых или бариевых солей карбоновых кислот приводит к образованию кетонов:
Характерными реакциями для альдегидов являются: нуклеофильное присоединение `»A»_»N»`, реакции окисления, полимеризация и поликонденсация. Кетоны менее активны в реакциях `»A»_»N»`. Это объясняется тем, что у кетонов в молекуле не один, а два углеводородных радикала, присоединённых к карбонильной группе. Электронодонорные группы уменьшают `delta+` на атоме углерода карбонила, снижая реакционную способность кетонов в реакциях нуклеофильного присоединения. Кетоны окисляются с большим трудом, при этом происходит расщепление углеродного скелета; они не реагируют c `»Cu»(«OH»)_2` и `[«Ag»(«NH»_3)_2]»OH»`. Кетоны не вступают в реакции полимеризации.
Важнейшие реакции `»A»_»N»`
2. Реакция с гидросульфитом натрия (нуклеофил – ион `»SO»_3″Na»^-`)
Эта реакция позволяет не только обнаружить карбонильные соединения, но и выделить альдегиды и кетоны, поскольку сульфопроизводное выпадает в осадок в избытке гидросульфита.
3. Взаимодействие со спиртами в присутствии каталитических количеств кислоты:
4. Присоединение реактива Гриньяра. Галогеноводороды при взаимодействии с магнием в растворе абсолютного диэтилового эфира образуют магнийорганическое соединение или реактивы Гриньяра:
Присоединение реактивов Гриньяра к карбонильным соединениям с после дующим гидролизом промежуточных алкоголятов магния приводит к спиртам:
5. Присоединение воды. Гидратация оксосоединений – обратимая реакция. Устойчивость образующихся гидратов определяется величиной `delta+` на атоме углерода группы и её пространственным окружением. Так, формальдегид и трихлорацеталь гидратированы практически нацело, ацетальдегид – наполовину, а ацетон практически не гидратирован:
Окислительно-восстановительные реакции
1. Гидрирование (восстановление) карбонильных соединений (см. «Спирты», получение). В лабораторных условиях для восстановления используют `»LiAlH»_4`.
2. Реакция «серебряного зеркала»:
Выделяющееся серебро осаждается тонким слоем на стенках пробирки, образуя зеркальный налёт. Это – качественная реакция на альдегиды (формальдегид в этой реакции окисляется до `»CO»_2`). Раньше эту реакцию использовали для изготовления зеркал, ёлочных игрушек.
3. Окисление гидроксидом меди (II) также является качественной реакцией на альдегиды. При нагревании свежеосаждённого `»Cu»(«OH»)_2` вначале образуется жёлтый осадок `»СuOH»`, который разлагается с образованием оксида меди (I) красного цвета:
4. Окисление альдегидов раствором перманганата калия:
б) в щелочной среде:
в) в нейтральной среде:
Реакции поликонденсации и полимеризации
1. Реакции полимеризации характерны для низших альдегидов:
В результате реакции получается твёрдое вещество – пара-формальдегид. Кетоны не подвергаются полимеризации.
2. Формальдегид вступает в реакцию поликонденсации с фенолом. В результате реакции каждая молекула формальдегида связывает между собой две молекулы фенола и происходит отщепление одной молекулы воды:
Процесс поликонденсации протекает с образованием линейного полимера, в котором молекулы формальдегида присоединяются в орто-положение:
Возможно образование и более сложных «сшитых» полимерных соединений.
Химические свойства и способы получения муравьиного альдегида
В молекулах альдегидов имеется несколько реакционных центров: электрофильный центр (карбонильный атом углерода), участвующий в реакциях нуклеофильного присоединения; основный центр – атом кислорода с неподеленными электронными парами; Н-С(О)-Н кислотный центр, отвечающий за реакции конденсации; связь С-Н, разрывающаяся в реакциях окисления.
Реакции присоединения
1. Присоединение водорода (восстановление):
Н-CH=O + H2 (t,Ni) → Н-CH2-OH (метиловый спирт);
2. Присоединение аммиака:
3. Присоединение бисульфита натрия:
4. Присоединение циановодородной кислоты (синильной):
Н-CH=O + H-CN → H-CH(CN)-OH;
5. Присоединение гидразина с образованием гидразона:
6. Присоединение аминов с образованием N-замещенного имина:
7. Присоединение тиола с образованием дитиоацеталя (в кислой среде):
8. Присоединение воды с образованием гем-диола:
Н-CH=O + Н-ОН → Н-CH(OH)-OH.
При действии щелочи на формалин получаются метиловый спирт и муравьиная кислота:
2Н-CH=O + Н-ОН → СН3-ОН + Н-СООН.
В присутствии щелочей в водном растворе может идти и другая реакция: формальдегид конденсируется, причем в числе прочих продуктов получается один из простейших сахаров, или гексоз:
9. Присоединение спирта с образованием полуацеталя:
10. При взаимодействии формальдегида с ацетальдегидом в газовой фазе в присутствии катализаторов (окись алюминия, ацетат свинца на силикагеле и др.) образуется акролеин:
В водном растворе при большом избытке формальдегида под влиянием гидроокиси кальция конденсация с ацетальдегидом приводит к пентаэритриту:
Высшие алифатические альдегиды дают в этих условиях окси-или диоксиальдегиды (в зависимости от числа H-водородных атомов):
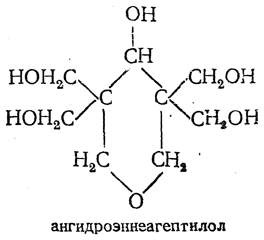
Формальдегид при взаимодействии с ацетоном образует ангидроэннеагептилол:
Реакции окисления
1. Альдегиды – довольно сильные восстановители, и поэтому легко окисляются различными окислителями, например: KMnO4, K2Cr2O7, [Ag(NH3)2]OH, Cu(OH)2. Все реакции идут при нагревании:
Реакции полимеризации
1. Реакция с фенолом с образованием фенолформальдегидных смол:
Получение формальдегида:
Промышленные методы получения формальдегида
1. Окисление метанола.
Реакция проводится в присутствии серебряного катализатороа и при нагревании (около 650—720 °C) или при 400 °C в присутствиии железо-никилиевых катализаторов:
2. Реакция дегидрирования метанола.
Процесс проводится на цинк-медных катализаторах при 600 °C:
3. Окисление метана.
Реакцию проводят при температуре 450 °C и давлении 1—2 МПа на катализаторе AlPO4.
Лабораторные способы получения формальдегида
1. Восстановление метанола:
Реакцию проводят, опуская раскаленную медную проволоку в пробирку с метанолом, образуется резкий запах альдегида. Если процесс окисления повторить несколько раз, то можно получить значительную концентрацию формальдегида.
2. Реакция метанола с перманганатом калия:
Смесь слабого раствора марганцовки и метанола нагревают до кипения. Появляется запах формальдегида, а фиолетовая окраска перманганата исчезает.
3. Реакция метанола с бихроматом калия:
В насыщенный раствор бихромата калия К2Сг2О7 добавляют такой же объем концентрированной серной кислоты. Затем по каплям вводят метанол. Очень осторожно подогревают смесь (отверстие пробирки направляют в сторону!). Реакция идет с выделением тепла. Желтая окраска хромовой смеси исчезает, и появляется зеленая окраска сульфата хрома.
Какие связи в молекуле формальдегида
Систематические названия кетонов производят от названий радикалов (в порядке увеличения) с добавлением слова кетон.
В более общем случае название кетона строится по названию соответствующего углеводорода и суффикса -он; нумерацию цепи начинают от конца цепи, ближайшего к карбонильной группе.
Физические свойства альдегидов
Метаналь (формальдегид) – газ, альдегиды С2-C5 и кетоны С3-С4 – жидкости, высшие – твердые вещества. Низшие гомологи растворимы в воде, благодаря образованию водородных связей между атомами водорода молекул воды и карбонильными атомами кислорода. С увеличением углеводородного радикала растворимость в воде падает.
Альдегиды обладают удушливым запахом, который при многократном разведении становится приятным, напоминая запах плодов. Альдегиды кипят при более низкой температуре, чем спирты с тем же числом углеродных атомов. Это cвязано с отсутствием в альдегидах водородных связей. В то же время температура кипения альдегидов выше, чем у соответствующих по молекулярной массе углеводородов, что связано с высокой полярностью альдегидов.
Физические свойства некоторых альдегидов:
Формальдегид – газ, с резким запахом, раздражает слизистые ткани и оказывает действие на центральную нервную систему. ОПАСЕН ДЛЯ ЗДОРОВЬЯ! Водный раствор формальдегида – формалин.
Акролеин СН2 = CH CH = O акриловый альдегид, пропеналь (в производстве полимеров) – образуется при пригорании жиров, жидкость с неприятным запахом, раздражает слизистые ткани.
Бензальдегид C 6 H 5 CH = O (производство красителей) – жидкость с запахом горького миндаля, содержится в миндале, листьях черёмухи, косточках персиков, абрикосов.
Строение карбонильной группы
Свойства альдегидов и кетонов определяются строением карбонильной группы >C=O.
Альдегиды характеризуются высокой реакционной способностью. Большая часть их реакций обусловлена наличием карбонильной группы.
Связь С=О сильно полярна. Электроны кратной связи С=О, в особенности более подвижные π-электроны, смещены к электроотрицательному атому кислорода, что приводит к появлению на нем частичного отрицательного заряда. Карбонильный углерод приобретает частичный положительный заряд
Какие связи в молекуле формальдегида
Представьте себе запах свежеиспеченной булочки с ванилью… ммм! Вкуснотища!
Когда этот ароматизатор добавляют в выпечку, слюнки текут!
А знаете, что из себя представляет ванилин?
Структурная формула:
Урок поможет вам получить представление о теме «Карбонильные соединения. Строение, изомерия, номенклатура». На этом занятии вы узнаете, от чего зависят свойства карбонильных соединений и на какие два больших класса их делят. Вы также рассмотрите не только их строение и изомерию, но и то, как происходит формирование их названий по систематической номенклатуре.
I. Понятие “карбонильные соединения”
Вы уже знаете, что при окислении спиртов могут быть получены альдегиды или кетоны. Свойства карбонильных соединений очень сильно зависят от того, какие атомы или группы атомов связаны с карбонильной группой. Карбонильная группа – группа из атомов С и О, связанных двойной связью:
Карбонильные соединения делят на два класса – альдегиды и кетоны.
соединения, в которых карбонильная группа связана хотя бы с одним атомом водорода
Общая формула RCOH или С n H2nO
соединения, в которых карбонильная группа связана только с атомами углерода
Общая формула RCOR1 или С n H2nO
Рис. 1. Альдегиды в природе
Первый член ряда альдегидов – формальдегид, или муравьиный альдегид, или метаналь. В его молекуле карбонильная группа связана только с атомами водорода: H2C=O
II. Номенклатура альдегидов и кетонов
Систематические названия альдегидов строят по названию соответствующего углеводорода с добавлением суффикса -аль. Нумерацию цепи начинают с карбонильного атома углерода.
Тривиальные названия производят от тривиальных названий тех кислот, в которые альдегиды превращаются при окислении.
Формула
Название
метаналь
муравьиный альдегид (формальдегид)
этаналь
уксусный альдегид (ацетальдегид)
пропаналь
бутаналь
2-метил-пропаналь
пентаналь
CH3CH=CHCH=O
бутен-2-аль
Систематические названия кетонов производят от названий радикалов (в порядке увеличения) с добавлением слова кетон.
В более общем случае название кетона строится по названию соответствующего углеводорода и суффикса -он; нумерацию цепи начинают от конца цепи, ближайшего к карбонильной группе.
III. Физические свойства альдегидов
Метаналь (формальдегид) – газ, альдегиды С2-C5 и кетоны С3-С4 – жидкости, высшие – твердые вещества. Низшие гомологи растворимы в воде, благодаря образованию водородных связей между атомами водорода молекул воды и карбонильными атомами кислорода. С увеличением углеводородного радикала растворимость в воде падает.
Альдегиды обладают удушливым запахом, который при многократном разведении становится приятным, напоминая запах плодов. Альдегиды кипят при более низкой температуре, чем спирты с тем же числом углеродных атомов. Это cвязано с отсутствием в альдегидах водородных связей. В то же время температура кипения альдегидов выше, чем у соответствующих по молекулярной массе углеводородов, что связано с высокой полярностью альдегидов.
Физические свойства некоторых альдегидов
Формальдегид – газ, с резким запахом, раздражает слизистые ткани и оказывает действие на центральную нервную систему. ОПАСЕН ДЛЯ ЗДОРОВЬЯ! Водный раствор формальдегида – формалин.
АкролеинСН2 = CHCH=Oакриловый альдегид, пропеналь (в производстве полимеров) – образуется при пригорании жиров, жидкость с неприятным запахом, раздражает слизистые ткани.
Бензальдегид C6H5CH=O (производство красителей) – жидкость с запахом горького миндаля, содержится в миндале, листьях черёмухи, косточках персиков, абрикосов.
IV. Строение карбонильной группы
Свойства альдегидов и кетонов определяются строением карбонильной группы >C=O.
Альдегиды характеризуются высокой реакционной способностью. Большая часть их реакций обусловлена наличием карбонильной группы.
Связь С=О сильно полярна. Электроны кратной связи С=О, в особенности более подвижные π-электроны, смещены к электроотрицательному атому кислорода, что приводит к появлению на нем частичного отрицательного заряда. Карбонильный углерод приобретает частичный положительный заряд
V. Изомерия альдегидов и кетонов
Изомерия альдегидов
1. Изомерия углеродного скелета, начиная с С4
2. Межклассовая изомерия
Изомерия кетонов
Для кетонов с числом атомов углерода больше 4-х характерна изомерия положения функциональной группы:
Кетоны изомерны альдегидам с таким же числом атомов углерода, а также енолам – соединениям, содержащим одновременно двойную связь и гидроксильную группу:
Енолы (непредельные спирты), у которых двойная связь и гидроксильная группа находятся при одном атоме углерода, неустойчивы и перегруппировываются в кетоны или альдегиды.
Такая перегруппировка происходит при гидратации алкинов: