какие таблетки назначают при сахарном диабете 2 типа
Новые международные правила лечения диабета 2 типа
Оксана Жосан, гинеколог-онколог. Редактор А. Герасимова
Каждые три года Американская ассоциация диабета (ADA) и Европейская ассоциация по изучению диабета (EASD) публикуют совместно разработанные рекомендации по гликемическому контролю у пациентов с диабетом типа 2. В издании 2018 года произошли серьезные изменения, включая правило выбора второго перорального средства в зависимости от наличия или отсутствия макро- или микрососудистых осложнений.
У пациентов с этими состояниями помимо основного орального препарата следует предпочитать ингибиторы SGLT-2, тогда как у пациентов без сосудистых осложнений могут быть использованы другие оральные препараты. Также была признана важной детерминантой выбора лечения стоимость терапии.
Что изменилось в направлении лечения диабета 2 типа
В 2018 году была опубликована новая совместная позиция авторитетных обществ. В области фармакотерапии диабета 2 типа можно отметить четыре основных изменения:
» data-medium-file=»https://unclinic.ru/wp-content/uploads/2019/11/protivodiabeticheskij-preparat.jpg» data-large-file=»https://unclinic.ru/wp-content/uploads/2019/11/protivodiabeticheskij-preparat-900×600.jpg» loading=»lazy» src=»https://unclinic.ru/wp-content/uploads/2019/11/protivodiabeticheskij-preparat.jpg» alt=»Противодиабетический препарат» width=»900″ height=»600″ srcset=»https://unclinic.ru/wp-content/uploads/2019/11/protivodiabeticheskij-preparat.jpg 900w, https://unclinic.ru/wp-content/uploads/2019/11/protivodiabeticheskij-preparat-768×512.jpg 768w» sizes=»(max-width: 900px) 100vw, 900px» title=»Новые международные правила лечения диабета 2 типа»> Противодиабетический препарат
Новое положение ADA и EASD не изменило отношение к метформину в качестве лекарственного средства первого выбора при лечении диабета типа 2. Введение выбора последующих — после метформина — противодиабетических препаратов должно производиться в зависимости от наличия и рисков развития сердечно-сосудистых, цереброваскулярных заболеваний и заболеваний периферических артерий. Эти новшества были вызваны динамичным развитием диабетической фармакотерапии в последние 10 лет, и прежде всего новыми данными о влиянии современных антидиабетических препаратов на риск развития сердечно-сосудистых патологий.
Что показали исследования
В 2005–2007 гг. для лечения диабета были введены первые препараты инкретина, то есть аналоги GLP-1 и ингибиторы DPP-4, а в 2012 г. в Европе появился первый ингибитор SGLT-2 — дапаглифлозин. С 2013 года, в соответствии с рекомендацией Американского агентства по лекарствам и продуктам питания (FDA), проводились исследования сердечно-сосудистых исходов (CVOT).
Первые публикации в этой серии исследований были посвящены ингибиторам DPP-4 (глиптин) и показали нейтральное влияние этой группы препаратов на сердечно-сосудистый риск. Только саксаглиптин дал небольшое увеличение риска госпитализации по поводу сердечной недостаточности.
Ученые не обнаружили никаких тревожных эффектов в следствии приема ситаглиптина и линаглиптина, поэтому эти лекарства в настоящее время считаются полностью безопасными с точки зрения кардиологии.
Их преимуществом также является низкий риск гипогликемии и увеличения веса, что означает, что в последнее десятилетие в большинстве европейских стран они все чаще значатся вторым препаратом, добавляемым к метформину, заменяя в этой роли сульфонилмочевины.
Эмпаглифлозин — ингибитор SGLT-2
Ключевое влияние при составлении новых рекомендаций оказали результаты исследования EMPA-REG OUTCOME, начатого в конце 2015 года, которое показало, что применение эмпаглифлозина, ингибитора SGLT-2, у пациентов после сердечно-сосудистого приступа приводит к статистически значимому (на 14%) снижению комбинированного риска смертей, связанных с сердечно-сосудистой патологией, нефатальных инфарктов и инсультов.
» data-medium-file=»https://unclinic.ru/wp-content/uploads/2019/11/serdechno-sosudistyj-pristup.jpg» data-large-file=»https://unclinic.ru/wp-content/uploads/2019/11/serdechno-sosudistyj-pristup-900×600.jpg» loading=»lazy» src=»https://unclinic.ru/wp-content/uploads/2019/11/serdechno-sosudistyj-pristup.jpg» alt=»Сердечно-сосудистый приступ» width=»900″ height=»600″ srcset=»https://unclinic.ru/wp-content/uploads/2019/11/serdechno-sosudistyj-pristup.jpg 900w, https://unclinic.ru/wp-content/uploads/2019/11/serdechno-sosudistyj-pristup-768×512.jpg 768w» sizes=»(max-width: 900px) 100vw, 900px» title=»Новые международные правила лечения диабета 2 типа»> Сердечно-сосудистый приступ
С тех пор интерес к этой группе препаратов, которые снижают гликемию за счет ингибирования реабсорбции глюкозы в почках, а также оказывает ряд других метаболических, гемодинамических и гормональных активностей в организме, неизмеримо возрос.
Канаглифлозин
Другим препаратом из этой группы, также снижающим риск смерти, сердечных приступов и нефатальных инсультов (все исследования, проводимые в соответствии с рекомендацией FDA, имеют такую общую конечную точку), был канаглифлозин.
Прием этого препарата пациентами с умеренной почечной недостаточностью, которые участвовали в исследовании CREDENCE (результаты опубликованы в апреле 2019 года), был связан не только с ингибированием хронического заболевания почек, но также с уменьшением смертей по причине сердечно-сосудистого приступа.
Лираглутид — агонист рецептора GLP-1
В середине 2016 года было обнаружено, что лираглутид, агонист рецептора GLP-1, вводимый один раз в день подкожной инъекцией, также оказывает положительное влияние на сердечно-сосудистый риск. Относительное снижение риска смерти от кардиологических причин было ниже, чем в случае эмпаглифлозина, и было зарегистрировано по крайней мере после одного года лечения, но было статистически значимым.
Последующие исследования подтвердили общее благоприятное влияние на сердечно-сосудистый риск других препаратов в этой группе – семаглутида, экзенатида LAR и альбиглютида (применяемых один раз в неделю, хотя в настоящее время альбиглутид недоступен), хотя между этими препаратами были некоторые различия.
Можно ли доверять результатам международных исследований?
Для понимания текущей формы рекомендаций ADA и EASD важно состояние здоровья пациентов, участвующих в исследованиях, оценивающих сердечно-сосудистый риск. Согласно рекомендациям FDA, для испытаний препаратов отбирались диабетики с высоким риском сердечно-сосудистых заболеваний. Например, в исследовании EMPAREG-OUTCOME, половина пациентов на момент начала исследования была в состоянии после сердечного приступа и четверть после инсульта.
По этой причине в настоящее время считается, что результаты исследований CVOT применимы во вторичной профилактике сердечно-сосудистых заболеваний (то есть они относятся к людям с развитыми сердечно-сосудистыми заболеваниями), и еще предстоит определить, имеют ли они сходное значение для первичной профилактики, то есть для пациентов без сердечно-сосудистых приступов, например, с недавно диагностированным диабетом.
Ингибиторы SGLT-2 и агонисты рецептора GLP-1 эффективно подавляют прогрессирование хронического заболевания почек
Стоит также подчеркнуть, что ингибиторы SGLT-2 и агонисты рецептора GLP-1 вошли в группу лекарственных средств, которые эффективно ингибируют прогрессирование хронического заболевания почек. Этот эффект был продемонстрирован как для эмпаглифлозина, канаглифлозина и дапаглифлозина, так и для лираглутида и семаглутида.
Правила выбора второго препарата при диабете 2 типа
Более конкретно, после запуска метформина решение о выборе следующего препарата, связанного с метформином, должно основываться на следующих соображениях (рис. 1).
Рисунок 1. Схема выбора второго препарата, добавляемого к метформину, если одним метформином не достигнуто значение HbA1c
Схема выбора второго препарата
Схема выбора второго препарата
Для диабетиков без сердечно-сосудистых заболеваний или хронических заболеваний почек доступен более широкий ассортимент лекарств. В этом случае следует учитывать следующие элементы клинических характеристик пациента:
В таблице 1 представлены пероральные противодиабетические препараты, доступные в настоящее время в Европе и США. Схема выбора второго препарата, который будет добавлен к метформину в соответствии с текущими рекомендациями ADA и EASD, показана на рисунке 1.
Другие препараты также добавляются согласно этой схеме, в соответствии с приоритетами лечения в клинической ситуации пациента.
Таблица 1. Пероральные противодиабетические препараты
| Класс | Препарат в данном классе | Основной механизм действия | Преимущества | Ограничения, побочные эффекты | Эффект |
| Бигуаниды | Метформин * | Общее снижение инсулинорезистентности (среди прочего, снижение выработки глюкозы в печени, усиление усвоения глюкозы в мышцах) | Многолетний клинический опыт; не вызывает гипогликемию; низкая стоимость использования | Дискомфорт в животе; многолетнее использование может вызвать дефицит витамина B12 (редко); не использовать с рСКФ | Высокий |
| Ингибиторы SGLT-2 | Дапаглифлозин * эмпаглифлозин * эртуглифлозин канаглифлозин * | Блокирование обратного захвата глюкозы и натрия в почках, что приводит к глюкозурии | Не вызывают гипогликемию; приводят к снижению массы тела и артериального давления; эффективны на всех стадиях диабета при сохранении функции почек; доказано положительное влияние на сердечно-сосудистый риск, сердечную недостаточность и прогрессирование хронического заболевания почек (различия между препаратами обсуждаются в тексте) | Грибковые инфекции половых органов; приводит к полиурии; кратковременное повышение креатинина; повышенный риск эугликемического кетоацидоза (особенно у пациентов, получающих инсулин); некроз мягких тканей промежности (Fournier) – очень редко; высокая стоимость лечения | Высокий |
| Ингибиторы DPP-4 | Линаглиптин * Саксаглиптин * Ситаглиптин * Вильдаглиптин | Ингибирование расщепления нативного GLP-1, которое приводит к зависимому от глюкозы увеличению секреции инсулина и ингибированию секреции глюкагона | Не вызывают гипогликемию; нейтрально влияют на массу тела; очень хорошая переносимость | Эффективность зависит от сохранности функции β-клеток; при почечной недостаточности, необходимо снижение дозы (кроме линаглиптина); высокая стоимость лечения | Средний |
| Производные сульфонилмочевины | Гликлазид Гликвидон Глимепирид, Glipizide | Повышенная секреция инсулина | Десятилетия клинического опыта | Значительный риск гипогликемии (различен для разных препаратов, самый низкий для гликлазида); риск увеличения веса; со временем снижается клиническая эффективность | Высокий |
| Thiazolidinediones | Пиоглитазон * | Повышает чувствительность к инсулину | Не вызывает гипогликемию; Длительная клиническая эффективность; приводит к увеличению холестерина ЛПВП и снижению триглицеридемии; снижает риск сердечно-сосудистых заболеваний при вторичной профилактике | Увеличение веса; задержка жидкости, ведущая к ухудшению сердечной недостаточности; декальцинация костей, приводящая к повышенному риску переломов длинных костей; риск возникновения или усиления отека желтого пятна; неясная безопасность с точки зрения риска рака мочевого пузыря; умеренно высокая стоимость терапии | Высокий |
| Ингибиторы Α-глюкозидазы | Акарбоза * | Ингибирование распада полисахаридов в кишечнике | Не вызывает гипогликемию; снижение постпрандиальной глюкозы; не всасывается | Общие желудочно-кишечные побочные эффекты (вздутие живота, ветер, диарея); требует 3-х разового ежедневного приема; снижение клинической эффективности с течением времени | Низкий |
| * препараты, изученные в рандомизированных проспективных исследованиях, оценивающих безопасность сердечно-сосудистой системы | |||||
Лечение диабета 2 типа на поздних этапах
На более позднем этапе, если применение двух или трех пероральных препаратов перестает быть эффективным, авторы последней позиции ADA и EASD рекомендуют начать применение инъекционной терапии. Сначала назначается агонист рецептора GLP-1, а затем базальный инсулин.
Следующим шагом должно быть добавление инсулина короткого действия, вводимого перед самым большим приемом пищи, а затем перед другими приемами пищи. Также можно сочетать пероральные препараты с инсулином.
Выводы
Многие страны взяли за основу в лечении диабета позицию ADA и EASD, которые по прежнему рекомендует использовать метформин как препарат первого выбора при начале фармакологического лечения диабета типа 2, если он не противопоказан и хорошо переносится.
Выбор последующих препаратов должен быть индивидуальным и учитывать их эффективность, побочные эффекты, влияние на массу тела, риск развития гипогликемии, цену и предпочтения пациента. Однако наиболее важным фактором, влияющим на выбор препарата, должен быть факт наличия осложнений макро- и / или микроангиопатической природы.
Таким образом, у пациентов с сердечно-сосудистыми заболеваниями, особенно после сердечного приступа, в первую очередь следует рассмотреть применение препаратов, которые доказали положительное влияние на сердечно-сосудистый риск, т.е. ингибиторы SGLT-2 и агонисты рецептора GLP-1.
Аналогичным образом, у пациентов с хроническим заболеванием почек вследствие продемонстрированного нефропротективного эффекта предпочтение следует отдавать выбору препаратов обеих групп, прежде всего флозинов, если нет противопоказаний к их применению.
Современные сахароснижающие средства в лечении сахарного диабета 2 типа
*Пятилетний импакт фактор РИНЦ за 2020 г.
Читайте в новом номере
Эндокринологический научный центр РАМН, Москва
Эндокринологический научный центр РАМН, Москва
К оличество больных сахарным диабетом 2 типа (СД2) неуклонно возрастает. По данным Diabetes Atlas 2000, в мире зарегистрирован 151 миллион больных СД2. В то же время эксперты говорят о том, что количество невыявленного сахарного диабета (СД) может превышать регистрируемый сегодня уровень в 2–3 раза. Поэтому рациональная фармакотерапия этого заболевания является предметом многочисленных научных и клинических исследований. Одним из самых крупных исследований последнего времени явилось Британское проспективное исследование по контролю сахарного диабета и развитию осложнений (UKPDS). Оно продолжалось около 20 лет, в нем участвовало более 5000 больных СД2. Больные были разделены на группы, получавшие с момента выявления СД разные виды лечения: только диету, различные пероральные сахароснижающие препараты, инсулинотерапию.
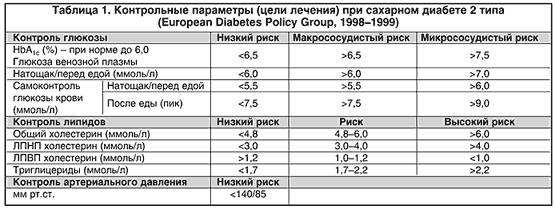
Исследование показало возможность уменьшения частоты осложнений заболевания при интенсивной тактике лечения. Было продемонстрировано, что снижение уровня гликированного гемоглобина HbA1c на 1% (в результате интенсивного лечения СД с применением различных методов в течение 10 лет) снижает частоту осложнений СД в целом на 21%, микрососудистые осложнения на 35%, инфаркт миокарда на 18%, инсульт на 15%, смертность по диабету на 25%, общую смертность на 17%. С учетом большой опасности хронической (и часто не осознаваемой пациентами и даже врачами) декомпенсации СД в плане развития сосудистых осложнений, в последние годы разработаны более жесткие критерии компенсации (точнее сказать, цели лечения) СД2 (табл. 1) и пересмотрены некоторые терапевтические подходы к данной группе больных. Последний пересмотр этих критериев был проведен в 1998–99 гг. после изучения результатов исследования UKPDS.
Дополнительная цель: прекращение курения или уменьшение, насколько это возможно.
Одной из целей лечения сахарного диабета следует считать и снижение веса при его избытке.
Основными принципами лечения СД2 в настоящее время являются:
Эффективное лечение СД2 невозможно без соблюдения диеты, вне зависимости от того, получает больной дополнительно какие–либо сахароснижающие средства (в том числе инсулин) или нет. Питание больного СД2 должно отвечать ряду требований:
1. Оптимизация массы тела (для 80–90% больных с избытком массы – ее снижение).
2. Предотвращение постпрандиальной (после еды) гипергликемии.
3. Профилактика или лечение факторов риска сердечно–сосудистых заболеваний (дислипидемии, артериальной гипертонии).
4. Соблюдение всех принципов здорового питания, включая правильные соотношения всех необходимых нутриентов, достаточное количество витаминов, минеральных веществ и т.д.
Основную причину нарушения углеводного обмена при СД2 составляет избыточная масса тела. Многочисленными исследованиями уже давно доказано, что у большинства больных снижение массы тела позволяет достичь устойчивой компенсации углеводного обмена, уменьшить инсулинорезистентность, а также получить положительный эффект в отношении часто сопутствующих артериальной гипертонии и дислипидемии. Достигнуть снижения веса можно только путем ограничения калорийности рациона. Физическая нагрузка при СД2 играет, как правило, вспомогательную роль и особенно важна для длительного поддержания полученного эффекта.
Следует помнить, что не имеет смысла рекомендовать больному точный подсчет калоража. Во–первых, это практически невозможно. Человек питается смешанной пищей, а таблицы калорийности содержат информацию лишь о продуктах в чистом виде, что ведет к грубым ошибкам при попытках подсчета калорийности реального питания. Во–вторых, взвешивание каждого куска, постоянная сверка с таблицами калорийности, лишают процесс питания гедонической (доставляющей удовольствие) ценности. Собственно говоря, важно не столько само по себе рекомендуемое количество калорий, сколько реальное сокращение калорийности по сравнению с предшествующим питанием, которое и привело к избытку веса. Информация о низкокалорийной диете для больного должна быть простой, ясной и применимой в его повседневной жизни. Исходя из калорийности компонентов пищи (вода – 0 ккал, 1 г белка – 4 ккал, 1 г углеводов – 4 ккал, 1 г жира – 9 ккал, 1 г алкоголя – 7 ккал), основные принципы низкокалорийной диеты сводятся к следующему: во–первых, необходимо исключить или резко ограничить высококалорийные продукты – богатые жирами, алкоголь, сахар и сладости; во–вторых, употреблять в меньшем по сравнению с прежним (т.е. привычным для данного больного) количестве продукты средней калорийности – белки и крахмалы; в–третьих, свободно, без всяких ограничений, употреблять (замещая уменьшившийся за счет перечисленных ограничений объем питания) низкокалорийные продукты – овощи, зелень, некалорийные напитки.
Большинству больных СД2 следует рекомендовать дробное питание (5–6 раз в день малыми порциями). Оно позволяет избежать сильного чувства голода при уменьшении привычного объема питания, а также препятствует как постпрандиальной гипергликемии (порция углеводов в каждом приеме пищи должна быть невелика), так и гипогликемиям у больных на медикаментозной сахароснижающей терапии (частый прием небольших количеств углеводов).
Предотвращение постпрандиальной гипергликемии является вторым принципом диеты для больного СД2. Часто ему придают первостепенное значение, забывая, что патогенетически более важной является нормализация массы тела. Кроме дробного режима питания, снизить постпрандиальную гликемию помогают следующие меры: исключение из диеты легкоусвояемых углеводов в чистом виде (сахара, меда, сладких напитков, фруктовых соков), увеличение количества растительных волокон в пище, минимальная кулинарная обработка.
Диетические рекомендации для больных с нормальной массой тела сводятся, в конечном итоге, только к устранению высокой постпрандиальной гликемии. Сокращения калорийности рациона им, разумеется, не требуется.
Физические упражнения рассматриваются как важный метод в структуре комплексной терапии СД2. Кроме ускорения снижения веса, физическая активность сама по себе улучшает чувствительность к инсулину и, как следствие этого – показатели состояния углеводного обмена, а также нормализует липидемию. Считается, что наиболее приемлемой и безопасной (в связи с наличием сопутствующих заболеваний) тактикой физических упражнений являются занятия с начальной продолжительностью 5 – 10 минут и постепенным увеличением времени до 30–40 минут по крайней мере 2–3 раза в неделю. Если больной получает сахароснижающие препараты, на первый план должна выдвигаться осторожность в связи с возможной гипогликемией.
Пероральные сахароснижающие препараты
Подбор адекватной сахароснижающей терапии и достижение желаемой степени компенсации заболевания у больных СД2 представляют определенные сложности. Это обусловлено значительной гетерогенностью СД2, которая затрудняет поиск патогенетического лечения в каждом конкретном случае.
Назначение пероральных сахароснижающих препаратов (ПССП) при впервые выявленном СД2 рекомендуется, если правильное соблюдение диеты в сочетании с физическими нагрузками не приводит к компенсации углеводного обмена. К сожалению, зачастую приходится назначать ПССП при сохраняющейся декомпенсации СД на фоне явного несоблюдения диеты. Альтернативой здесь могло бы быть направление в «Школу диабета» для группового обучения с целью изменения отношения к питанию или привлечение психолога к процессу изменения поведения пациента.
На сегодняшний день в клинической практике применяются ПССП следующих классов:
1. Производные сульфонилмочевины
4. Прандиальные регуляторы гликемии
6. Комбинированные препараты.
Механизмы действия этих классов препаратов различны, но в целом направлены на устранение трех основных метаболических нарушений, приводящих к гипергликемии: нарушение секреции инсулина поджелудочной железой, периферическая инсулинорезистентность, избыточная продукция глюкозы печенью. Дополнительный механизм действия – замедление всасывания глюкозы в тонком кишечнике и за счет этого уменьшение постпрандиального подъема гликемии.
ПСМ делятся на препараты первой и второй генерации. Основное отличие препаратов второй генерации от первой заключается в их большей активности. Так, препараты второго поколения оказывают в 50–100 раз более выраженный сахароснижающий эффект по сравнению с таковыми первой генерации, в связи с чем применяются в значительно меньших дозах. Соответственно, риск побочных эффектов у препаратов второй генерации ниже, чем у первой. В настоящее время в клинической практике (во всяком случае в России) применяются только ПСМ второй генерации. Все ПСМ имеют в целом сходную структуру, и их фармакологический эффект опосредуется через единый механизм. Но некоторые различия в химической структуре приводят к тому, что каждый из них имеет свои особенности действия, которые позволяют оптимально использовать их в тех или других ситуациях.
Назначают ПСМ с минимальных доз, постепенно (с интервалом в 1–2 недели) оценивая эффект и увеличивая дозу по мере необходимости. В каждом конкретном случае дозу препарата следует подбирать индивидуально, помня о высоком риске гипогликемичеких состояний у лиц старческого возраста.
Биодоступность немикронизированной формы составляет до 70%, а концентрация в крови достигает максимума через 4–6 ч после приема препарата внутрь. Период полувыведения составляет от 10 до 12 ч, сахароснижающий эффект сохраняется до 24 ч. Выводится из организма на 50% почками и на 50% с желчью. Суточная доза может варьировать от 2,5 до 20 мг (обычно составляя 10–15 мг) и назначается обычно в 1–2 приема. Часто применяемое в обычной практике назначение в 3 приема не является обоснованным в отношении увеличения его эффективности. Обычно соотношение утренней и вечерней дозы составляет 1:1 или 2:1. Препарат принимается за 30 мин до еды.
Появившиеся в последние годы микронизированные формы (1,75 и 3,5) характеризуются почти полной биодоступностью, особенными фармакокинетикой, фармакодинамикой и большей эффективностью при употреблении в меньшей разовой и суточной дозе. Микронизированная форма глибенкламида обеспечивает полное высвобождение действующего вещества в течение 5 мин после растворения и быстрое всасывание, в связи с чем может быть сокращен интервал между приемом препарата и пищи. Максимальная концентрация микронизированного глибенкламида также наступает раньше, т.е. лучше совпадает с пиком постпрандиальной гликемии. Длительность сахароснижающего эффекта микронизированных форм – до 24 ч, а в связи с полной биодоступностью препарата потребность в глибенкламиде оказывается ниже на 30–40%, что в итоге обеспечивает адекватную секрецию инсулина в течение суток и снижает риск гипогликемических состояний. Максимальная доза микронизированного глибенкламида составляет 14 мг/сут.
Глипизид в настоящее время представлен двумя основными формами: традиционной и новой – ГИТС (гастроинтестинальная терапевтическая система).
Начальная доза препарата – 2,5 – 5 мг, максимальная суточная – 20 мг. Время действия традиционной формы препарата составляет 12–24 ч, поэтому он назначается в основном 2 раза в день перед приемами пищи. Новая форма глипизида ГИТС выпускается под названием ретард. Отличие ее от традиционной формы глипизида заключается в наличии осмотически активного ядра препарата, который окружен полупроницаемой для воды мембраной. Ядро разделено на два слоя: «активный», содержащий препарат, и слой, содержащий инертные компоненты, однако обладающие осмолярной активностью. Вода из кишечного тракта поступает в таблетку, увеличивая давление в осмотическом слое, которое «выдавливает» активную часть препарата из центральной зоны. Это ведет к выходу препарата через мельчайшие, образованные лазером отверстия в наружной мембране таблетки. Таким образом, поступление препарата из таблетки в желудочно–кишечный тракт осуществляется постоянно и постепенно, до тех пор, пока не изменяется осмотический градиент. После приема препарата пролонгированного действия концентрация его в плазме повышается постепенно, достигая максимума через 6–12 ч. Терапевтическая концентрация в крови поддерживается в течение 24 часов, что позволяет принимать препарат 1 раз в сутки. Это более удобно и повышает приверженность больного лечению. ГИТС– форма достаточно безопасна в плане гипогликемических реакций. Это качество препарата особенно ценно для пациентов старше 65 лет – риск развития гипогликемий у которых выше.
Гликлазид (Диабетон), помимо сахароснижающего эффекта (более мягкого, чем у глибенкламида), оказывает положительное влияние на микроциркуляцию, систему гемостаза, некоторые гематологические показатели и реологические свойства крови, что является крайне актуальным для больных СД. Также считается, что гликлазид наиболее хорошо стимулирует раннюю фазу секреции инсулина, которая нарушена при СД2. Период полувыведения составляет 12 ч, поэтому чаще всего применяется в 2 приема. Метаболизируется в печени, большая часть выводится почками. Начальная суточная доза – 40–80 мг, максимальная – 320 мг. Совсем недавно появилась новая форма гликлазида с модифицированным высвобождением – Диабетон МВ. Почти 100% биодоступность позволила снизить дозу гликлазида при использовании такой формы до 30–120 мг в сутки. Длительность действия составляет 24 ч, поэтому препарат принимается 1 раз в сутки перед завтраком, чтобы профиль действия соответствовал нормальному суточному ритму выделения инсулина. Такой режим применения, а также действие гликлазида преимущественно на первую фазу секреции инсулина обеспечивают меньший риск гиперинсулинемии. Результатом такого, более мягкого, действия является низкая частота гипогликемий, отсутствие прибавки веса и относительно более позднее развитие вторичной резистентности к препарату.
Гликвидон является единственным сахароснижающим препаратом, назначение которого возможно у лиц с заболеваниями почек: 95% полученной дозы препарата выводится через желудочно–кишечный тракт и лишь 5% – через почки. В связи с тем, что другие сахароснижающие препараты выводятся в значительной мере через почки, при диабетической нефропатии или сопутствующем поражении почек высок риск их кумуляции с развитием тяжелых гипогликемий. Начальная доза 30 мг, при отсутствии эффекта ее постепенно увеличивают (при необходимости до 120–180 мг). Также следует отметить, что по сравнению с другими препаратами гликвидон является более короткодействующим, поэтому кратность приема может быть увеличена до 3 раз в день.
Всегда необходимо помнить о риске гипогликемических реакций при использовании ПСМ и предупреждать больных о необходимости ношения с собой легкоусвояемых углеводов. Гипогликемия является, скорее, не побочным, а прямым эффектом ПСМ, но свидетельствует о неправильном подборе дозы или нарушении режима питания. Особенностью гипогликемий, вызванных ПСМ (в отличие от большинства «инсулиновых» гипогликемий), является их пролонгированность в связи с длительным периодом полувыведения этих препаратов, особенно в пожилом возрасте. Поэтому после успешного выведения из состояния гипогликемии, она, тем не менее, может рецидивировать в течение 12–72 часов.
Побочные эффекты при применении ПСМ чаще всего нетяжелые. Как правило, они появляются в первые 2 месяца от начала терапии и проявляются диспептическими расстройствами в виде тошноты, иногда рвоты, болей в эпигастрии, ощущением металлического вкуса во рту. Значительно реже встречаются более тяжелые побочные эффекты, которые требуют снижения дозы или полной отмены препаратов. Это кожные аллергические реакции, лейко– и тромбоцитопения, агранулоцитоз, гемолитическая анемия, токсическое поражение печени и почек. К побочным эффектам ПСМ следует относить и увеличение веса, однако этот эффект можно минимизировать или предотвратить правильным соблюдением диеты.
Препараты этой группы не изменяют секрецию инсулина, однако в присутствии последнего увеличивают периферическую утилизацию глюкозы тканями. Второй важный механизм действия бигуанидов – снижение глюконеогенеза и уменьшение продукции глюкозы печенью. Также считается, что они могут уменьшать всасывание углеводов в кишечнике. Влияние бигуанидов на уровень сахара в крови можно оценить, скорее, как антигипергликемическое, нежели как сахароснижающее.
Наиболее опасным побочным эффектом бигуанидов является развитие лактацидоза, в связи с этим долгое время отношение к этой группе было очень негативным, но в 90–е годы один из представителей группы бигуанидов – метформин – был реабилитирован. Было доказано, что он обладает минимальным риском развития лактацидоза.
Mетформин относительно быстро всасывается из желудочно–кишечного тракта. При суточной дозе 0,5–1,5 г биодоступность составляет 50–60%. Максимальное насыщение препаратом обычно достигается при дозе 3 г. В связи с этим назначение более высоких доз метформина считается нецелесообразным, так как не способствует дальнейшему усилению антигипергликемического эффекта. Полное выведение препарата обычно происходит в течение 8–20 ч. Начальная суточная доза метформина не должна превышать 500 мг. Препарат принимается вместе с пищей. При необходимости через неделю от начала терапии (при условии отсутствия побочных эффектов) доза препарата может быть увеличена до 500 мг дважды в сутки и далее. Оптимальная суточная доза метформина составляет 1500–1700 мг (500 мг трижды или 850 мг дважды в день). Максимальный эффект при лечении метформином наступает через несколько недель – его не следует ожидать слишком рано. При монотерапии снижение HbA1c составляет 0,9–1,5%.
Помимо перечисленного действия метформина на углеводный обмен, следует подчеркнуть его положительное влияние на метаболизм липидов, что не менее важно при СД2: снижение общего холестерина на 10%, триглицеридов на 20–30%. Метформин – практически единственный сахароснижающий препарат, лечение которым может приводить не к повышению, а даже к снижению массы тела пациентов (в среднем – на 1,5 кг в год). По данным исследования UKPDS, если повышение веса со временем все же происходит, то оно минимально по сравнению с другими препаратами. Поэтому показанием к применению метформина является невозможность достижения компенсации заболевания у лиц с СД2 (в первую очередь с ожирением) на фоне диетотерапии только или в сочетании с применением ПСМ.
Среди побочных действий метформина следует отметить диарею и другие диспепсические явления (металлический вкус во рту, тошнота, анорексия), которые в начале терапии наблюдаются почти у 20% больных, а затем самостоятельно проходят через несколько дней. Риск побочных эффектов можно свести к минимуму медленным титрованием дозы, приемом препарата во время еды и снижением доз при их возникновении. При длительном приеме метформина в больших дозах следует помнить о возможности снижения всасывания в желудочно–кишечном тракте витаминов В12 и фолиевой кислоты, что в исключительных случаях может привести к развитию мегалобластной анемии.
Риск развития лактацидоза при применении метформина минимален по сравнению с остальными бигуанидами и не превышает 8,4 случая на 100 000 больных в год. Тем более, что при развитии лактацидоза речь, как правило, идет не о метформин–индуцированном, а метформин–ассоциированном ацидозе. Лактацидоз той или иной степени тяжести может развиваться и без приема медикаментов – на фоне сердечной, почечной и печеночной недостаточности, а также при употреблении алкоголя. Однако следует иметь в виду даже столь незначительную опасность развития лактацидоза и контролировать содержание лактата (оптимально – около двух раз в год), регулярно оценивать скорость клубочковой фильтрации (развитие почечной недостаточности любого происхождения приведет к кумуляции метформина). При появлении жалоб на мышечные боли следует немедленно исследовать уровень лактата, а при возрастании содержания в крови лактата или креатинина, лечение метформином следует прекратить. К положительным аспектам действия метформина относится то, что сам по себе он практически не способен вызвать гипогликемию.
Противопоказаниями к назначению метформина являются гипоксические состояния любой природы, нарушение функции печени и почек, сердечная недостаточность, склонность к злоупотреблению алкоголем и указание на наличие лактацидоза в анамнезе. Прием метформина должен быть приостановлен за 1–2 дня до проведения любого контрастного исследования в связи с опасностью развития почечной недостаточности после внутривенного введения контраста.
Метформин может применяться как в виде монотерапии с диетой у лиц с СД2 и ожирением, так и в сочетании с ПСМ или инсулином. Указанная комбинированная терапия назначается в том случае, если желаемый терапевтический эффект на фоне монотерапии не достигается.
Побочные эффекты акарбозы не опасны, но могут быть очень неприятны для больных. В толстый кишечник поступает значительно большее, чем обычно количество углеводов, которые перерабатываются бактериальной флорой с повышенным газообразованием. У пациентов возникает метеоризм и диарея. Пациент должен быть информирован о том, что возникновению побочных эффектов способствует в основном отклонение от рекомендованной диеты: употребление большого количества углеводов, как медленно, так и быстроусвояемых. Поэтому у некоторых больных побочные эффекты акарбозы являются дополнительным фактором, требующим соблюдения диеты.
Начальная доза акарбозы составляет 50 мг трижды в день перед едой или непосредственно в самом начале приема пищи. В случае хорошей переносимости препарата и отсутствия побочных эффектов дозу препарата можно увеличивать до 300–600 мг/сут.
Противопоказанием для назначения акарбозы являются такие заболевания желудочно–кишечного тракта, как грыжи различной локализации, язвенный колит, а также хронические заболевания кишечника, протекающие с выраженными нарушениями пищеварения и всасывания, острые и хронические гепатиты, панкреатиты, колиты.
Гипогликемии на фоне терапии акарбозой не развиваются. Однако следует учесть, что если гипогликемия развилась по другим причинам (передозировка ПСМ, в комбинации с которыми применялся препарат), акарбоза замедляет всасывание перорально принимаемых для ее коррекции углеводов. Пациентов необходимо информировать, что в этой ситуации они должны принимать препараты или продукты, содержащие глюкозу: виноградный сок, таблетированную глюкозу. Обычный сахар оказывается неэффективным.
Прандиальные регуляторы гликемии (меглитиниды)
Дозировка – от 0,5 до 4 мг перед основными приемами пищи (обычно 2–4 раза в день). Таким образом, препарат позволяет больному более гибко подходить к вопросу соблюдения режима питания. В случае пропуска приема пищи (например, обеда) прием препарата также пропускается. Это очень важно для относительно молодых пациентов с активным образом жизни, т.к. при лечении ПСМ в этом случае возникал бы риск гипогликемии. Максимальная доза составляет 16 мг в сутки.
Наилучшие результаты репаглинид показывает у больных с небольшим стажем СД2, т.е. у больных с сохраненной секрецией инсулина. Если на фоне использования препарата происходит улучшение постпрандиальной гликемии, а гликемии натощак остается повышенной, его можно успешно комбинировать с метформином или пролонгированным инсулином перед сном.
Натеглинид является еще одним представителем прандиальных регуляторов гликемии. Он представляет собой производное аминокислоты D–фенилаланина. Механизм действия и все основные фармакокинетические и фармакодинамические свойства схожи с репаглинидом. Можно отметить, что натеглинид практически не требует подбора дозы. Стандартная разовая доза – 120 мг перед каждым основным приемом пищи.
Препараты тиазолидиндионового ряда (пиоглитазон, розиглитазон) вошли в клиническую практику только в последние годы. Подобно бигуанидам, эти препараты не стимулируют секрецию инсулина, но повышают чувствительность к нему периферических тканей. Соединения этого класса выступают в роли агонистов ядерных PPAR- g рецепторов (peroxisome proliferator–activated receptor). PPAR- g рецепторы обнаруживаются в жировой, мышечной тканях и в печени. Активация PPAR- g рецепторов модулирует транскрипцию ряда генов, связанных с передачей эффектов инсулина на клетки и участвующих в контроле уровня глюкозы и метаболизме липидов. Помимо снижения уровня гликемии, улучшение чувствительности тканей к инсулину благоприятно влияет на липидный профиль (повышается уровень липопротеидов высокой плотности, снижается содержание триглицеридов). Учитывая, что эти препараты действуют, стимулируя транскрипцию генов, для получения максимального эффекта требуется до 2–3 мес. В клинических исследованиях эти препараты обеспечивали снижение уровня HbA1c при монотерапии примерно на 0,5–2%. Препараты данного класса могут применяться в сочетании с ПСМ, инсулином или метформином. Сочетание с метформином обосновано в связи с тем, что действие бигуанидов направлено в большей степени на подавление глюконеогенеза, а действие тиазолидиндионов – на повышение периферической утилизации глюкозы. Гипогликемии они практически не вызывают (но как и бигуаниды, способны повышать частоту гипогликемий в сочетании с секретогогами).
В настоящее время в России зарегистрирован препарат из группы тиазолидиндионов пиоглитазон. У препарата, который относится ко второму поколению тиазолидиндионов, не было обнаружено гепатотоксического действия (применение препарата «первого поколения» троглитазона было из–за этого запрещено). На фоне лечения рекомендуется контроль уровня аланин– и аспартаттрансферазы и прекращение приема препарата при уровне ферментов, вдвое превышающем норму. Пиоглитазон инактивируется в печени, выделяется преимущественно с желчью. Одним из побочных эффектов может быть появление отеков, а также прибавка веса. Препарат назначают один раз в сутки вне зависимости от приемов пищи. Суточная доза варьирует от 15 до 45 мг.
Традиционно лечение СД2 начинают с монотерапии метформином или ПСМ и только при выраженном ухудшении гликемического контроля добавляют второй препарат или инсулин. Такая тактика приводит к тому, что достаточно большая часть больных СД2 постоянно находится в состоянии неудовлетворительной компенсации, имея гликированный гемоглобин HbA1c на уровне не ниже 9%. В исследовании UKPDS также была отмечена ограниченная возможность монотерапии при длительном поддержании хорошего гликемического контроля. Через 3 года после установления диагноза только 50% были в состоянии достичь рекомендуемого уровня HbA1c при использовании монотерапии, а к 9 году эта цифра составила менее 25%. Логичным представляется интенсивное терапевтическое воздействие в возможно более ранние сроки одновременно на оба патогенетических звена, вызывающих гипергликемию для того, чтобы добиться постоянного уровня HbA1c менее 7%, рекомендуемого в качестве цели для профилактики осложнений.
Применение двух препаратов разных классов в средних дозах более оправдано не только патогенетически: такая терапия создает меньший риск тяжелых побочных эффектов, чем высокие дозы одного препарата. Но, с другой стороны, комбинированная терапия может приводить к снижению комплаентности больных в отношении лечения. В связи с этим встал вопрос о производстве готовых комбинаций. В настоящее время используются готовые комбинации ПСМ и метформина.
Число больных СД2, требующих лечения инсулином, неуклонно возрастает, уже давно превысив количество больных СД1. К сожалению, существует множество причин (скорее психологических, чем объективных), из–за которых инсулинотерапия при СД2 зачастую назначается слишком поздно и рассматривается, как «последняя возможность» в лечении СД. На самом деле, помня о гетерогенности СД2, можно сказать, что в ряде случаев инсулин должен назначаться очень рано, если не вообще с самого начала заболевани