какие таблетки снимают приступ астмы
Астма-школа

Контролируемая астма должна вести себя так, чтобы не напоминать о себеникакими симптомами как можно дольше. И опыт последних лет говорит о том, что этой высокой цели можно достичь у большинства пациентов. Только для этого необходимо всей семье поработать совместно (с лечащим врачом). А вот пассивное ожидание чудес (например, полного и окончательного исцеления или того, что ребенок «перерастет» свою болезнь) – не рекомендуется.
Итак, для сотрудничества нам понадобится общий язык и инструментысамоконтроля: дневник симптомов и пикфлоуметрии, регулярное заполнениеопросников АСТ и/или ACQ. Незнакомые слова? Обратитесь к статьям этого жераздела на нашем сайте или к своему лечащему врачу. А в рамках этоймаленькой статьи расскажу о двух группах противоастматичекихпрепаратов. Это – СРЕДСТВА БАЗИСНОЙ ТЕРАПИИ (1) и ПРЕПАРАТЫ СКОРОЙПОМОЩИ (2)*.
1. СРЕДСТВА БАЗИСНОЙ ТЕРАПИИ *
Врач назначает обычно сразу на длительный срок (месяцы!) с противовоспалительной целью, для ежедневного применения вне зависимостиот наличия/отсутствия проявлений астмы в данный момент, для профилактики, а не снятия бронхиальной обструкции. На эти лекарства и возлагаются главныенадежды по достижению контроля над астмой. Причем длительность ихприменения не ограничена, нет понятия «пройти курс лечения»: лекарственнаяподдержка может использоваться так долго, как будет в ней необходимость. Итак, к БАЗИСНЫМ относятся:
2. ПРЕПАРАТЫ СКОРОЙ ПОМОЩИ *
Как видите, универсального или идеального лекарства пока не обнаружено. Исследуются и внедряются в жизнь и новые группы средств. У каждогопрепарата, пусть даже отнесенного в одну группу, есть свои нюансыприменения, часто – свое устройство для ингаляции (дозированные аэрозольныеили порошковые ингаляторы, небулайзер), особенности действия, преимуществаи недостатки.
Рассказать обо всем сразу – просто нереально, да наверное и не нужно. Ведь мынаконец добрались до самого интересного. На чем же основан выборконкретного лекарства для конкретного пациента?
Клинические рекомендации по лечению астмы (международные – GINA, российские – Национальная программа) рекомендуют определенную ступеньтерапии в зависимости от того, достигнут ли контроль над астмой. Соответственно, на протяжении времени возможны и «шаги вниз» (то естьснижение доз, числа используемых препаратов) и «шаги вверх» по ступеням (тоесть наращивание терапии).
Необходимо учесть предыдущий индивидуальный опыт самого больного(переносимость, нежелательные явления, мнение об эффективности), правильность применения и удобство ингаляционного устройства, возможныевозрастные ограничения и ограничения по безопасности (у детей, у беременныхи кормящих мам), сопутствующие заболевания и их лечение медикаментами в данное время.
Желаю всем астматикам полного контроля!
* При написании названий препаратов даю первым международноенепатентованное наименование, а в скобках – коммерческие наименования.
Терапия обострений бронхиальной астмы
Бронхиальная астма (БА) — это гетерогенное заболевание, характеризующееся наличием хронического воспаления дыхательных путей и респираторных симптомов (сухие хрипы, одышка, стеснение в груди и кашель), интенсивность которых изменяется с течением времени, а также вариабельностью в отношении ограничения экспираторного потока.
Симптомы астмы могут купироваться как самостоятельно, так и с помощью медикаментов. Проявления БА зачастую усугубляются ночью или ранним утром, а также провоцируются вирусной инфекцией (простуда), физической нагрузкой, аллергенами, изменениями погоды, смехом, ирритантами (выхлопные газы автомобилей, дым и сильные запахи) и другими факторами.
Снижают вероятность диагноза изолированный кашель без других респираторных симптомов, хроническая продукция мокроты, одышка, сопровождающаяся головокружением, предобморочным состоянием или периферическими парестезиями (чувство покалывания, жжения в дистальных отделах конечностей), боль за грудиной, а также инспираторная одышка, обусловленная физической нагрузкой.
Фенотипы астмы
Как говорилось выше, бронхиальная астма — гетерогенное заболевание с различным течением процесса. Демографический кластер, клинические и/или патологические характеристики заболевания называются «фенотипом астмы». Наиболее часто встречаемые «фенотипы астмы»:
Аллергическая
Самый распространенный фенотип астмы. Часто выявляется в детстве, обычно характерно наличие обширного семейного и/или личного аллергологического анамнеза (экзема, аллергический ринит, пищевая или лекарственная аллергия и т. д.). При исследовании мокроты пациентов часто выявляется воспаление дыхательных путей с эозинофильной инфильтрацией. Пациенты с данным фенотипом хорошо отвечают на терапию ингаляционными глюкокортикостероидами (ИГКС).
Неаллергическая
Выделяется у взрослых пациентов при отсутствии аллергии в анамнезе. Клеточный профиль их мокроты может быть нейтрофильным, эозинофильным или содержать лишь незначительное количество воспалительных клеток. Пациенты данной группы зачастую хуже отвечают на терапию ИГКС.
Астма с поздним началом
Чаще выявляется у женщин, первые проявления возникают во взрослой жизни. В большинстве случаев это пациенты без аллергии, требующие высоких доз ИГКС или относительно невосприимчивые к лечению глюкокортикостероидами.
Астма с фиксированным ограничением экспираторного потока
У части пациентов с длительным течением астмы ограничения экспираторного потока становятся необратимыми из-за ремоделирования стенок дыхательных путей.
Астма с ожирением
В эту группу, собственно, входят пациенты с ожирением и респираторными проявлениями астмы, а также незначительной эозинофилией мокроты.
Перекрест бронхиальной астмы и ХОБЛ (ПБАХ)
Перекрест бронхиальной астмы и ХОБЛ (ПБАХ) характеризуется персистирующим ограничением экспираторного потока c проявлениями, всегда ассоциирующимися с астмой (молодой возраст, значительная вариабельность ограничения экспираторного потока, положительный тест с бронходилататором), а также c некоторыми проявлениями, всегда ассоциирующимися с ХОБЛ (возраст старше 40 лет, отсутствие вариабельности потока, снижение емкости легких, отсутствие ответа на бронходилататор).
У некоторых больных, особенно пожилых и курильщиков, сложно провести дифференциальный диагноз астмы и хронической обструктивной болезни легких. Прогноз у таких пациентов значительно хуже, чем у имеющих изолированную БА либо ХОБЛ, и информации о подборе оптимальной терапии для них пока недостаточно. Вот некоторые рекомендации по начальной терапии «сомнительных» пациентов:
Всем пациентам требуется изменение образа жизни (отказ от курения, умеренная физическая активность), а также лечение коморбидной патологии.
Наличие типичных респираторных симптомов бронхиальной астмы, а также характерного анамнеза, является показанием к выполнению спирометрии либо пикфлоуметрии (измерение пиковой скорости выдоха, ПСВ) с целью выявления ограничений экспираторного потока. При тяжелом состоянии пациента и низкой вероятности других диагнозов начинают проведение эмпирической терапии БА ингаляционными глюкокортикостероидами (ИГКС) и короткодействующими бета-2-агонистами (КДБА), и в дальнейшем после оценки состояния больного и эффекта от терапии проводят необходимые диагностические мероприятия для уточнения и подтверждения диагноза.
Проводится ряд тестов, позволяющих оценить степень и обратимость бронхиальной обструкции: оценка увеличения функции легких после введения бронходилататора или после проведенной терапии, снижения функции легких после физической нагрузки или при проведении провокационных тестов с гистамином или метахолином, выявление нарушений функции легких и вариаций потока в течение 1–2 недель при плановых посещениях либо самостоятельно.
Подтипы БА
«Трудно поддающаяся лечению» БА — термин, применяемый для обозначения случаев, когда невозможно достичь контроля БА несмотря на оптимально подобранную терапию. Зачастую это происходит при наличии у пациента отягчающих факторов, таких как наличие коморбидной патологии, низкая приверженность к лечению, присутствие в среде обитания человека неустранимых аллергенов.
Термины «резистентная» или «рефрактерная к лечению астма» применяются для пациентов, у которых течение, обострения и выраженность симптомов БА плохо контролируются, несмотря на высокие дозы ИГКС в сочетании с вторым препаратом контроля (длительно действующие бета-2-агонисты (ДДБА) и/или системные ГКС) и лечение сопутствующей патологии, либо для тех пациентов, у которых теряется контроль при снижении ступени терапии.
Понятие «тяжелая астма» объединяет пациентов с рефрактерной к терапии БА и нелеченной коморбидной патологией.
В рекомендациях GINA последних лет термин «астматический статус» не встречается, плановая и неотложная терапия БА проводится в зависимости от степени тяжести обострения, определяемой по клиническим и инструментальным данным.
Обострение астмы
Обострением БА считается любое выраженное ухудшение симптомов и/или функции легких (снижение ПСВ или ОФВ1) пациента по сравнению с его обычным статусом. Важно, чтобы пациент следил за своим состоянием и отмечал происходящие изменения. Существует необходимость в плане («asthma action plan») лечения и действий при БА, в котором будет четко прописано, что, когда и в каких дозах принимать пациенту с целью самостоятельного купирования приступа БА.
Перед началом лечения обострения бронхиальной астмы (БА) любой степени тяжести необходимо оценить факторы, увеличивающие риск развития связанной с астмой смерти:
Самопомощь по «asthma action plan» при обострении астмы
Врач, занимающийся лечением БА, должен составить четкий план действий пациента при развитии обострения и обучить его им. Пациент, в свою очередь, должен самостоятельно осуществлять мониторинг функции легких и проходить регулярные осмотры у специалистов.
Изменения в приеме медикаментов, приведенные ниже, осуществляются при развитии обострения в течение 1–2 недель.
— В начале обострения проводится попытка его купирования увеличением дозы обычных препаратов, облегчающих течение астмы (реливеры):
— При неэффективности этих действий необходимо увеличение дозы препаратов контроля:
— При ухудшении симптомов и неэффективности лечения необходимо добавление оральных глюкокортикостероидов и срочный визит к врачу. Дозировка преднизолона: для взрослых 1 мг/кг/день (максимально 50 мг) в течение 5–7 дней, для детей 1–2 мг/кг/день (максимально 40 мг) в течение 3–5 дней.
Особенности течения обострений у детей
Незамедлительная госпитализация показана, если у ребенка с БА в возрасте 5 лет и младше наблюдаются любые из следующих симптомов:
При поступлении в приемное отделение пациента с обострением астмы необходимо собрать краткий анамнез, провести быстрый осмотр пациента и в максимально ранние сроки начать терапию.
Анамнез
При сборе анамнеза важно учесть несколько моментов:
Степени тяжести
Степень тяжести течения БА у пациента может определяться с помощью физикального обследования (определение возможного угнетения сознания, оценка поведения и речи, частота пульса, дыхания, участие дополнительных мышц в акте дыхания, артериальное давление, сухие хрипы в легких при аускультации и на расстоянии) и объективных методов (пульсоксиметрия, пикфлоуметрия). Сатурация Лечение
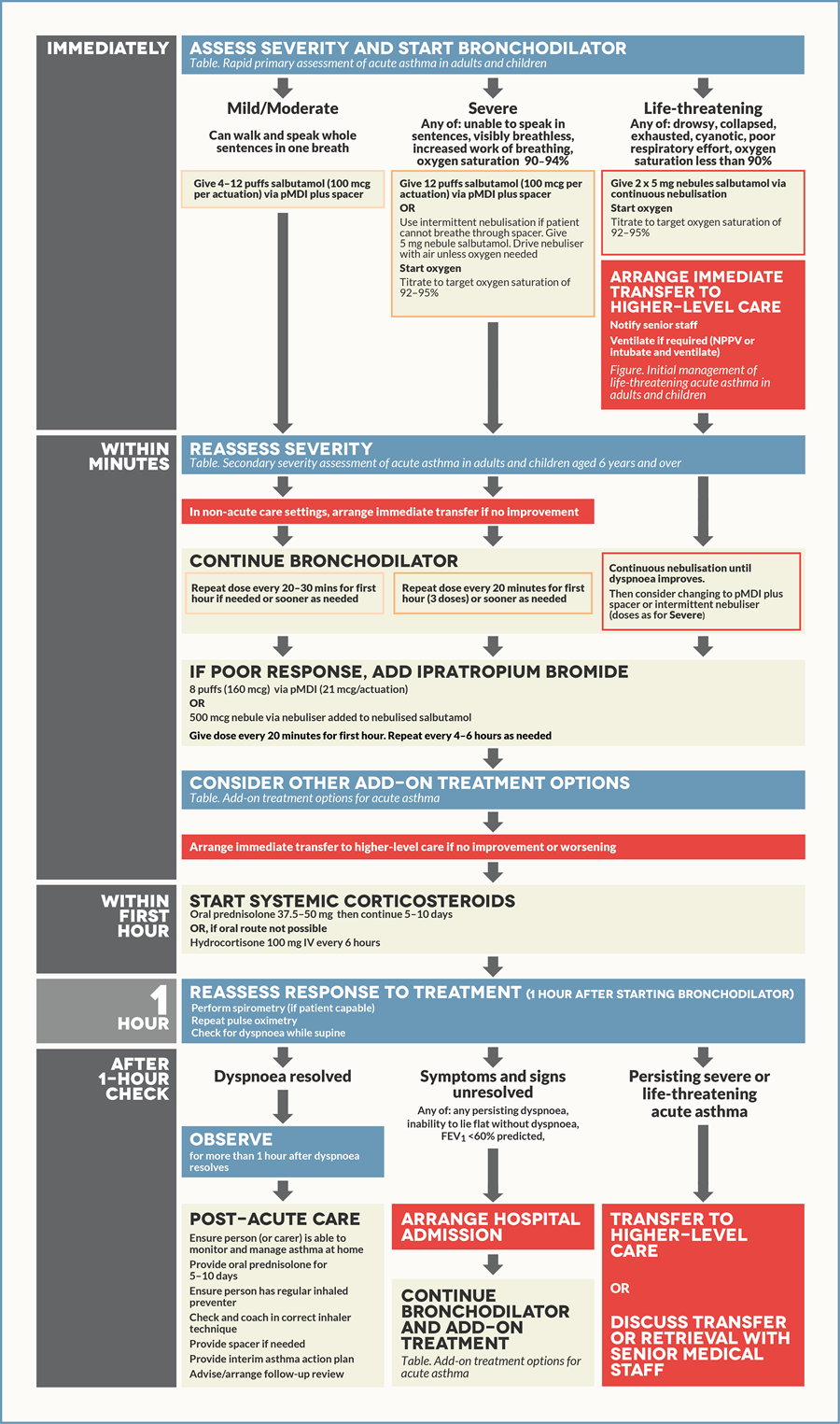
Главной целью терапии БА является быстрое устранение обструкции дыхательных путей и гипоксемии, для чего проводится назначение короткодействующих бронходилататоров, раннее применение системных кортикостероидов и контролируемая подача кислорода.
Ингаляция короткодействующих агонистов бета-2-адренорецепторов
Одним из самых эффективных способов устранения обструкции воздухоносных путей является ингаляция КДБА. Для купирования приступа астмы допустимо применение ингаляторов (дозированный аэрозольный ингалятор (pDMI) со спейсером или порошковый ингалятор (DPI)), однако зачастую при их использовании пациенты допускают ошибки, что приводит к снижению эффективности терапии. При невозможности использовать ингалятор применяют небулайзер.
Для обострений легкой и средней степеней тяжести применяют повторные ингаляции КДБА (до 4–10 вдохов каждые 20 минут в течение первого часа). После первого часа доза КДБА варьирует от 4–10 вдохов каждые 3–4 часа до 6–10 вдохов каждые 1–2 часа и более. Примерное содержание лекарственных средств в 1 дозе ингалятора: сальбутамол — 100 мкг, тербуталина сульфат — 250 мкг, фенотерола гидробромид — 200 мкг, левалбутерол — 45 мкг. Дополнительные ингаляции КДБА не требуются, если имеется хороший ответ на начальную терапию (пиковая скорость выдоха (ПСВ) > 60–80 % от должной или личного максимального результата за 3–4 часа).
Кислородотерапия
Кислородотерапию необходимо проводить под контролем сатурации смешанной крови: целевым является ее уровень 93–95 % для взрослых и 94–98 % для детей 6–11 лет. При отсутствии возможности измерения сатурации кислородотерапия проводится под контролем клинических признаков.
Системные кортикостероиды
Прием ОГКС при обострении БА легкой или средней степени тяжести начинается незамедлительно при значительном ухудшении состояния пациента или при условии, что пациент перед поступлением принимал увеличенные дозировки препарата контроля и реливера. Дозировка преднизолона или его эквивалента для взрослых — 1 мг/кг/день (максимально 50 мг) в течение 5–7 дней, для детей — 1–2 мг/кг/день (максимально 40 мг). Прием ОГКС рекомендуется в течение 5–7 дней. Пациентов необходимо предупредить о частых побочных эффектах приема ОГКС (нарушения сна и настроения, повышение аппетита, рефлюкс желудочного содержимого и т. д.).
Препараты контроля астмы
После терапии обострения астмы необходимо увеличение дозировок препаратов контроля (см. выше) на следующие 2–4 недели вплоть до 3 месяцев в зависимости от причины обострения. Пациентам, не получающим терапию контроля, необходимо назначить лечение, включающее ИГКС.
Оказание помощи в ОАиР
Тяжелые обострения бронхиальной астмы, а также сопутствующие жизнеугрожающие состояния являются показанием для нахождения в ОАиР, где пациенту проводится активный мониторинг жизненных функций и имеется больше возможностей для проведения эффективной терапии. Наличие повышенной сонливости, спутанности сознания либо полное отсутствие дыхательных шумов при аускультации легких служат крайне неблагоприятными признаками и требуют повышенного внимания.
Анамнез
Сбор анамнеза ведется по стандартной схеме, представленной выше, однако особое внимание стоит обратить на проводимую ранее терапию и ее эффективность. Выполняется стандартное физикальное исследование: оценка уровня сознания, поведения и речи, частота пульса и дыхания, участие в акте дыхания вспомогательной дыхательной мускулатуры, артериальное давление, наличие/отсутствие сухих хрипов. Учитывая возможности ОАиР, арсенал доступных объективных методов исследования расширяется:
Кислородотерапия
Необходимо достигнуть артериальной сатурации кислорода не менее 93–95 % (94–98 % для детей 6–11 лет). Кислород может подаваться через носовые канюли или маску. При тяжелом обострении терапия низкими потоками кислорода с достижением уровня сатурации 93–95 % предпочтительнее подачи высоких потоков 100 % кислорода. После стабилизации пациента проводится его «отучение» от кислорода под контролем сатурации крови.
В очень тяжелых случаях пациентам с обострением БА и признаками тяжелой дыхательной недостаточности (гипоксические расстройства сознания, нарастание одышки и отсутствие дыхательных шумов, нарастающая гиперкапния PaCO2 > 60 мм рт. ст., гипоксемия PaO2 Ингаляция короткодействующих агонистов бета-2-адренорецепторов
В ОАиР ингаляция может проводиться при помощи небулайзера периодически или непрерывно. Дозировки препаратов КДБА стандартные для начальной терапии (см. выше). Дозировки препаратов для ингаляции через небулайзер: «небула» по 2,5 мл, содержащая 2,5 мг сальбутамола в физиологическом растворе или «небула» 1,5 мг левалбутерола, 1–2 небулы на ингаляцию, повторные ингаляции проводят каждые 20 минут или непрерывно в течение часа.
Адреналин (эпинефрин)
Внутримышечное введение адреналина (эпинефрина) допустимо как дополнение к стандартной терапии при развитии анафилаксии и ангиоэдемы.
Системные и ингаляционные глюкокортикостероиды
Системные глюкокортикостероиды быстро купируют обострение БА и предотвращают ее рецидив. Применение ГКС обязательно при обострении средней степени тяжести у взрослых, детей 6–11 лет и подростков. Терапию начинают с применения ИГКС, а при отсутствии улучшения состояния пациента в течение первого часа от поступления, назначаются системные ГКС, однако данные по эффективности совместного использования ИГКС и ОГКС пока спорные. Особенно важно назначение ОГКС, если начальная терапия КДБА не принесла успеха, обострение развилось на фоне приема ОГКС или ранее для купирования обострения требовалось применение ГКС.
Эффективность оральных форм ГКС сравнима с их внутривенными инъекциями, ввиду этого предпочтительнее использование таблетированных форм (жидкие для детей). Внутривенное введение ГКС может использоваться при наличии у пациента тошноты или рвоты, выраженной одышки, невозможности глотать, а также во время проведения неинвазивной или инвазивной ИВЛ. ГКС применяются в эквивалентных дозах: у взрослых — 50 мг преднизолона однократно утром или 200 мг гидрокортизона, разделенные на несколько доз, у детей — 1–2 мг/кг до максимальной дозировки 40 мг/день. Курс приема для взрослых 5–7 дней, для детей 3–5 дней.
Различные препараты и методики
— Ипратропия бромид: у взрослых с обострением средней или тяжелой степени тяжести при неэффективности проводимой ранее терапии добавление антихолинергического препарата короткого действия (ипратропия бромида) увеличивает скорость восстановления показателей ПСВ и ОФВ1. Проводят его ингаляцию через небулайзер по 0,5 мг каждые 20 минут до трех доз, далее — по необходимости, или с помощью ингалятора (18 мкг/доза) по 8 вдохов каждые 20 минут;
— Аминофиллин и теофиллин: применение данных препаратов при обострении БА не рекомендуется из-за их плохого профиля безопасности и отсутствии доказательств эффективности;
— Препараты магнезии (MgSO4): могут применяться при тяжелом обострении путем однократного внутривенного капельного введения 2 г в течение 20 минут либо как замена в небулайзере изотоническому раствору NaCl 0,9 % (раствор магнезии также должен быть изотоничен).
Через час после начала проведения терапии проводится оценка ее эффекта: при ОФВ1 или ПСВ 60–80 % от должного значения возможна выписка пациента, при отсутствии положительной динамики показателей ОФВ1 или ПСВ Источник:
Global Initiative for Asthma. Global Strategy for Asthma Management and Prevention, 2018.
Современная терапия бронхиальной астмы
Бронхиальная астма — заболевание, с которым все чаще сталкиваются врачи в последнее время. Это неудивительно, ибо, по данным международных исследований, в развитых странах мира около 5% взрослого населения и почти 10% детей страдают этим недугом.
Бронхиальная астма — заболевание, с которым все чаще сталкиваются врачи в последнее время. Это неудивительно, ибо, по данным международных исследований, в развитых странах мира около 5% взрослого населения и почти 10% детей страдают этим недугом. Кроме того, в последние десятилетия прослеживается четкая тенденция роста заболеваемости аллергическими болезнями, в том числе бронхиальной астмой.
Именно этим обстоятельством обусловлено появление в последние годы ряда программных документов, руководств, посвященных диагностике и лечению бронхиальной астмы. Такими основополагающими документами являются Совместный доклад ВОЗ и Национального института сердца, легких, крови (США) «Бронхиальная астма. Глобальная стратегия (GINA)», 1996 [1] и «Бронхиальная астма (Формулярная система). Руководство для врачей России», 1999 [2]. Эти руководства предназначены для практических врачей и служат одной цели — формированию единой концепции бронхиальной астмы, ее диагностики и лечения.
В свою очередь, современная терапия бронхиальной астмы базируется на вышеупомянутой концепции, на основании которой определяются форма и степень тяжести заболевания.
Согласно современным представлениям, бронхиальная астма независимо от тяжести ее течения является хроническим воспалительным заболеванием дыхательных путей, в формировании которого участвуют многие клетки: тучные клетки, эозинофилы и Т-лимфоциты. При наличии предрасположенности это воспаление приводит к повторяющимся эпизодам хрипов, одышки, тяжести в грудной клетке и кашлю, особенно ночью и/или ранним утром. Эти симптомы обычно сопровождаются распространенной, но вариабельной обструкцией бронхов, которая по крайней мере частично обратима спонтанно или под влиянием лечения. Воспаление приводит к формированию повышенной чувствительности дыхательных путей к самым различным стимулам, которые у здоровых лиц никакой реакции не вызывают. Это состояние — бронхиальная гиперреактивность, которая может быть специфической и неспецифической. Специфическая гиперреактивность представляет собой повышенную чувствительность бронхов к определенным, специфическим аллергенам, вызвавшим развитие астмы. Под неспецифической гиперреактивностью понимают повышенную чувствительность к разнообразным неспецифическим стимулам неаллергенной природы: холодному воздуху, физической нагрузке, резким запахам, стрессам и пр. Одним из важных признаков гиперреактивности, используемых для оценки степени тяжести бронхиальной астмы, является суточная вариабельность пиковой скорости выдоха (ПСВ), составляющая 20% и более.
Аллергические механизмы становятся причиной развития астмы у 80% детей и приблизительно у 40-50% взрослых, поэтому Европейская Академия Аллергологии и Клинической Иммунологии (EAACI) предлагает использовать термин «аллергическая астма» как основное определение астмы, обусловленной иммунологическим механизмом, причем в тех случаях, когда доказано участие в этом механизме антител класса иммуноглобулинов Е, отсюда и термин «IgE-обусловленная астма» [4]. В нашей стране для обозначения этого варианта применяется термин «атопическая астма». Определение полностью отражает суть процесса, в котором принимают участие IgE-антитела. Другие неиммунологические типы астмы ЕААСI предлагается называть неаллергической астмой [4]. По-видимому, к этой форме может быть отнесена астма, развивающаяся из-за нарушения метаболизма арахидоновой кислоты, эндокринных и нервно-психических расстройств, нарушения рецепторного и электролитного балансов дыхательных путей, воздействия неаллергенных аэрополлютантов и профессиональных факторов.
Установление формы бронхиальной астмы имеет принципиальное значение для ее терапии, ибо лечение любого аллергического заболевания начинается с мероприятий по элиминации аллергена (или аллергенов), виновного в развитии болезни. Можно полностью удалить аллерген, если речь идет о домашнем животном, пищевом продукте или лекарственном препарате, и уже только благодаря этому добиться ремиссии бронхиальной астмы. Но чаще развитие астмы провоцирует клещ домашней пыли, которого не удается удалить полностью. Однако количество пылевых клещей можно существенно сократить, используя специальные безаллергенные постельные принадлежности и акарицидные средства, проводя регулярную влажную уборку с помощью пылесоса с глубокой степенью очистки. Все эти мероприятия, равно как и меры по сокращению содержания пыльцы в воздухе жилых помещений в сезон цветения и меры, позволяющие минимизировать контакт со спорами внедомашних и внутридомашних непатогенных плесневых грибов, приводят к значительному ослаблению симптомов бронхиальной астмы у чувствительных к этим аллергенам пациентов.
Фармакотерапия — неотъемлемая и важнейшая составляющая комплексной лечебной программы бронхиальной астмы. Существует несколько ключевых положений в терапии бронхиальной астмы:
Итак, все препараты, которые используются для лечения бронхиальной астмы, принято делить на две группы: базисные или лечебные, то есть обладающие противовоспалительным эффектом, и симптоматические, обладающие преимущественно быстрой бронхолитической активностью. Однако за последние годы на фармакологическом рынке появилась новая группа противоастматических препаратов, которые представляют собой комбинацию противовоспалительных и бронхолитических средств.
К базисным противовоспалительным препаратам относятся глюкокортикостероиды, стабилизаторы тучных клеток — кромоны и ингибиторы лейкотриенов.
Ингаляционные глюкокортикостероиды (беклометазон дипропионат, флютиказон пропионат, будесонид, флунизолид) в настоящее время являются препаратами выбора для лечения среднетяжелой и тяжелой астмы. Более того, согласно международным рекомендциям, ингаляционные глюкокортикостероиды (ИГКС) показаны всем больным с персистирующей астмой, в том числе и с легким течением, ибо даже при этой форме астмы в слизистой дыхательных путей присутствуют все элементы хронического аллергического воспаления. В отличие от системных стероидов, которые, в свою очередь, являются средством выбора при острой тяжелой астме, ИГКС не имеют тяжелых системных побочных эффектов, представляющих угрозу для больного. Лишь в высоких суточных дозах (выше 1000 мкг) они могут угнетать функцию коры надпочечников. Многофакторное противовоспалительное действие ингаляционных глюкокортикостероидов проявляется в их способности снижать или даже вовсе устранять бронхиальную гиперреактивность, восстанавливать и повышать чувствительность β2-адренорецепторов к катехоламинам, в том числе к препаратам β2-агонистам. Доказано, что противовоспалительная эффективность ИГКС зависит от дозы, поэтому целесообразно начинать лечение со средних и высоких доз (в зависимости от тяжести астмы). При достижении стабильного состояния больных (но не ранее чем через 1-3 месяца от начала терапии ИГКС) и улучшении показателей ФВД дозу ИГКС можно снизить, но не отменять! В случае ухудшения течения астмы и снижения функциональных легочных показателей доза ИГКС должна быть повышена. Возникновения таких неопасных, но нежелательных побочных эффектов ИГКС, как кандидоз ротовой полости, дисфония, раздражающий кашель, можно избежать благодаря применению спейсеров, а также полосканию ротовой полости и горла слабым раствором соды или просто теплой водой после каждой ингаляции препарата.
Кромогликат натрия и недокромил натрия (кромоны) подавляют выделение медиаторов из тучной клетки путем стабилизации ее мембраны. Эти препараты, назначенные до начала воздействия аллергена, способны угнетать раннюю и позднюю аллергические реакции. Их противовоспалительный эффект значительно уступает таковому у ИГКС. Снижение бронхиальной гиперреактивности происходит лишь после длительного (не менее 12 недель) лечения кромонами. Однако преимущество кромонов — в их безопасности. Эти препараты практически не дают побочных эффектов и поэтому с успехом применяются для лечения детской астмы и астмы у подростков. Атопическая астма легкого течения у взрослых иногда также хорошо контролируется кромогликатом или недокромилом натрия.
Антилейкотриеновые препараты, включающие в себя антагонисты цистеиниловых (лейкотриеновых) рецепторов и ингибиторы синтеза лейкотриенов, представляют собой относительно новую группу противовоспалительных препаратов, используемых для лечения астмы. В России в настоящее время зарегистрированы и разрешены к использованию препараты зафирлукаст (аколат) и монтелукаст (сингуляр) — блокаторы лейкотриеновых рецепторов, представленные в форме для орального применения. Противовоспалительный эффект этих препаратов заключается в блокаде действия лейкотриенов — жирных кислот, продуктов распада арахидоновой кислоты, участвующих в формировании бронхиальной обструкции. В последние годы появилось много работ, посвященных изучению клинической эффективности антилейкотриеновых препаратов при различных формах и различной степени тяжести бронхиальной астмы. Эти препараты эффективны в лечении больных с аспириновой формой бронхиальной астмы, при которой лейкотриены являются основными медиаторами воспаления и формирования бронхиальной обструкции. Они эффективно контролируют астму физических нагрузок и ночную астму, а также интермиттирующую астму, вызванную воздействием аллергена. Особое внимание уделяется изучению антилейкотриеновых препаратов, применяемых в терапии детской астмы, так как они удобны в использовании и вызывают относительно низкий по сравнению с ИГКС риск возникновения серьезных побочных эффектов. В последних американских руководствах по диагностике и терапии астмы препараты — антагонисты лейкотриеновых рецепторов рассматриваются как альтернатива ИГКС для контроля легкой, персистирующей астмы у детей 6 лет и старше, а также у взрослых. Однако в настоящее время проводится достаточно много исследований, демонстрирующих эффективность этих препаратов у лиц, страдающих среднетяжелой и тяжелой астмой, которым антагонисты лейкотриеновых рецепторов назначаются как дополнение к ИГКС. Такое сочетание препаратов, потенциирующих действие друг друга, усиливает противоастматическую терапию и позволяет избежать повышения дозы ИГКС у некоторых пациентов, а иногда даже снизить ее.
Таким образом, новые противоастматические препараты — антагонисты лейкотриеновых рецепторов могут использоваться для противовоспалительной (базисной) терапии астмы в следующих ситуациях [5]:
Препараты бронхолитического действия применяются как для купирования острого приступа астмы при хроническом ее течении, так и для профилактики астмы физических нагрузок, острой астмы, индуцированной аллергеном, а также для снятия тяжелого бронхоспазма при обострении бронхиальной астмы.
Ключевые положения в бронхолитической терапии бронхиальной астмы:
Селективные β2-агонисты первой генерации [3]: албутерол (сальбутамол, вентолин), тербуталин (бриканил), фенотерол (беротек) и другие — представляют собой наиболее эффективные бронхолитики. Они способны быстро (в течение 3-5 мин) и на довольно долгий срок (до 4-5 ч) оказывать бронхолитическое действие после ингаляции в виде дозированного аэрозоля при легких и среднетяжелых приступах астмы, а при использовании растворов этих препаратов через небулайзер — и при тяжелых приступах в случае обострения астмы. Однако β2-агонисты короткого действия следует применять только для купирования приступа удушья. Они не рекомендуются для постоянной, базисной терапии, так как не способны уменьшать воспаление дыхательных путей и бронхиальную гиперреактивность. Более того, при постоянном и длительном их приеме степень бронхиальной гиперреактивности может возрастать, а показатели функции внешнего дыхания — ухудшаться [3]. Этих недостатков лишены β2-агонисты второй генерации, или β2-агонисты длительного действия: сальметерол и формотерол. В силу липофильности своих молекул эти препараты очень близки β2-адренорецепторам, чем прежде всего и определяется длительность их бронхолитического действия — до 12 ч после ингаляции 50 мкг или 100 мкг сальметерола и 6 мкг, 12 мкг или 24 мкг формотерола. При этом формотерол кроме длительного действия одновременно оказывает и быстрое бронхорасширяющее действие, сопоставимое со временем начала действия сальбутамола. Все препараты β2-адреномиметики обладают способностью ингибировать высвобождение медиаторов аллергического воспаления, таких, как гистамин, простагландины и лейкотриены, из тучных клеток, эозинофилов, причем максимально это свойство проявляется у β2-агонистов длительного действия. Кроме того, последние обладают способностью уменьшать проницаемость капилляров слизистой бронхиального дерева. Все это позволяет говорить о противовоспалительном эффекте β2-агонистов длительного действия. Они способны подавлять как раннюю, так и позднюю астматические реакции, возникающие после ингаляции аллергена, и снижать бронхиальную реактивность. Эти препараты являются средством выбора при легкой и среднетяжелой астме, а также у пациентов с ночными симптомами астмы; их можно использовать также для профилактики астмы физических нагрузок [1]. У пациентов со среднетяжелой и тяжелой астмой их целесообразно сочетать с ИГКС.
Теофиллины — основной вид метилксантинов, используемых в лечении астмы. Теофиллины обладают бронхолитическим и противовоспалительным действием. Блокируя фермент фосфодиэстеразу, теофиллин стабилизирует цАМФ и снижает концентрацию внутриклеточного кальция в клетках гладкой мускулатуры бронхов (и других внутренних органов), тучных клетках, Т-лимфоцитах, эозинофилах, нейтрофилах, макрофагах, эндотелиальных клетках. В результате происходят расслабление гладкой мускулатуры бронхов, подавление высвобождения медиаторов из клеток воспаления и снижение повышенной сосудистой проницаемости. Теофиллин в значительной степени подавляет как раннюю, так и позднюю фазы астматической реакции. Пролонгированные теофиллины успешно применяются для контроля ночных астматических проявлений. Однако эффективность теофиллина при острых приступах астмы уступает (как по скорости наступления эффекта, так и по его выраженности) β2-агонистам, применяемым ингаляционно, особенно через небулайзер. Поэтому внутривенное введение эуфиллина должно рассматриваться как резервное мероприятие для тех пациентов с острой тяжелой астмой, для которых прием β2-агонистов через небулайзер оказывается недостаточно эффективным [1]. Это ограничение обусловлено еще и высоким риском возникновения побочных реакций на теофиллин (сердечно-сосудистые и желудочно-кишечные расстройства, возбуждение ЦНС), развивающихся, как правило, при превышении концентрации 15 мкг/мл в периферической крови. Поэтому длительное применение теофиллина требует мониторинга его концентрации в крови.
Антихолинергические препараты (ипратропиум бромид и окситропиум бромид) обладают бронхолитическим действием за счет блокады М-холинорецепторов и снижения тонуса блуждающего нерва. В России давно зарегистрирован и успешно применяется один из этих препаратов — ипратропиум бромид (атровент). По силе и скорости наступления эффекта антихолинергические препараты уступают β2-агонистам, их бронхолитическое действие развивается через 30-40 мин после ингаляции. Однако совместное их использование с β2-агонистами, взаимно усиливающее действие этих препаратов, оказывает выраженный бронхолитический эффект, особенно при среднетяжелой и тяжелой астме, а также у пациентов с астмой и сопутствующим хроническим обструктивным бронхитом. Такими комбинированными препаратами, содержащими ипратропиум бромид и β2-агонист короткого действия, являются беродуал (содержит фенотерол) и комбивент (содержит сальбутамол).
Принципиально новым шагом в современной фармакотерапии бронхиальной астмы является создание комбинированных препаратов, обладающих выраженным противовоспалительным и длительным бронхолитическим действием. Речь идет о комбинации ингаляционных кортикостероидов и длительно действующих β2-агонистов. Сегодня на фармакологическом рынке Европы, и России в том числе, существуют два таких препарата: серетид, содержащий флютиказон пропионат и сальметерол, и симбикорт, имеющий в своем составе будесонид и формотерол. Оказалось, что в подобных соединениях кортикостероид и пролонгированный β2-агонист обладают комплементарным действием и их клинический эффект существенно превышает таковой в случае монотерапии ИГКС или β2-агонистом длительного действия. Назначение такой комбинации может служить альтернативой повышению дозы ИГКС у пациентов со среднетяжелой и тяжелой астмой. Пролонгированные β2-агонисты и кортикостероиды взаимодействуют на молекулярном уровне. Кортикостероиды увеличивают синтез β2-адренорецепторов в слизистой бронхов, снижают их десенситизацию и, напротив, повышают чувствительность этих рецепторов к действию β2-агонистов. С другой стороны, пролонгированные β2-агонисты стимулируют неактивный глюкокортикоидный рецептор, который в результате становится более чувствительным к действию ингаляционных глюкокортикостероидов [6]. Одновременное применение ИГКС и пролонгированного β2-агониста не только облегчает течение астмы, но и существенно улучшает функциональные показатели, снижает потребность в короткодействующих β2-агонистах, значительно эффективнее предупреждает обострения астмы по сравнению с терапией только ИГКС.
Безусловным преимуществом этих препаратов, особенно привлекающим пациентов-астматиков, является сочетание двух активно действующих субстанций в одном устройстве для ингаляций: дозированном аэрозольном ингаляторе (серетид ДАИ) или порошковом ингаляторе (серетид мультидиск) и турбухалере, содержащем препараты в виде пудры (симбикорт-турбухалер). Препараты имеют удобный двукратный режим дозирования, для симбикорта возможен также однократный прием. Серетид выпускается в формах, содержащих различные дозы ИГКС: 100, 250 или 500 мкг флютиказона пропионата при неизменной дозе сальметерола — 50 мкг. Симбикорт выпускается в дозировке 160 мкг будесонида и 4,5 мкг формотерола. Симбикорт можно назначать от 1 до 4 раз в сутки, что позволяет контролировать вариабельное течение астмы с помощью одного и того же ингалятора, уменьшая дозу препарата при достижении адекватного контроля астмы и увеличивая при ухудшении симптомов. Это обстоятельство позволяет подобрать адекватную терапию с учетом тяжести астмы для каждого конкретного больного. Кроме того, симбикорт за счет быстродействующего формотерола быстро облегчает симптомы астмы. Из этого вытекает повышение приверженности к терапии: видя, что лечение помогает быстро и эффективно, больной более охотно соблюдает предписание врача. Следует помнить, что комбинированные препараты (ИГКС + длительно действующие β2-агонисты) не должны использоваться для купирования острого приступа астмы. Для этой цели пациентам рекомендуются β2-агонисты короткого действия.
Таким образом, применение комбинированных препаратов ИГКС и пролонгированных β2-агонистов целесообразно во всех случаях персистирующей астмы, когда не удается достичь хорошего контроля над заболеванием только назначением ИГКС. Критериями хорошо контролируемой астмы являются отсутствие ночных симптомов, хорошая переносимость физической нагрузки, отсутствие потребности в неотложной помощи, суточная потребность в бронхолитиках менее 2 доз, пиковая скорость выдоха больше 80% и ее суточные колебания менее 20%, отсутствие побочных эффектов от проводимой терапии [7].
Безусловно, целесообразно начинать лечение ИГКС с комбинации их с сальметеролом или формотеролом, что позволит достичь быстрого клинического эффекта и заставит пациентов поверить в успех лечения.
По вопросам литературы обращайтесь в редакцию