какие ткани зуба могут регенерировать
Регенерация тканей в ротовой полости
Другие области применения
Постоянный прогресс команды ученых BTI в исследованиях, применении и создании терапевтических композиций из факторов роста позволил предоставить новые терапевтические решения в различных областях медицины, таких как стоматология, травматология, офтальмология, клиническая и эстетическая дерматология и другие.
Гарантия и надёжность
Инновация
ENDORET® (PRGF®) является первой технологией, основанной на получении концентрата 100% аутогенных факторов роста (получаемого из небольшого объема крови пациента).
Она признана врачами во всем мире и является запатентованной технологией BTI.
Регенеративная медицина стала революционным прорывом в области поиска новых методов лечения.
Благодаря этому, сегодня возможно использовать собственные ресурсы человеческого организма для его излечения, что лежит в основе принципов технологии ENDORET® (PRGF®).
Данная методика позволяет нам изолировать, сконцентрировать и извлечь факторы роста; ряд белков, присутствующих в нашей крови, которые отвечают за естественное восстановление тканей.
Применение технологии ENDORET® (PRGF®) стало революцией в сфере стоматологии и позволило нам разработать решения с минимальной степенью инвазивности, индивидуализировать их, гарантируя биобезопасность и предсказуемость успеха лечения.
Процесс регенерации
Наше тело
Факторы роста
Природная регенерация
Почему ваш стоматолог применяет технологию endoret® (prgf®)?
Потому-что её применение приносит Вам большую пользу. Применение технологии ENDORET® (PRGF®) в стоматологии способствует скорейшему и более предсказуемому лечению, снижая не только боль, но также риск развития инфекции.
Как видно на фотографиях, со стороны где не применялась технология ENDORET® (PRGF®), заметен отек, который означает пост-оперативное воспаление.
Мой случай сложный и болезненный, существуют ли какие-либо решения?
Существует множество универсальных решений, которые предлагает технология ENDORET® (PRGF®). Поскольку получаемый продукт может иметь различную консистенцию (жидкость, сгусток, фибриновая мембрана), плазма, обогащенная факторами роста, помогает нам в решении сложных клинических ситуаций.
Например, жидкостью может быть смочена поверхность имплантата с целью сокращения времени его остеоинтеграции, а в форме сгустка плазма применяется для восстановления объема кости после удаления зуба, или закрытия дефекта кости. Также возможно создание трансплантата в соединении плазмы с костью пациента или искусственным костным материалом для того, чтобы избежать более сложного хирургического вмешательства.
Кто может применять технологию endoret® (prgf®)?
Гарантии для пациентов
Технология ENDORET® (PRGF®) была создана благодаря следованию серии точных и очень строгих протоколов на каждом этапе: забор крови, центрифугирование, разделение на фракции, активация и, непосредственно, применение. Данный протокол гарантирует качество конечного продукта, при оптимальных условиях. Все элементы, используемые специалистами в данном протоколе, были разработаны Исследовательским отделом Института Биотехнологий (BTI).
Знаки качества
Все составляющие технологии ENDORET® (PRGF®) получили сертификацию СЕ от Европейского центра здравоохранения, поэтому Система ENDORET® (PRGF®) разрешена к использованию в странах Европы и США с целью получения факторов роста из крови пациентов и применения их в различных сферах медицины.
ТЕХНОЛОГИЯ ENDORET® (PRGF®) УСПЕШНО ПРИМЕНЯЕТСЯ БОЛЕЕ, ЧЕМ В 20 СТРАНАХ МИРА.
Регенерация пародонта: клинические подходы и возможности
Максимальное сохранение собственных зубов является, по сути, манифестом для всех пародонтологов, и целью, за которой уже многие годы следуют все стоматологи. Технологические усовершенствования сделали данную цель уже более достигаемой, чем ранее, но даже несмотря на возможности пародонтальной регенерации и реконструкции периодонтальной связки, цемента, десен и альвеолярной кости, полностью решить проблему пародонтальных поражений так и не удалось.
В июне 2014 года 52 международных представителя, среди которых были клиницисты, исследователи и ученые, собрались вместе в ходе семинара Американской академии пародонтологии (AAP), для того чтобы систематизировать все доступные данные по пародонтальной регенерации. В ходе семинара участникам удалось не только обговорить механизмы биологических реакций в структуре пародонта, и то, как данные аспекты могут быть использованы в практике, но и определить перспективы для дальнейших исследований. AAP инициировала работу данного конгресса совсем небезосновательно: в то время в США уровень распространенности пародонтальных патологий был критически высоким. Данные, полученные Центрами по контролю и профилактике заболеваний (CDC), которые удалось собрать за период 2009-2012 годов, указывают на то, что почти 50% всего населения США в возрасте старше 30 лет, имеют разные формы поражения тканей пародонта, а 70% американцев в возрасте 65 лет и старше страдают от деструктивных форм пародонтита. Пародонтит легкой и средней форм сложности был зарегистрирован среди 38% взрослого населения США. Сохранение целостности естественного зубного ряда при одновременном обеспечении ремиссии пародонтального заболевания является крайне сложной клинической задачей, которая выходит за рамки обычной коррекции параметров эстетики и функции структурных элементов ротовой полости.
Растущее количество фактических данных указывает на наличие связи между патологией пародонта и системными заболеваниями организма: например, была обнаружена зависимость между пародонтитом умеренно-тяжелой степени сложности и повышенным риском возможности развития диабета. Эпидемиологические данные также свидетельствуют о том, что пародонтит повышает риск развития сердечно-сосудистых заболеваний. Хотя имеющихся данных пока что недостаточно, однако ученые уже отметили возможность существования патофизиологической связи между пародонтитом и хронической обструктивной болезнью легких, пневмонией, хронической болезнью почек, ревматоидным артритом, когнитивными нарушениями, ожирением, метаболическим синдромом и раком. Регенеративные методы коррекции пародонтальных нарушения нацелены не на замедление процесса прогрессирования заболевания, но на восстановление сформировавшихся дефектов мягких и твердых тканей, защиту еще интактных единиц зубного ряда и подготовку пораженных участков для дальнейшей реабилитации с использованием имплантатов. Однако воспаление, ассоциированное с пародонтитом, все же может быть уменьшено в процессе повторного физиологического восстановления тканей за счет естественных биологических механизмов.
Типы регенеративных техник пародонтальных вмешательств
Многие новые появляющиеся методы регенераторных пародонтальных вмешательств, в том числе и те, которые предполагают использование систем доставки определенных клеток, матричных остовов, костных анаболических агентов и мезенхимальных стволовых клеток, находятся на ранней доклинической стадии апробации и требуют дополнительного научного исследования для их дальнейшей имплементации в клиническую стоматологическую практику. Процедуры твердотканной аугментации позволяют восстановить костную ткань, периодонтальную связку и корневой цемент, которые в своем комплексе обеспечивают стабилизацию зуба. Процедуры мягкотканой аугментации позволяют стимулировать рост новых десен в области рецессии, улучшая эстетической вид слизистой. Наиболее распространенными в клинической практике являются следующие три типа пародонтальных ятрогенных вмешательств: костная аугментация, использование биологических агентов и направленная тканевая регенерация (НТР).
Костная пластика
Костная пластика является одной из наиболее долго используемых техник регенеративных ятрогенных вмешательств, в ходе реализации которой может быть использована собственная костная ткань пациента (аутотрансплантат), костная ткань другого пациента (аллотрансплантат), костная ткань разных видов животных (ксенотранслпантат), или же искусственно синтезированная костная ткань (аллопластный трансплантат). Со временем используемый аугментат замещается костью пациента.
Направленная тканевая регенерация
Процедура направленной регенерация тканей предусматривает применение барьерной мембраны для защиты и стабилизации кровяного сгустка в ходе процесса заживления области костной аугментации. Любые вмешательства в структуру кровяного сгустка во время заживления раны могут вызвать нарушения и формирование рубцовой ткани вместо новой кости и связки. Используемые мембраны могут быть резорбируемыми и нерезорбируемыми. Первые идеально подходят при вмешательствах непосредственно на пародонте, другие – лучше всего работают в ходе реконструкции альвеолярного гребня и его подготовки под будущую установку имплантатов. Резорбируемые мембраны исключают потребность проведения повторных хирургических вмешательств с целью их удаления, что очень удобно для пациента. Но при этом они также должны характеризовать соответствующими параметрами деградации, которые позволят удержать достаточный объем пространства для его выполнения костной тканью. В случаях, когда основная барьерная функция мембраны может быть компрометирована анатомическими особенностями в области вмешательства, врач должен прибегнуть к альтернативному методу лечения. Так, вместо мембраны можно использовать костный графт, который характеризуется достаточно быстрой резорбцией. Мембраны, которые резорбируются слишком медленно, могут препятствовать притоку крови к регенерированным структурам, и более часто подвергаются инфицированию. Как и в любом клиническом случае, врач должен использовать НТР только в клинических условиях, оптимально подходящих для такого вида вмешательства. Кроме того, для обеспечения успешности НТР врач должен провести прецизионную деконтаминацию корня зуба в области реализации основного хирургического вмешательства. Следует отметить, что надлежащая дезинфекция корня зуба также требует специальных технических навыков и соответствующего опыта.
Биопрепараты
Биологические агенты продемонстрировали значительный потенциал в процессе восстановления пародонтальных ран. Такие препараты включают факторы роста, производные эмалевого матрикса и костные анаболические агенты, которые стимулируют клетки к пролиферации, миграции, биосинтезу или дифференцированию матрикса. Как правило, большинство техник использования биопрепаратов являются на ранних стадиях апробации, однако некоторые из них уже довольно широко применяются в клинической практике. В будущем планируется проводить индивидуализированные пародонтальные вмешательства с учетом генетического фона пациента, использованием биомаркеров с целью прогноза, трехмерных технологий с целью планирования и клеточных остовов в качестве основных материалов для трансплантации.
Регенеративные процедуры при дефектах в области фуркации и внутрикостных дефектах
Как правило, пациенты, требующие проведения регенеративных пародонтальных вмешательств, характеризуются наличием дефектов тканей в области фуркации и внутрикостных дефектов. Классификация дефектов в области фуркации осуществляется за счет оценки уровня потери пародонтального прикрепления на участках «раздвоения» корней зубов. Клиницисты часто стоят перед выбором: стоит ли удалять такие зубы, или все же попытаться восстановить ткани в области имеющегося дефекта.
Результаты, полученные Huynh-Ba и коллегами, указывают на то, что НТР области фуркационных дефектов обеспечивает высокую выживаемость пролеченных зубов на уровне 83,3-100% в ходе 5-12 летнего мониторинга. Внутрикостные дефекты развиваются при внутреннем пародонтальном поражении альвеолярного гребня. Lang и коллеги рекомендуют оценить морфологию внутрикостного дефекта по количеству пораженных костных стенок.
Классификация Goldman и Cohen (1958) предполагает наличие четырех классов дефектов:
Цель пародонтальной терапии любых типов дефектов состоит в непосредственной регенерации тканей пародонта, включая аппозицию нового цемента с проникновением в него волокон пародонтальной связки. Reynolds и коллеги установили, что регенеративное лечение внутрикостных пародонтальных дефектов повышает уровень клинического прикрепления, способствует редукции пародонтальных карманов и улучшает общее состояние пародонта. Алгоритм восстановления внутрикостных дефектов, как правило, предусматривает костную аугментацию посредством разных типов трансплантатов, однако с той же целью можно использовать методы направленной регенерации тканей и принципы применения биологически активных агентов.
От теории к практике
Материалы семинара AAP по регенерации были опубликованы в Journal of Periodontology, и включали в себя консенсусные отчеты и систематические обзоры по восстановлению мягкотканного покрытия поверхности корней, дефектов в области фуркаций и реконструкции пародонта. Сопровождающие практические рекомендации были опубликованы в журналах Clinical Advances in Periodontics и Journal of Periodontology, которые сформировали, собственно, переход от теории к практике.
Методы лечения дефектов рецессии десны представляют собой ключевую проблему в возможностях регенерации пародонта. Рецессия десны является довольно распространённым состоянием, и участники семинара сошлись на том, что оценка результатов его коррекции должна проводиться с учетом уменьшения глубины дефекта, улучшения уровня клинического прикрепления и прироста кератинизированных мягких тканей. С целью восстановления покрытия обнаженной поверхности зуба можно использовать техники субэпителиального соединительнотканевого лоскута, коронально смещенного лоскута, свободного десневого графта и его аналогов, по типу бесклеточного дермального матрикса, кетогенного коллагенового мактрикса и биоактивных агентов (рекомбинантного фактора роста, полученного из тромбоцитов или производных эмалевой матрицы).
Richardson и коллеги отметили: «Вариативность выбора вышеупомянутых методов вертится вокруг возможности или невозможности забора мягкотканного трансплантата с неба. Выбор метода лечения должен базироваться на возможности формирования максимального ассоциированного с формой рецессии графта, учитывая при этом все цели хирургического вмешательства и индивидуальные условия клинической ситуации. Результаты проведенного систематичного обзора указывают на то, что применение субэпителиального соединительнотканевого трансплантата обеспечивает наилучший исход лечения с точки зрения восстановления покрытия поверхности корня и прироста кератинизированных десен».
Что же касается ситуаций, не требующих восстановления мягкотканного покрытия корня, John и коллеги установили, что процедура аугментации области десен обязательно должна сопровождаться обучением пациента гигиеническому уходу за полостью рта и редукцией влияния потенциальных факторов риска: «Понимание того, что минимальное количество прикрепленной десны и неоптимальный уровень гигиены полости рта, являются определяющими клиническими условиями – это первый шаг на пути к объективной диагностике. Анализ пациент-специфических факторов помогает адекватно подойти к выбору хирургической процедуры, направленной на увеличение параметров кератинизированных тканей/прикрепленных десен.»
Reynolds и коллеги резюмировали, что выбор наиболее эффективного метода лечения внутрикостных дефектов зависит от проведенной полноценной диагностики и учета пациент-ассоциированных факторов риска. При этом авторы также резюмировали, что терапевтические подходы, предусматривающие использование комбинированных техник лечения, также являются достаточно успешными. Так, например, бесклеточные трансплантаты для замещения дефектов, которые используются в протоколе направленной регенерации тканей, способствуют достижению надлежащей стабильности области аугментации, защите кровяного сгустка и формированию новой ткани. При этом данный подход, по сути, не предусматривает использование биологически-активных агентов. Выбор метода лечения внутрикостных дефектов должен предполагать анализ таких параметров, как количество резидуальных интактных стенок, потерю высоты ткани, близость дефекта к другим структурам, возможность достижения надлежащей васкуляризации в будущем.
Aichelmann-Reidy при лечении патологии в области фуркации рекомендуют учитывать системные пациент-ассоциированные факторы, локализированные анатомические возможности и характеристики самой области фуркации. Дефекты фуркации по II классу, как правило, подлежат прогнозированному лечению с применением методов регенераторного лечения, а дефекты по I классу можно восстановить посредством комбинации костной аугментации и изолирующих мембран. Lin и коллеги указывают на то, что современные технологии прогрессивно способствуют развитию новых пародонтально-регенеративных методов лечения, и публикующиеся клинические отчеты свидетельствуют о еще большей вариативности актуальных методов вмешательства на тканях пародонта. Однако, остается еще одна проблема – дефицит доказательной базы, но данный аспект зависит лишь от времени и результатов имплементации различных подходов.
Систематизированный консенсусный доклад Cochran и коллег о приоритетах будущих исследований в области новых пародонтальных технологий можно представить в виде последующих тезисов:
Заключение
Регенеративная терапия с использованием трансплантатов мягких и твердых тканей, биологических агентов или направленной тканевой регенерации имеет многообещающее будущее в отрасли пародонтологии. Ряд дополнительных регенеративных методов, включая новые системы доставки клеток, является весьма перспективным, но требует дальнейшего научного исследования для определения их эффективности. Результаты консенсусных семинаров по регенерации пародонта указывают на наличие сильной доказательной базы, подтверждающей эффективность реконструктивной терапии пародонтальных дефектов, позволяющей восстановить не только структуру мягких и твердых тканей, но и их полноценную функцию. Использование регенеративных вмешательств в области пародонта также способствует сохранению собственных зубов пациента, что является одной из наиболее важных целей в пародонтологии.
Авторы:
William V. Giannobile, DDS, DMSc
Pamela K. McClain, DDS
Руководство по «выращиванию» зубов, или биоинжениринг в стоматологии
Доктор зло, или стоматолог за работой.
Автор
Редакторы
Статья на конкурс «био/мол/текст»: Все еще боитесь стоматологов? Тогда эта статья для вас! Давайте на секунду представим, что бормашина затихла, и ее звук больше не побеспокоит вас никогда, а инструменты для удаления зубов так и остались в невскрытом крафт-пакете. «Такое возможно?» — спросите вы. «Да! — отвечу вам я. — Ведь в тот самый момент на первых полосах будет мелькать интригующая новость — впервые выращен и имплантирован человеку зуб. Успешно. »
Конкурс «био/мол/текст»-2017
Эта работа опубликована в номинации «Свободная тема» конкурса «био/мол/текст»-2017.
Генеральный спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.
Спонсором приза зрительских симпатий и партнером номинации «Биомедицина сегодня и завтра» выступила фирма «Инвитро».
. Говорят, зло не имеет лица. Действительно, на его лице не отражалось никаких чувств. Ни проблеска сочувствия не было на нём, а ведь боль просто невыносима. Разве он не видит ужас в моих глазах и панику на моем лице? Он спокойно, можно сказать, профессионально выполнял свою грязную работу, а в конце учтиво сказал: “Прополощите рот, пожалуйста. ”
Так описывает посещение стоматолога Дэн Эндрюс в своем рассказе «Несчастная». И действительно, с детства мы с невероятным «трепетом» относимся к таким специалистам, как стоматологи. Что только ни предпринимают родители, чтобы заставить своих детей хотя бы зайти в кабинет к врачу, стараясь не думать о том, что ждет их дальше. Да и порой у взрослого человека душа уходит в пятки при виде многочисленных инструментов. Иногда для этого достаточно только вида стоматологической клиники.
В итоге состояние полости рта и твердых тканей зубов во всем мире не вселяет надежду на будущее без кариеса. Несмотря на успехи, достигнутые в стоматологическом лечении, потеря зубов остается одной из самых существенных проблем. Так, по данным ВОЗ, основными причинами потери зубов являются кариес и пародонтит. Полная потеря зубов в особенности широко распространена среди пожилых людей. В глобальных масштабах примерно у 30% людей в возрасте 65–74 лет отсутствуют зубы по причине воспалительных заболеваний пародонта и патологии твердых тканей зубов [1].
Поэтому неудивительно, что состояние полости рта у населения не только в России, но и в мире представляет собой серьезную проблему, предлагая возможности как для изучения, так и, что более важно, — для поиска новых способов лечения. Одним из них стала тканевая инженерия — междисциплинарная отрасль, целью которой является создание биологических заместителей, восстанавливающих и поддерживающих функции ткани или органа. Достаточно высокая эффективность методов тканевой инженерии и их потенциал заставили обратить на себя внимание многих деятелей науки. Это же способствует их неувядающей популярности в различных сферах медицины и по сей день.
Зуб за зуб
Первые попытки стоматологического лечения люди предприняли очень давно. При раскопках в Египте археологи обнаружили вырезанный из раковины моллюска искусственный зуб в челюсти человека, жившего пять с половиной тысяч лет тому назад (рис. 1) [2].
Рисунок 1. Вид вестибулярной поверхности зуба, вырезанного из раковины. Интервал отметок по краям — 1 мм.
Помимо «зуба из морепродуктов» нашли реимплантированные зубы в челюсти молодой женщины, причем все они были не на своих «местах»: вместо верхнего центрального резца альвеола содержала клык. Эти зубы имели все признаки интеграции, то есть сращения с живой тканью [3]. Таким образом, оказывается, уже в это время были сделаны первые шаги в стоматологии, но, что более удивительно, также и в области тканевой инженерии.
Но, спросите вы, как могут быть связаны стоматология и тканевая инженерия, не считая того, что несколько тысячелетий назад один египтянин ценил свою улыбку так, что заменил потерянный зуб чужим? Очень даже могут, ведь на данный момент не существует панацеи для лечения пациента, которому поставлен диагноз частичной или полной адентии, то есть отсутствия зубов. К тому же потеря даже одного зуба приводит к изменению не только эстетических параметров, но, что более важно, к нарушению первичной обработки пищи и ухудшению речи. Не стоит также забывать, что при потере зубов — будь то в результате травмы или кариозного процесса и его осложнений — изменяется состояние зубочелюстной системы в целом, что ухудшает прогноз и осложняет дальнейшее лечение.
Для того чтобы компенсировать функции утраченного зуба, сейчас используют ортопедические конструкции и имплантаты (рис.2). Все же это «искусственные» заменители: у них отсутствуют сосуды, нервные окончания, рецепторы. Также одним из наиболее важных аспектов является отсутствие периодонтальной связки у имплантата, до недавнего времени считавшегося золотым стандартом лечения при отсутствии зубов.
Рисунок 2. Строение зуба и имплантата. Natural tooth — зуб. Artificial crown — искусственная коронка. Gingiva — десна. Implant — имплантат. Osteointegration — остеоинтеграция. Periodontal ligament — периодонтальная связка.
Периодонт — это высокоспециализированная фиброзная соединительная ткань, состоящая из клеток и внеклеточного матрикса. Она располагается между цементом, покрывающим корень зуба, и костной тканью, формирующей стенку лунки. У человека периодонтальная связка способствует укреплению зуба в альвеоле, обеспечивает механическую устойчивость к воздействию жевательных сил на зуб, распределяя приложенное давление: сила всех жевательных мышц составляет ни много ни мало 390 кг [4].
Что же не так с имплантатом?
Во-первых, как уже было описано выше, — это отсутствие периодонтальной связки. Имплантат удерживается за счет остеоинтеграции, то есть посредством анатомической связи с костной тканью. В отличие от зуба, у которого имеется небольшая физиологическая подвижность, имплантат неподвижен. Если же вокруг имплантата появляется подобие соединительной ткани, то это означает только одно — периимплантит, то есть воспалительный процесс в костной ткани, окружающей имплантат. В большинстве случаев развития данного сценария имплантат подлежит удалению [5].
Во-вторых, имплантат не может быть соединен в общую конструкцию с оставшимися зубами пациента из-за отсутствия связочного аппарата и неспособности адекватного распределения давления. Здесь работает принцип: кто сильнее, тот в зубном ряду. Либо имплантат не позволит зубу двигаться, что приведет к атрофии тканей пародонта и потере зуба, либо будет потерян имплантат.
В-третьих, у каждого пациента свои анатомические особенности, и объем костной ткани для постановки имплантата не всегда бывает достаточным.
И, в-четвертых, важно помнить, что для долговечности имплантата необходимо поддерживать идеальную гигиену полости рта, что, мягко говоря, получается далеко не у всех. Здесь мы возвращаемся к ранее упомянутой проблеме периимплантита [5]. Получается своего рода замкнутый круг.
Все эти недостатки приводят к поиску альтернативных способов лечения.
Одним из них может стать тканевая инженерия. В этой статье я постараюсь суммировать недавний прогресс, перспективы и основные направления развития биоинженерии зуба, то есть кратко рассказать о том, что нужно для создания зуба.
Откуда берутся зубы, или одонтогенез in vivo
Естественно, перед тем как разбираться в биоинжениринге, нужно понимать, как зуб развивается изначально в организме человека.
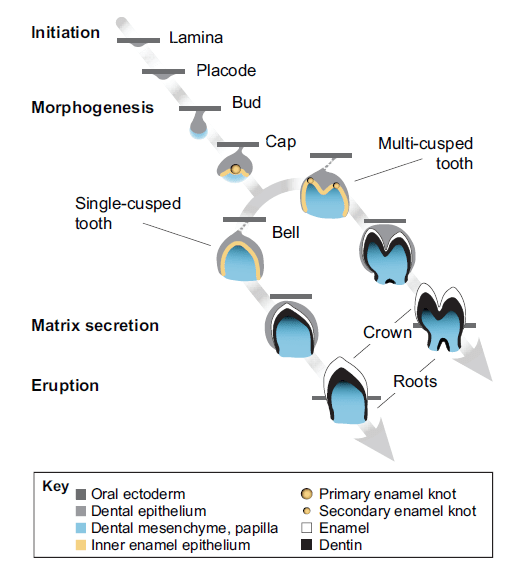
Формирование зубов — достаточно сложный процесс, который сопровождается тканевым взаимодействием и контролируется огромным количеством сигнальных молекул (рис.3) [6].
Рисунок 3. Стадии развития зуба. В процессе развития зуб проходит через следующие стадии: плакоды, почки, колпачка, колокола, стадии развития корня и прорезывания. Формирование зуба начинается в области дентальной пластинки, которая состоит из мезенхимальных клеток и инвагинированного эпителия. На первом этапе из дентальной пластинки образуется зачаток зуба (стадия плакоды). Во время стадии колпачка формируется первичный эмалевый узел, а на стадии колокола — вторичные эмалевые узлы, которые формируют бугорки будущих коронок зубов. Здесь же эпителиальные и мезенхимальные клетки зародыша зуба дифференцируются в амелобласты, одонтобласты и клетки дентального фолликула. Амелобласты и одонтобласты продуцируют эмаль и дентин соответственно. Клетки дентального фолликула дифференцируются в клетки тканей периодонта: в периодонтальную связку, цемент и альвеолярную кость.
Зуб развивается из тканей, образованных зародышевым листком эктодермой. Делясь и дифференцируясь, клетки эктодермы формируют структуры, необходимые для развития зуба: дентальный эпителий и нервный гребень, который позже преобразуется в мезенхиму. Формирование зуба инициируется и регулируется эпителиально-мезенхимальными взаимодействиями. Самый ранний признак развития зуба — образование дентальной пластинки, подковообразного утолщения эпителия вдоль верхней и нижней челюстей. Дальнейшие этапы включают стадии плакоды, почки, колпачка, колокола и развитие корня [6], [7].
В развитии зуба основную роль играет взаимодействие между клетками эпителия и мезенхимы. Почему же в процессе развития зародыша формируется именно зуб, а не другой орган, например, кишечник? Все дело в том, что клетки, участвующие в развитии зуба, обладают одонтогенной компетентностью. Генетическая подоплека одонтогенности, то есть способности стволовых клеток дифференцироваться непосредственно в дентальные клетки, до конца не выяснена, хотя выделено более 200 генов, «причастных» к развитию зуба. Во многих работах, направленных на изучение данного феномена, также уделяется много внимания неким эпителиальным сигнальным центрам. Всего на данный момент мы знаем о 4 таких центрах: дентальная пластинка, плакода, первичные и вторичные эмалевые узлы, основная роль которых заключается в экспрессии сигнальных молекул, регулирующих формирование зуба [8], [9].
Негонконгская «Триада»
Теперь, когда мы так много знаем о происхождении и развитии зуба, можно перейти непосредственно к интересующей нас теме — тканевой инженерии.
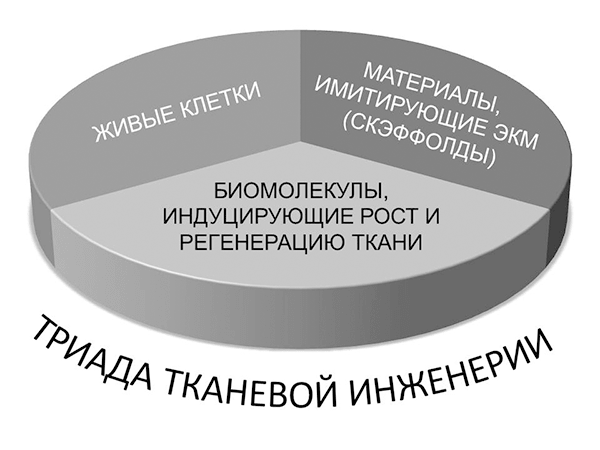
Тканевая инженерия представляет собой совокупность методов и процедур, направленных на регенерацию биологических тканей. Она включает в себя триаду основных элементов (рис.4): стволовые клетки, внеклеточный матрикс или скаффолд (от англ. scaffold — помост), факторы роста и сигнальные пути (signaling) [10].
Рисунок 4. Триада тканевой инженерии. Основу триады тканевой инженерии составляют стволовые клетки, факторы роста и внеклеточный матрикс.
Цель тканевой инженерии — заместить утраченные клетки, ткани и органы, либо способствовать их регенерации, либо просто восстановить нарушенную функцию.
Сегодня мы много слышим и читаем о стволовых клетках. Это та отрасль науки, где ведут горячие споры. Информация, которая выходит к потребителям, как правило, не всегда объективна. Что же на самом деле представляют собой стволовые клетки, и как и какие из них можно использовать в тканевой инженерии зуба?
Давайте знакомиться: стволовые клетки — это недифференцированные эмбриональные или взрослые (постнатальные) клетки, способные проходить через огромное количество клеточных делений, находясь в недифференцированном состоянии, а также образовывать промежуточные клеточные типы — предшественники, которые могут дифференцироваться в различные клетки и создавать полноценные ткани и органы (рис.5) [10], [11].
Рисунок 5. Классификация стволовых клеток по способности к дифференцировке. Стволовые клетки по масштабу дифференцировки делят на тотипотентные, плюрипотентные, мультипотентные и унипотентные. Тотипотентные клетки способны дифференцироваться в любой тип клеток взрослого организма. Плюрипотентные клетки могут продуцировать специализированные клетки трех зародышевых листков (эктодермы, эндодермы и мезодермы), но не целый организм. Мультипотентные клетки продуцируют ограниченный набор типов клеток. Унипотентные клетки способны к дифференцировке только в один вид клеток [13].
Первую клеточную линию эмбриональных стволовых клеток выделили в далеком 1998 году [12]. На самом деле, не так уж и давно, а с точки зрения хода истории можно сказать совсем недавно, но прогресс колоссален [10].
Эмбриональные стволовые клетки выделяют из бластоцисты в течение развития эмбриона. Они дают рост трем зародышевым слоям: экто-, эндо- и мезодерме. Эти клетки тотипотентны, то есть они могут развиться в каждый из более 200 типов клеток взрослого организма [10].
Сейчас известно 3 источника эмбриональных стволовых клеток млекопитающих: клетки, выделенные из внутренней клеточной массы бластоцисты; клетки тератом и первичные половые клетки зародыша [10].
Как было раньше упомянуто, стволовые клетки бывают не только эмбриональные, но и постнатальные. Что касается «взрослых» стволовых клеток, то они существуют в организме в различных тканях, включая костный мозг, кровеносные сосуды, печень, кожу, жировую ткань и дентальные ткани. Они локализованы в специальных нишах, где идет регуляция их пролиферации, миграции и сроков жизни. Постнатальные стволовые клетки мультипотентны, то есть дают рост только одному типу клеток.
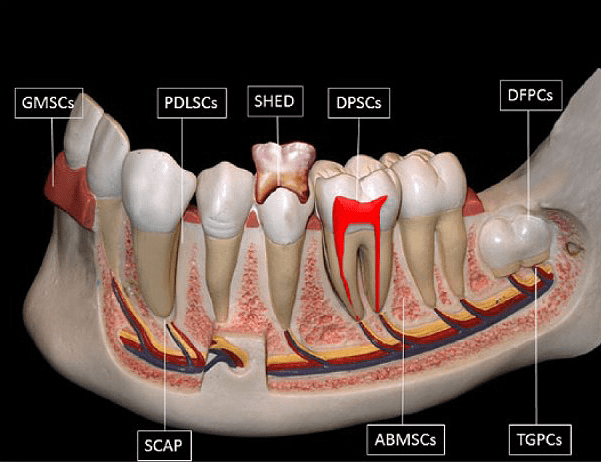
Дентальные стволовые клетки представляют собой популяцию постнатальных мезенхимальных стволовых клеток (МСК), обладающих способностью к самообновлению и дифференцировке [4], [14]. В зависимости от локализации депо МСК (рис. 6) [15], они подразделяются на:
Рисунок 6. Стволовые клетки зуба. Схематическое изображение источников дентальных стволовых клеток. Расшифровку аббревиатур смотрите во врезке ниже.
Аббревиатуры
Остановимся на некоторых из них.
Стволовые клетки пульпы можно достаточно легко выделить из пульпы удаленных зубов. Они представляют собой очень привлекательный и перспективный источник аутологичных стволовых клеток и могут применяться как для регенерации дентина, пульпы и цемента, так и для восстановления костной ткани [15]. Помимо этого они проявляют сильную нейрорегенеративную активность, что представляет особую ценность при лечении повреждений спинного мозга: МСК пульпы кроме подавления раннего воспалительного ответа ингибируют апоптоз нейронов, астроцитов и олигодендроцитов после травмы, что приводит к сохранению нервного волокна и миелиновой оболочки. Также установили, что они способствуют регенерации перерезанных аксонов. Таким образом, ученые предполагают, что МСК пульпы смогут обеспечить значительные терапевтические преимущества в лечении травм спинного мозга [16].
Стволовые клетки удаленных молочных зубов — это постнатальная популяция стволовых клеток с высокой пролиферативной способностью, высокой жизнеспособностью и потенциалом многолинейной дифференциации (например, в остеобласты, нейронные клетки и одонтобласты) [15].
Мезенхимальные стволовые клетки десны идеально подходят для восстановления поврежденных тканей пародонта, мышц и даже сухожилий. Но пока не совсем ясно, способны ли они формировать клетки дентина и пульпы [15].
Прогениторные клетки зубного зачатка — относительно новая популяция стволовых клеток, которую обнаружили в мезенхиме зачатка третьего моляра на стадии колокола. Они показывают такую же многоуровневую дифференциацию, как и другие МСК зуба, включая способность к дифференцировке в адипоциты, остеобласты, одонтобласты, хондроциты и нейроны, а также могут дифференцироваться в клетки с морфологическими, фенотипическими и функциональными характеристиками гепатоцитов. Отсюда предполагают, что данный тип стволовых клеток в будущем смогут использовать для лечения заболеваний печени [15].
Таким образом, каждый тип дентальных стволовых клеток имеет свои особенности и сферы применения не только в стоматологии, но и в других областях медицины.
Помимо описанных выше МСК, в тканевой инженерии используют и индуцированные плюрипотентные стволовые клетки (ИПСК), полученные из соматических клеток. Впервые о них заговорили в 2006 году, когда японские ученые Кадзутоси Такахаси и Синъя Яманака показали, что соматические клетки можно перепрограммировать в ИПСК с помощью усиления экспрессии определенных факторов транскрипции (Oct3/4, Sox2 и Klf4) [17], [18]. Сами по себе эти клетки иммунологически нейтральны и, что не менее важно, не вызывают таких этических препирательств, как стволовые эмбриональные клетки. Однако для их перепрограммирования использовали вирусных агентов, что могло повлечь за собой формирование новообразований [19]. Были попытки использования вместо вирусов химических молекул [20], но, к сожалению, процент успешного репрограммирования оказался невелик. Сейчас развивают новые способы получения ИПСК, поскольку их применение выглядит достаточно привлекательным и весьма многообещающим.
Что нам стоит зуб построить?
Для использования стволовых клеток в тканевой инженерии необходимо наличие скаффолда и ростовых факторов (рис. 7). Идеальный скаффолд должен поддерживать прикрепление, миграцию, пролиферацию и пространственную организацию клеток.
Рисунок 7. Что нам стоит зуб построить?
В основном, скаффолд как подходящий матрикс для реконструкции тканей должен соответствовать следующим требованиям [21]:
Материалы, используемые для формирования скаффолдов, разделяют на натуральные и синтетические (рис. 8) [22]. Биоактивное стекло, полимолочная кислота, различные композиты (многокомпонентные материалы, в основе которых — матрица на основе металла, полимера или керамики) — все это синтетические материалы. Несмотря на то, что эти материалы позволяют изготовлять скаффолды необходимой формы, их применение весьма ограничено ввиду неудовлетворительной биосовместимости и токсичности. Из биоматериалов (натуральных материалов), используемых для создания скаффолдов, можно выделить коллаген, хитозан, гиалуроновую кислоту. Они состоят из макромолекул, которые также входят в состав экстраклеточного матрикса, поэтому биосовместимы и хорошо биодеградируемы. Однако они менее прочные и способны вызывать реакции отторжения [21].
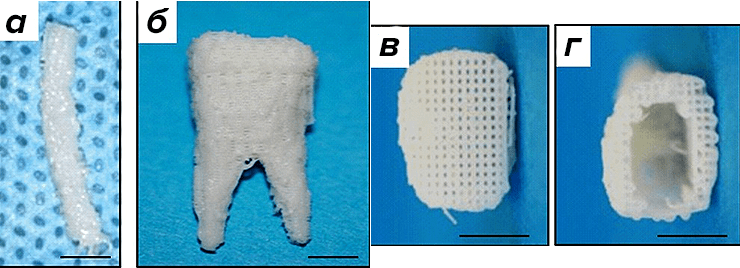
Рисунок 8. Трехмерный скаффолд зубов мыши и человека. а — Нижний центральный резец мыши. б — Нижний первый моляр человека. Использованы 3D-реконструкция и биопечать. Материал — гидроксиапатит и поликапролактон. Визуализируются микроканалы (d = 200 нм), в которые вводят МСК и факторы роста (в и г).
Самым подходящим и отвечающим на большинство требований скаффолдом является либо скаффолд, полученный из экстраклеточного матрикса (ЭКМ-скаффолд), либо его аналог. За счет своей идентичности с внеклеточным матриксом такие скаффолды способны обеспечить наилучшую взаимосвязь с клетками и ростовыми факторами. Дентальные МСК, такие как стволовые клетки пульпы и периодонта, при культивировании в ЭКМ-скаффолдах проходили дифференцировку в одонтогенном направлении. После имплантации же данного скаффолда формировалась пульпа [10], [23].
Помимо скаффолда и стволовых клеток, необходимо связывающее их звено, которое бы регулировало рост ткани. Таковым могут быть факторы роста, определенные гены и интерферирующие РНК [7].
Факторы роста — пептидные молекулы, передающие сигналы для управления клеточным поведением и взаимодействующие со специфическими рецепторами на поверхности клеток [24]. Они обеспечивают взаимосвязь и взаимодействие между клетками и экстраклеточным матриксом. Вслед за повреждением клетки начинается секреция ростовых факторов, запускающих в дальнейшем процессы регенерации и ангиогенеза. Примером «работы» факторов роста в зубе можно назвать образование вторичного и третичного дентина, которое происходит при близком расположении кариозной полости к пульпе зуба либо при повышенной стираемости зубов. Среди ключевых факторов роста во время развития зуба можно выделить костный морфогенетический белок (BMP), тромбоцитарный фактор роста (PDGF) и фактор роста фибробластов (FGF). Именно их в первую очередь используют в тканевой инженерии зуба [25–27]. Для доставки факторов роста могут использовать как клетки и наночастицы, так и сам скаффолд.
Рецепт готов
Вот и всё, если кратко, что необходимо для создания зубов. Таким образом, рецепт по созданию зуба выглядит примерно так:
Технологии регенеративной медицины прогрессируют невероятно быстро. И уже сейчас разработаны, наверное, самые основные положения для тканевой инженерии зуба. Все они происходят из наших знаний о клеточных и молекулярных основах развития зуба. Мы понимаем, что наилучшего результата в биоинжениринге зуба можно достичь только в присутствии двух типов клеток, а не одного: это и клетки эпителия, и мезенхимальные клетки (куда же без них?) [28]. Однако на одних клетках зуб не построишь. Таким образом, здесь нельзя исключать роль факторов роста и внеклеточного матрикса. К счастью, наука не стоит на месте, и новые положения активно разрабатывают. Возможно, в ближайшее время копилка знаний под названием «тканевая инженерия зуба» пополнится очередной не менее ценной «монетой».
Но, несмотря на весь многообещающий потенциал тканевой инженерии в стоматологии, предстоит решить еще задачи, связанные с проведением клинических испытаний, с иннервацией и кровоснабжением биоинженерного зуба, его связочным аппаратом, сроками его прорезывания, а также с выбором пула стволовых клеток и технологии работы с ними, и еще ряд других не менее насущных задач [10], [29].
Что касается самого основного, а именно стволовых клеток: в проведенных экспериментах (стоит отметить, что практически все они проведены на мышах), в основном, использовали эмбриональные стволовые клетки. Но в клинике их применение резко лимитировано, в том числе законодательно. Поэтому остаются только постнатальные стволовые клетки (не считая ИПСК, где тоже не все спокойно), и здесь перед нами возникает следующая загвоздка: в отличие от мышей, у человека отсутствует ниша дентальных стволовых клеток, именно поэтому наши зубы не имеют способности к постоянному росту. Те МСК, которые пригодны для использования, нельзя получить без повреждения зуба или уж тем более в том случае, если зуб ранее лечили эндодонтически, то есть с удалением пульпы. Те же, к которым доступ открыт, не обладают одонтогенной компетентностью, например, МСК десны. Это только одна из дилемм, которые еще предстоит решить (рис.9).
Рисунок 9. Борьба за здоровые зубы человечества.
Вперед в будущее!
Конечно же, не вызывает сомнения тот факт, что в скором времени биоинжениринг зубов станет неотъемлемой частью стандартных протоколов лечения поражений зубов. Возможно, что методики регенеративной стоматологии позволят нам создать полноценный зубодесневой комплекс. Важно помнить, что методы, разработанные в соответствии с требованиями и задачами биоинженерии зуба, смогут подстегнуть развитие новых подходов в регенерации других тканей и органов и таким образом поспособствовать прогрессу не только в стоматологии, но и в области регенеративной медицины в целом. Ну что ж, вперед в будущее!