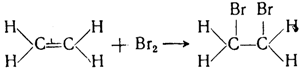какие углеводороды называются непредельными
Какие углеводороды называются непредельными
г) гидрогалогенирование (гидрохлорирование):
Присоединение молекул галогеноводородов протекает по правилу Марковникова (водород присоединяется к наиболее гидрогенизированному атому углерода).
4. Качественные реакции на алкены: обесцвечивание бромной воды (см. уравнение 2 б ) и раствора перманганата калия
Алкины – это непредельные углеводороды, в молекулах которых есть одна тройная связь между атомами углерода
Физические свойства алкинов
Химические свойства алкинов
В этой реакции температура пламени может достигать 3000 o С, поэтому она применяется для сварки металлов.
в) гидрогалогенирование (первая стадия):
CH CH + HCl CH 2 = CHCl
г) гидратация (реакция Кучерова):
ацетальдегид
(уксусный альдегид)
5. Качественные реакции на алкины: обесцвечивание бромной воды (см. реакцию 2 б ) и раствора перманганата калия; образование осадка ацетиленида серебра (см. реакцию 4).
Алкадиены – это непредельные углеводороды, в молекулах которых есть две двойные связи между атомами углерода
Физические свойства алкадиенов
Химические свойства алкадиенов
Такой же состав, как полиизопрен, (C5H8)n – имеет и природный полимер − натуральный каучук.
Алкадиены, как алкены и алкины, обесцвечивают бромную воду (реакция 2 б ) и раствор перманганата калия.
Получение непредельных углеводородов
Алгоритм составления названий непредельных углеводородов
Непредельные углеводороды
Непредельными называются углеводороды, в молекулах которых имеются двойные или тройные связи между атомами углерода. Простейшими представителями их являются этилен и ацетилен:
Этилен С2Н4 представляет собой бесцветный газ со слабым приятным запахом, довольно хорошо растворимый в воде. На воздухе он горит слегка светящим пламенем. Сжигаемый в специальных горелках, он служит для получения высоких температур.
Этилен является весьма важным сырьем для получения ряда синтетических продуктов. Применение этилена основано на его высокой химической активности, выражающейся в способности к реакциям присоединения. Двойная связь в молекулах этилена при действии различных веществ довольно легко разрывается, остается простая связь, а за счет освободившихся валентностей происходит присоединение новых атомов или атомных групп. Так, например, этилен легко присоединяет бром по месту двойной связи, переходя в насыщенное соединение дибромэтан С2Н4Вr:
Реакции присоединения характерны для всех углеводородов, имеющих двойные и тройные связи в молекулах.
Молекулы этилена обладают свойством не только присоединять к себе другие атомы или группы атомов, но и соединяться с себе подобными. Такой процесс происходит, например, если сильно сжать этилен (выше 1000 ат) и нагреть до 200°. В этих условиях молекулы этилена соединяются друг с другом, как это показано на следующей схеме:
Реакцию можно представить как результат раскрытия двойных связей в большом числе молекул этилена и последующего соединения образовавшихся частиц со свободными валентностями (двухвалентных радикалов) в одну гигантскую молекулу.
Реакция соединения нескольких молекул в одну большую, происходящая только за счет соединения по месту двойных или тройных связей, называется полимеризацией, а продукт этой реакции — полимером.
Полимер этилена называется полиэтиленом. Это белое твердое вещество, стойкое к действию концентрированных кислот и щелочей. Полиэтилен обладает высокими механическими и электроизоляционными свойствами, что позволяет широко использовать его в электро- и радиопромышленности, а также для изготовления труб, листовых материалов, различных изделий технического и бытового назначения. Пленки из полиэтилена отличаются исключительной газо- и влагонепроницаемостью.
Реакции полимеризации различных соединений, содержащих кратные связи, широко применяются в химической промышленности для получения разнообразных синтетических продуктов — пластических масс, химических волокон, синтетических каучуков и т. д.
Этилен является первым членом ряда этиленовых углеводородов, или олефинов. Следующие члены этого ряда — пропилен С3Н6, бутилен С4Н8 и т. д.
Главным источником получения этилена и его гомологов слу-жат газы крекинга нефтяных продуктов. Крекингом называют процесс расщепления больших молекул углеводородов на мелкие молекулы, проходящий при нагревании предельных углеводородов до 400—500° при повышенном давлении. Например:
Крекинг нефтяных продуктов позволяет получать низко-кипящие углеводороды (например, бензин) из углеводородов с высокой температурой кипения. При крекинге наряду с предельными углеводородами всегда получаются и непредельные.
Непредельные углеводороды, образующиеся при крекинге, а также в значительных количествах содержащиеся в попутных газах нефтедобычи, находят все более широкое использование в промышленности органического синтеза в качестве сырья для производства пластических масс, химических волокон, синтетических спиртов, различных каучукоподобных материалов, моющих средств, растворителей и других ценных продуктов.
Весьма важным непредельным углеводородом, молекулы которого содержат большое число двойных связей, является каучук. Состав молекулы каучука может быть выражен формулой (C5H8)х, где величина х составляет от 1000 до 3000.
Каучук является полимером углеводорода изопрена:
Как видно из этой схемы, при полимеризации изопрена происходит перемещение двойной связи.
Каучук содержится в млечном соке некоторых растений.
Другой природный продукт — гуттаперча также является полимером изопрена, но с иной конфигурацией молекул.
Сырой каучук липок, недостаточно прочен, а при небольшом понижении температуры становится хрупким. Чтобы придать изготовленным из каучука изделиям необходимую прочность и эластичность, проводят вулканизацию (нагревание с серой). Вулканизованный каучук называется резиной.
Отсутствие в нашей стране природного каучука вызвало необходимость в разработке метода искусственного получения этого важнейшего для народного хозяйства материала. Советскими химиками был найден и впервые в мире осуществлен в промышленном масштабе способ получения синтетического каучука.
По способу, предложенному Сергеем Васильевичем Лебедевым (1874—1934), исходным материалом для производства синтетического каучука служит непредельный углеводород бутадиен СН2 = СН—СН = СН2, который получается из спирта, а также из нефтяного бутана. Полимеризация бутадиена приводит к образованию синтетического бутадиенового каучука:
бутадиен синтетический, каучук
В настоящее время наша промышленность производит много различных видов синтетических каучуков, превосходящих по некоторым свойствам природный каучук.
Ацетилен С2Н2. Наиболее важным из углеводородов, в молекулах которых имеется тройная связь, является ацетилен Н—С ≡ С—Н, представляющий собой бесцветный газ, получаемый действием воды на карбид кальция:
а также крекингом в определенных условиях метана и других предельных углеводородов.
Так как ацетилен принадлежит к числу эндотермических соединений, при его горении выделяется большое количество тепла. Это позволяет использовать ацетилен для автогенной сварки металлов.
Ацетилен вступает в разнообразные реакции — присоединения, полимеризации и другие. На основе использования ацетилена в качестве исходного сырья в настоящее время широко развернуты промышленные синтезы таких важнейших продуктов, как уксусная кислота, синтетический каучук, пластмассы, различные растворители и пр.
В области непредельных, а особенно ацетиленовых углеводородов, большое теоретическое и практическое значение имеют исследования, проведенные Алексеем Евграфовичем Фаворским (1860—1945) и его учениками. Фаворский открыл большое число различных группировок молекул при химических реакциях и показал, как можно управлять этими процессами.
Вы читаете, статья на тему Непредельные углеводороды
Похожие страницы:
Понравилась статья поделись ей
Ненасыщенные углеводороды
Алкины (ацетиленовые углеводороды)
Алкины – это углеводороды, в молекулах которых два атома углерода находятся в состоянии sp-гибридизации и связаны друг с другом тройной связью.
Особенности алкинов: 1) длина связи в алкинах равна 0,120 нм; 2) каждый атом углерода в состоянии sp-гибридизации связан с двумя другими атомами; 3) может присоединять еще два атома.
Существует два типа изомерии алкинов: 1) изомерия положения тройной связи; 2) изомерия цепи.
Первые два члена гомологического ряда – этин и пропин – изомеров не имеют.
Для бутинов возможен только один вид изомерии – изомерия положения тройной связи.
Существует два типа номенклатуры: 1) международная номенклатура: этин; пропин; 2) рациональная номенклатура: ацетилен; метиацетилен.
Физические свойства алкинов: 1) С2Н2…С4Н6 – газы; 2) С5Н8…С15Н28 – жидкости; 3) С16Н30… – твердые вещества; 4) плохо растворимы в воде.
Химические свойства алкинов: обладают большой реакционной способностью, характеризуются реакцией присоединения, тройная связь содержит две π-связи.
Реакции присоединения:
1) присоединение водорода (гидрирование). На I ступени образуются алкены, на II ступени – алканы.
2) присоединение галогенов (галогенирование). HC ≡ CH + HCl → CH2 = CHCl → CH3 – CHCl2;
На I ступени образуются дигалогеналкены, на II – тетрагалогеналканы.
Реакция алкинов с бромной водой – качественная реакция на алкины. Бромная вода обесцвечивается;
3) присоединение галогеноводородов (гидрогалогенирование).
На I ступени образуются моногалогеналкены, на II – дигалогеналканы;
4) присоединение воды (гидратация).
Ацетилен образует альдегид, его гомологи – кетоны (реакция М.Г. Кучерова)
Реакция окисления: 1) горение (полное окисление): 2С2Н2 + 5O2 → 4СO2 + 2Н2О; 2) неполное окисление (под действием окислителя типа КМnO4, К2Сr2О7).
При действии сильных окислителей (КМnO4 в нейтральной среде, К2Сr2О7 в кислотной среде) алкины окисляются с разрывом молекулы по тройной связи (кроме ацетилена).
Конечным продуктом реакции являются карбоновые кислоты: СН3 – С ≡ С – СН3 + 3[О] + Н2О → 2СН3 – СООН – этановая (уксусная) кислота.
При неполном окислении ацетилена образуется двухосновная щавелевая кислота: СН ≡ Н + 4[О] → НООС – СООН.
Непредельные (ненасыщенные) углеводороды
Непредельные углеводороды – это углеводороды, в молекулах которых имеются атомы углерода, которые связаны между собой двойными или тройными связями.
Ненасыщенные углеводороды – это углеводороды, молекулы которых имеют меньшее число атомов водорода, чем насыщенные.
Особенности непредельных углеводородов:
1) первыми представителями гомологических рядов непредельных углеводородов являются этилен (с двойной связью) и ацетилен (с тройной связью);
2) двойная связь состоит из одной δ-связи и одной π-связи;
3) по своей природе π-связь резко отличается от δ-связи. Основные отличия π-связи от δ-связи:
а) π-связь менее прочная при перекрывании электронных облаков вне плоскости молекулы;
б) двойная связь изображается двумя одинаковыми черточками, но при этом учитывается их неравноценность;
4) тройная связь состоит из одной δ-связи и двух π-связей.
Особенность тройной связи ацетилена и его гомологов: из электронного строения видно, что кратные связи (двойные и тройные) сравнительно легко (легче, чем одинарные) разрываются при химическом взаимодействии.
Гомологические ряды непредельных углеводородов и их особенности:
1) соединения гомологического ряда этилена выражаются общей формулой СnН2n;
Общее международное название этиленовых углеводородов – алкены.
Олефины – это непредельные углеводороды ряда этилена, которые содержат одну двойную связь;
4) гомологический ряд ацетилена выражается формулой \(C_nH_<2n-n>\) ;
5) название ацетиленовых углеводородов по заместительной номенклатуре производятся от названий предельных углеводородов при замене окончаний -ан на -ин.
Алкины – это общее название ацетиленовых углеводородов по заместительной номенклатуре.
Важным источником получения этилена и его гомологов служат газообразные и жидкие продукты крекинга углеводородов нефти.
Крекинг – это процесс расщепления углеводородов с длинными цепями на молекулы меньшей длины.
При крекинге наряду с предельными углеводородами всегда получаются и непредельные, которые образуются при крекинге, а также получаются дегидрированием предельных углеводородов, содержащихся в попутных газах нефтедобычи.
Этилен и его гомологи
Особенности строения этилена: 1) это бесцветный газ; 2) немного легче воздуха; 3) почти не имеет запаха; 4) плотность этилена при нормальных условиях – \(1,25
г/л\) ; 5) молярная масса газа – \(1,25
г/моль\) ; 6) относительная молекулярная масса этилена – \(28
г/моль\) ; 7) не может иметь более двух атомов водорода; 8) молекулярная формула этилена – С2Н4; 9) в его молекуле атомы углерода соединены с меньшим числом атомов водорода, чем в молекуле этана; 10) атомы соединяются в соответствии с валентностью; 11) молекула этилена симметрична, т. е. каждый атом углерода в ней связан с двумя атомами водорода. Четвертые единицы валентности атомов углерода не могут оставаться свободными, они соединяются друг с другом, образуя вторую связь между атомами углерода; 12) в молекуле этилена устанавливается двойная связь. Каждая валентность атома углерода обусловливается наличием неспаренного электрона в его наружном электронном слое; 13) в молекуле этилена сохраняется четырехвалентность углерода и правило электронного октета для его атомов.
Особенности sр 2 -гибридизации:
1) гибридные облака принимают одинаковую форму несимметричных, вытянутых в одну сторону объемных восьмерок;
2) при образовании химических связей они расходятся на наибольшее удаление друг от друга – это достигается тогда, когда угол между их осями будет составлять 120°;
3) у атомов углерода остается еще по одному р-электрону.
Облако этого электрона не затронуто гибридизацией, оно не изменило своей формы и также имеет вид объемной восьмерки с равномерным распределением электронной плотности по обе стороны ядра;
4) оси электронных облаков перпендикулярны плоскости атомных ядер и оказываются наиболее удаленными от электронных облаков, которые участвуют в образовании химических связей.
Сигма-связь – это первая, более прочная связь, которая образуется при перекрывании электронных облаков в направлении прямой, соединяющей центры атомов.
Сигма-связь – это обычные ковалентные связи атомов углерода с атомами водорода.
Молекулы предельных углеводородов содержат только сигма-связи.
Пи-связь – это менее прочная связь, которая образуется при перекрывании электронных облаков вне плоскости атомных ядер.
Электроны π-связи и δ-связи теряют свою принадлежность к определенному атому.
Особенности δ-связи и π-связи:
1) вращение атомов углерода в молекуле возможно в случае, если они соединены δ-связью;
2) появление π-связи лишает атомы углерода в молекуле свободного вращения.
Строение и номенклатура углеводородов ряда этилена
Строение углеводородов: 1) этилен – первый представитель гомологического ряда веществ, в молекулах которых имеется двойная связь между атомами углерода; 2) ближайшие гомологи этилена – пропилен и бутилен; 3) названия углеводородов ряда этилена образуются путем изменения суффикса -ан соответствующего предельного углеводорода на – илен (этилен, пропилен и т. д.).
Реакция присоединения, характерная для всех алкенов:
1. Присоединение водорода.
Эта реакция протекает в присутствии катализатора – мелко раздробленного никеля, платины или палладия – при комнатной температуре.
Реакция гидрирования, или гидрогенизация, – это присоединение водорода к веществу.
При гидрогенизации олефины превращаются в предельные углеводороды.
2. Присоединение галогенов.
Реакция протекает при обычных условиях.
Дихлорэтан – это жидкость, которая хорошо растворяет органические вещества.
Реакция присоединения брома служит качественной реакцией на непредельные углеводороды.
3. Присоединение галогеноводородов.
Галогенопроизводные углеводороды можно получить двумя путями:
1) присоединение к этилену хлороводорода;
2) замещение водорода в этане на хлор.
4. Присоединение воды.
Реакция протекает в присутствии катализатора – серной кислоты.
Сначала происходит присоединение серной кислоты к этилену по месту разрыва двойной связи с образованием этилсерной кислоты.
Затем этилсерная кислота при взаимодействии с водой образует спирт и кислоту.
Реакция присоединения воды к этилену в присутствии твердых катализаторов используется для промышленного получения этилового спирта из непредельных углеводородов, которые содержатся в газах крекинга нефти (попутных газах), а также в коксовых газах.
Важным химическим свойством этилена и его гомологов является способность легко окисляться при обычной температуре.
При этом окислению подвергаются оба атома углерода, соединенные двойной связью.
Этилен горит светящимся пламенем с образованием оксида углерода и воды: С2Н4 + 3O2 → 2СO2 + 2Н2О.
Химические свойства углеводородов ряда этилена.
В результате этой реакции происходит насыщение атомов углерода водородными атомами до предела.
Реакции гидрирования – это реакции, в которых происходит присоединение водорода к веществу.
Правило Марковникова.
При ионном присоединении галогеноводорода к двойной углерод-углеродной связи несимметричного алкена водород присоединяется к тому атому углерода при двойной связи, с которым соединено больше водородных атомов, а атом галогена – к тому атому углерода, где их меньше.
Влиянием метильного радикала на двойную связь и обусловливается тот факт, что присоединение идет не произвольно, а в определенном направлении.
Атом углерода смещает в свою сторону электронную плотность связей с атомами водорода и приобретает частичный отрицательный заряд. Электронная плотность связи радикала с соседним атомом углерода смещается в сторону последнего, а это образует смещение весьма подвижного облака π-связи к крайнему атому углерода.
Применение и получение этиленовых углеводородов
Применение углеводородов:
1) благодаря высокой химической активности углеводороды ряда этилена являются ценным сырьем для синтеза многих органических веществ;
2) этиленовые углеводороды не используются в качестве горючего;
3) особенно широко этилен используется для получения органических веществ;
4) этилен применяется для получения этилового спирта, полиэтилена. Он ускоряет созревание плодов (помидоров, цитрусовых и др.) при введении небольших количеств его в воздух теплиц. Этилен и его гомологи используются как химическое сырье для синтеза многих органических веществ;
5) при взаимодействии этилена с хлором получается 1,2-дихлорэтан.
Особенности дихлорэтана: а) это летучая, трудновоспламеняющаяся жидкость; б) используется для растворения смол; в) используется для очистки текстильных материалов; г) применяется в сельском хозяйстве для обеззараживания зернохранилищ; д) используется в борьбе с филлоксерой винограда;
6) при присоединении хлороводорода к этилену получается хлорэтан.
Особенности хлорэтана: а) это газ, который легко превращается в жидкость; б) если налить небольшое количество хлорэтана на руку, произойдет быстрое испарение жидкости и сильное местное охлаждение; в) используется в медицине для замораживания; г) используется в медицине для местной анестезии – при легких операциях;
7) присоединение воды к этилену лежит в основе производства этанола (этилового спирта);
8) при полимеризации этилена и пропилена получаются широко применяемые в технике и быту полиэтилен и полипропилен;
9) в практическом применении этилен ускоряет созревание плодов (помидоров, груш, дынь, лимонов и др.);
10) для лучшего хранения плоды транспортируются неспелыми и доводятся до созревания на месте, путем ввода небольшого количества этилена в воздух закрытых хранилищ.
Получение углеводородов:
1) углеводороды ряда этилена химически активны;
2) в промышленности эти углеводороды получаются: а) при переработке нефтепродуктов путем высокотемпературного разложения; б) путем дегидрирования предельных углеводородов. Дегидрирование – это отщепление водорода от предельных углеводородов. Например: а) этан → этилен; б) изобутан → изобутилен. Приставка де– означает отделение чего-либо. Реакция дегидрирования обратима;
3) в лаборатории непредельные углеводороды получаются различными способами, например этилен получается из этилового спирта путем отщепления воды при нагревании с серной кислотой.
Реакция полимеризации. Полиэтилен
Особенности реакции полимеризации:
1) полимеризация – это последовательное соединение одинаковых молекул в более крупные;
2) реакции полимеризации особенно характерны для непредельных соединений:
а) из этилена образуется высокомолекулярное вещество – полиэтилен;
б) соединение молекул этилена происходит по месту разрыва двойной связи:
Сокращенно уравнение этой реакции записывается так:
\(nCH_2=CH_2 \rightarrow (-CH_2-CH_2^-)_n\) ;
3) к концам таких молекул (макромолекул) присоединяются какие-нибудь свободные атомы или радикалы (например, атомы водорода из этилена);
4) продукт реакции полимеризации называется полимером (от греческого поли – много, мерос – часть);
5) исходное вещество, которое вступает в реакцию полимеризации, называется мономером.
Особенности полимера.
1. Полимер – это соединение с высокой молекулярной массой, молекула которого состоит из большого числа повторяющихся группировок, которые имеют одинаковое строение.
2. Эти группировки называются элементарными звеньями и структурными единицами.
Степень полимеризации (обозначается n) – это число элементарных звеньев, которые повторяются в макромолекуле.
В зависимости от степени полимеризации из одних и тех же мономеров можно получать вещества с различными свойствами.
Особенности степени полимеризации:
а) полиэтилен с короткими цепями (n = 20) является жидкостью, обладающей смазочными свойствами;
б) полиэтилен с длиной цепи в 1500–2000 звеньев представляет собой твердый, но гибкий пластический материал, из которого можно получать пленки, изготовлять бутылки;
в) полиэтилен с длиной цепи 5–6 тыс. звеньев является твердым веществом, из которого можно готовить литые изделия, жесткие трубы, прочные нити.
Условия протекания реакций полимеризации весьма различны:
1) в некоторых случаях необходимы катализаторы и высокое давление;
2) главным фактором является строение молекулы мономера;
3) в реакцию полимеризации вступают непредельные (ненасыщенные) соединения за счет взрыва кратных связей.
В лабораторных условиях полиэтилен получают при нагревании этилового спирта с водоотнимающими веществами (концентрированной серной кислотой, оксидом фосфора (v) и другими): С2Н5ОН → СН2=СН2 + Н2О.
Ацетилен и его гомологи
Ацетилен – это непредельный углеводород, который содержит тройную связь, состоящую из одной δ-связи и двух π-связей.
Особенности строения:
1) первый представитель ряда ацетилена – бесцветный газ.
Особенности бесцветного газа:
а) немного растворим в воде;
б) его молекулярная формула С2Н2;
2) в молекуле ацетилена еще на два атома водорода меньше, чем в молекуле этилена;
3) π-связь уступает по прочности основной δ-связи, поэтому и по месту π-связей могут проходить реакции окисления и присоединения.
Структурная формула ацетилена: НС ≡ СН.
1) тройная связь в молекуле ацетилена означает, что атомы углерода в ней соединены тремя парами электронов;
2) исследования строения молекулы ацетилена показывают, что атомы углерода и водорода в молекуле ацетилена расположены на одной прямой;
3) молекула ацетилена имеет линейное строение;
4) атомы углерода соединены между собой одной δ-связью и двумя π-связями.
Особенности строения молекулы ацетилена:
1) в такой молекуле каждый атом углерода соединен δ-связями только с двумя другими атомами (атом углерода и атом водорода) и в гибридизации здесь участвуют лишь два электронных облака – одного s-электрона и одного р-электрона.
Это случай sр-гибридизации.
Суть состоит в том, что два гибридных облака, которые образуются в виде несимметричных объемных восьмерок, стремятся максимально удалиться друг от друга и устанавливают связи с другими атомами во взаимно противоположных направлениях под углом 180°;
2) облака двух других р-электронов не участвуют в гибридизации.
Они сохраняют форму симметричных объемных восьмерок и при боковом перекрывании с подобными облаками другого углеродного атома образуют две π-связи.
Гомологи ацетилена:
1) подобно метану и этилену, ацетилен начинает собой гомологический ряд;
2) это ряд ацетиленовых углеводородов с одной тройной связью между атомами углерода в молекуле;
3) согласно систематической номенклатуре название таких углеводородов образуются путем замены суффикса – ан соответствующих предельных углеводородов на – ин;
4) как и этиленовые углеводороды, атомы углерода нумеруются начиная с того конца, к которому ближе кратная (тройная) связь:
Особенности изомерии: а) обусловлена разветвлением углеродного скелета; б) характерное положение тройной связи; в) помогает в получении и использовании ацетилена в различных сферах.
Химические свойства ацетилена
1) ацетилен данного ряда углеводородов имеет большое практическое значение;
2) в отличие от метана и этилена, ацетилен горит ярким пламенем.
Примеры горения ацетилена: сварочные работы на стройках, в мастерских, на заводах.
Во всех этих случаях не видно образования копоти.
В данном случае: а) частички углерода сильно раскаляются в средней части пламени; б) придают ему яркость; в) в конечном итоге сгорают полностью.
При сварочных работах вместо воздуха используется кислород. При этом достигается полное сгорание ацетилена, возрастает температура пламени до 3000°C. Смеси ацетилена с воздухом и кислородом взрывоопасны;
3) π-связь уступает по прочности основной δ-связи;
4) по месту π-связей могут проходить реакции присоединения и окисления.
Если в цилиндр, заполненный ацетиленом, налить раствор перманганата калия, раствор быстро обесцветится;
5) ацетилен, как и этилен, легко окисляется;
6) из реакций присоединения для ацетилена характерно взаимодействие с бромом.
Две стадии реакции присоединения при взаимодействии ацетилена с бромом:
1) сначала бром присоединяется по месту одной π-связи и образуется 1,2-дибромэтен: СН = СН + Вr2 → ВrСН = СНВr;
2) затем присоединяется вторая молекула брома по второй π-связи, продуктом реакции является 1, 1, 2, 2 – тетрабромэтан: ВrСН = СНВr + Вг2 → Вr2СН – СНВr2;
3) в присутствии катализатора (платины, никеля) к ацетилену может присоединяться водород.
При этом ацетилен сперва превращается в этилен, а затем в этан.
4) при присоединении хлороводорода по одной из π-связей образуется газообразное вещество хлорэтен (хлорвинил). Катализатором данной реакции является хлорид ртути
5) присоединение воды (гидратация) происходит в присутствии катализатора Hg 2+ в кислой среде (реакция М.Г. Кучерова). При этом ацетилен образует ацетальдегид, а его гомологи – соответствующие кетоны.
Применение и получение ацетилена
Ацетилен – это один из наиболее значимых углеводородов с тройной связью. Он является первым представителем ряда ацетилена, а также бесцветным газом, который практически не растворим в воде. Молекула ацетилена имеет на два атома водорода меньше, чем в молекуле этилена, и при этом характерно образование третьей связи между атомами углерода.
Применение ацетилена:
1) может применяться в качестве горючего при газовой сварке и резке металлов;
2) используется также для синтеза различных органических соединений;
3) в результате присоединения хлора к ацетилену получают растворитель – 1, 1, 2, 2 – тетрахлорэтан. Путем дальнейшей переработки тетрахлорэтана получаются другие хлорпроизводные;
4) при отщеплении хлороводорода от 1,1,2,2-тетрахлорэтана образуется трихлорэтен – растворитель высокого качества, который широко применяется при чистке одежды: СНСI = ССI2;
5) в больших количествах ацетилен идет на производство хлорэтена, или винилхлорида, с помощью полимеризации которого получается поливинилхлорид (используется для изоляции проводов, изготовления плащей, искусственной кожи, труб и других продуктов);
6) из ацетилена получаются и другие полимеры, которые необходимы в производстве пластмасс, каучуков и синтетических волокон.
Получение ацетилена:
1) в лабораториях и промышленности ацетилен чаще всего получается карбидным способом. Если кусочки карбида кальция поместить в сосуд с водой или если воду добавлять к карбиду кальция, начинается сильное выделение ацетилена: СаС2 + 2НОН → С2Н2 + Са(ОН)2. Со стороны промышленности полимерных материалов карбидный способ является малоэффективным. Он связан с большими затратами электроэнергии на получение карбида кальция.
Особенности карбида кальция:
а) карбид кальция получают в электропечах;
б) получается при взаимодействии извести с углеродом (коксом, антрацитом);
в) получается при температуре 2000°C : СаО + 3С → СаС2 + СО;
2) применяется способ получения ацетилена из более доступного химического сырья – природного газа (метана).
в) одной из характерных черт получения ацетилена из метана являются две идеи:
– выделить его на промежуточной стадии;
– не дать ацетилену возможности разложиться на углерод и водород.
Для этого образующийся ацетилен необходимо быстро удалить из зоны высокой температуры и охладить.
Диеновые углеводороды
Строение и номенклатура.
Диеновые углеводороды – это углеводороды с двумя двойными связями.
Алкадиены, в молекулах которых две двойных связи разделены одной простой связью, называются соединениями с сопряженными двойными связями (дивинил и его гомологи).
СН2 = СН – СН = СН2 бутадиен – 1,3 (дивинил).
Алкадиены, в молекулах которых две двойных связи примыкают к одному углеродному атому, называются углеводородами с кумулированными двойными связями (аллен и его гомологи):
СН2 = С = СН2 пропадиен – 1,2 (аллен);
R – СН = С = СН2 алкилаллены.
Углеводороды, в молекулах которых две двойных связи разделены двумя и более простыми связями, называются алкадиенами с изолированными двойными связями.
Химические свойства диеновых углеводородов.
Имея двойные связи в молекулах, диеновые углеводороды вступают в обычные реакции присоединения.
Например: а) обесцвечивают бромную воду; б) присоединяют галогеноводороды.
Продуктом полимеризации 2-метилбутадиена-1,3 (изопрена) является природный каучук.
Каучук и его свойства. Вулканизация каучука
Основные способы получения каучука в природе:
1) каучук получается из млечного сока некоторых растений, преимущественно гевеи, родина которой – Бразилия;
2) для получения каучука на деревьях гевеи делаются надрезы;
3) млечный сок, который выделяется из надрезов и представляет собой коллоидный раствор каучука, собирается;
4) после этого он подвергается коагуляции действием электролита (раствор кислоты) или нагреванием;
5) в результате коагуляции выделяется каучук.
Основные свойства каучука:
1) важнейшее свойство каучука – это его эластичность.
Эластичность – это свойство испытывать значительные упругие деформации при сравнительно небольшой действующей силе, например растягиваться, сжиматься, а затем восстанавливать прежнюю форму после прекращения действия силы;
2) ценным для практического использования свойством каучука является также непроницаемость для воды и газов.
В Европе изделия из каучука (калоши, непромокаемая одежда) стали распространяться с начала ХIХ в. Известный ученый Гудьир открыл способ вулканизации каучука – превращения его в резину путем нагревания с серой, что позволило получать прочную и упругую резину.
3) резина обладает еще лучшей эластичностью, в этом с ней не может сравниться никакой другой материал; она прочнее каучука и более устойчива к изменению температуры.
По своему значению в народном хозяйстве каучук стоит в одном ряду со сталью, нефтью, каменным углем.
Состав и строение натурального каучука: а) качественный анализ показыв
В результате реакции гидратации бутена образовалось 37 г спирта, выход которого составляет 50% от теоретического. Определите массу бутена.
Во сколько раз тяжелее водорода (н. у.) алкин с 12 атомами водорода в молекуле?
Укажите общую формулу алкенов.
Относительная плотность по водороду этого вещества с общей формулой \(C_nH_<2n>\) непредельного ряда равна 28.
Алкен массой 5,6 г присоединяет 32 г брома. Общая молекулярная формула алкена
Какова масса образовавшегося 1,4-дибромбутена-2 в результате бромирования 108 г бутадиена-1,3?
К 7 г некоторого углеводорода присоединяется 16 г брома. Определите молекулярную формулу этого углеводорода ряда этилена.
Выберите наибольшую скорость реакцию получения пропиона.
Какая масса ацетилена требуется для получения бензола количеством вещества 1 моль, если массовая доля выхода составляет 30%?
У какого соединения возможна стереоизомерия?
Известно, что 8 г ацетиленового углеводорода полностью прореагировали с 8,96 л хлороводорода (н. у.). Определите молекулярную формулу этого углеводорода.
Какой объем (н. у.) пропилена затрачивается для синтеза одной макромолекулы полипропилена со средней молекулярной массой 84000? При этом степень полимеризации будет равна
Известно, что выделившийся при горении бутена углекислый газ взаимодействует с известковой водой и образуется 20 г осадка. Чему равна масса сгоревшего бутена (при н. у.)?
При обработке избытком воды 27,2 г смеси карбидов кальция и алюминия выделилось 11,2 л смеси газов. Чему равна объемная доля ацетилена в смеси?
Чему равно число σ-связей в молекуле бутина-2?
16,4 г ацетиленового углеводорода полностью прореагировали с 14,6 г хлороводорода. Определите молекулярную формулу этого углеводорода.
Чему равно число σ-связей в молекуле пропена?
6,8 г диенового углеводорода полностью прореагировали с 4,48 л бромоводорода (н. у.). Определите молекулярную формулу и название углеводорода.
Известно, что при сгорании 0,1 моль углеводорода выделилось 4,48 л углекислого газа и 0,1 моль воды. Определите молекулярную формулу вещества, если его плотность по водороду равна 13 (н. у.).
Для полного гидрирования 0,1 моль пропадиена необходим водород объемом (н.у.)
При обработке избытком воды 20,8 г смеси карбидов кальция и алюминия выделилось 8,96 л смеси газов. Чему равна объемная доля (н. у.) метана в смеси?
Сколько изомеров имеет \(C_5H_8\) внутри класса алкинов?
Какой реагент используют в качественной реакции для глюкозы?
К алкинам относятся
К алкенам относятся
К этилену относятся
Гомологами пентина являются
На хлорирование 126 г алкена израсходовали 67,2 л хлора. Найдите молекулярную массу алкена
Смесь этилена и ацетилена массой 53 г подвергли полному гидрированию, использовав 78,4 л водорода. Содержание этилена и ацетилена в смеси составляет
Изомерами п-ксилола являются
При взаимодействии пропена массой 63 г может быть образован
Для пропина характерны реакции
Сожгли смесь газа объемом 67,2 дм \(^3\) (н. у.), состоящую из этана и этилена в пропорции 1:1. Объем кислорода и воздуха, необходимые для горения смеси, составят
При сгорании вещества массой 2,1 г образовались оксид углерода (IV) массой 6,6 г и вода массой 2,7 г. Относительная плотность паров этого вещества по воздуху равна 5,862. Название соединения, соответствующее полученной молекулярной формуле
Какие свойства характерны для этилена?
Для алкинов характерным является
В молекулах 2-метилбутена-2 и пентин-3 гибридизация орбиталей углеродных атомов соответственно
Продукт взаимодействия 1 моль толуола с 3 молями азотной кислоты
С этиленом и ацетиленом взаимодействуют
Масса ацетилена, который получится при взаимодействии 71 г карбида кальция, содержащего 10% примесей, при условии, что выход продукта составил 80% к теоретическому