какие утверждения относительно строения молекулы бензола справедливы
Химия. 10 класс
§ 19. Ароматические углеводороды. Бензол, строение молекулы
Ароматические углеводороды. Бензол, строение молекулы
Название «ароматические соединения» возникло потому, что первые известные представители этого класса, полученные ещё в начале XIX века, обладали приятным запахом. Позднее оказалось, что большинство веществ, которые по строению и химическим свойствам принадлежат к этой же группе, не имеют приятного запаха. Однако исторически сложившееся общее название этих соединений сохранилось.
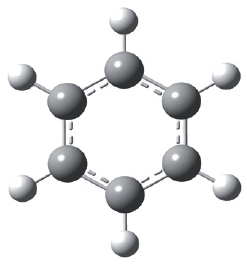
Простейшим представителем ароматических углеводородов является бензол. Его молекулярная формула C6H6.
Бензол — легкокипящая (tкип = 80 °С), бесцветная, нерастворимая в воде
жидкость с характерным запахом. При охлаждении бензол легко застывает в белую кристаллическую массу с температурой плавления 5,5 °С.
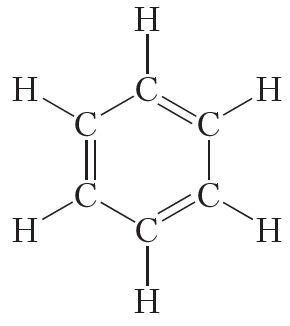
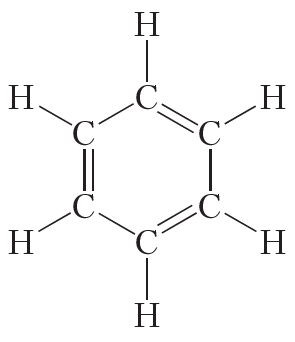
Открыл бензол великий английский физик Майкл Фарадей. В 1825 году ему удалось выделить бензол из каменноугольной смолы. Позже были установлены простейшая CH и молекулярная C6H6 формулы бензола. Однако долгое время не удавалось установить строение молекулы данного вещества. Через сорок лет после открытия бензола немецкий химик Август Кекуле сделал правильное предположение о циклическом строении молекулы бензола и предложил следующую структурную формулу:
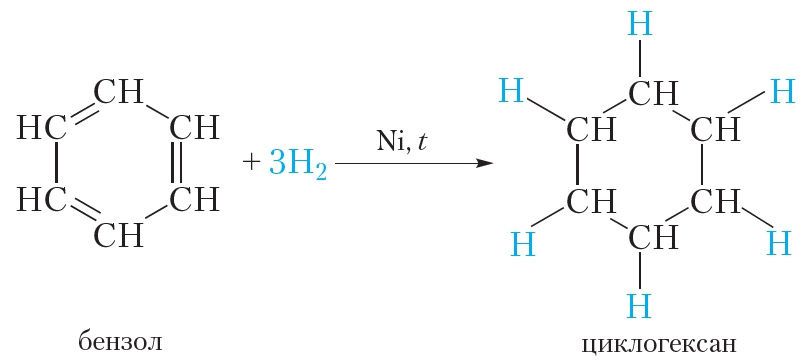
Представленная формула бензола называется формулой Кекуле. Формула Кекуле показывает, что молекула бензола имеет плоское строение, валентные углы равны 120°. Из формулы Кекуле также следует, что для гидрирования молекулы бензола до циклогексана требуются три молекулы водорода:
Все эти выводы подтверждаются экспериментальными данными. Однако формула Кекуле не объясняет ряд особых свойств бензола. Так, бензол не вступает в качественные реакции на двойную 
Кроме того, экспериментально установлено, что все связи углерод-углерод в молекуле бензола имеют одинаковую длину. Столь необычные свойства бензола удалось объяснить только в ХХ веке, используя современную теорию строения вещества.
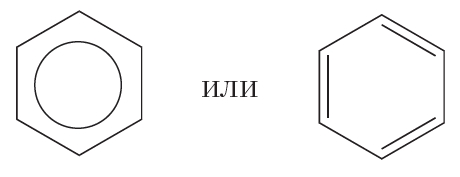
Из формулы Кекуле следует, что двойные связи в молекуле бензола являются сопряжёнными. На примере бутадиена-1,3 мы видели, что сопряжение ведёт к некоторому выравниванию длин двойных и одинарных связей. В молекуле бензола сопряжение настолько сильное, что длины всех связей углерод-углерод становятся одинаковыми:
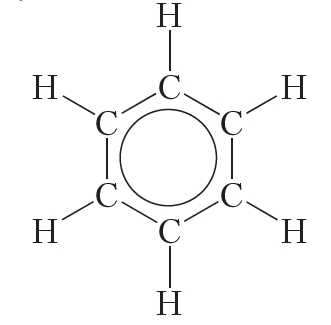
В данной формуле шестиугольник отображает σ-связи между атомами углерода, а окружность — систему π-связей.
Наряду с формулой бензола, в которой показана делокализация π-электронов, нередко пользуются формулой Кекуле, учитывая при этом, что она не совсем точно передаёт строение бензола:
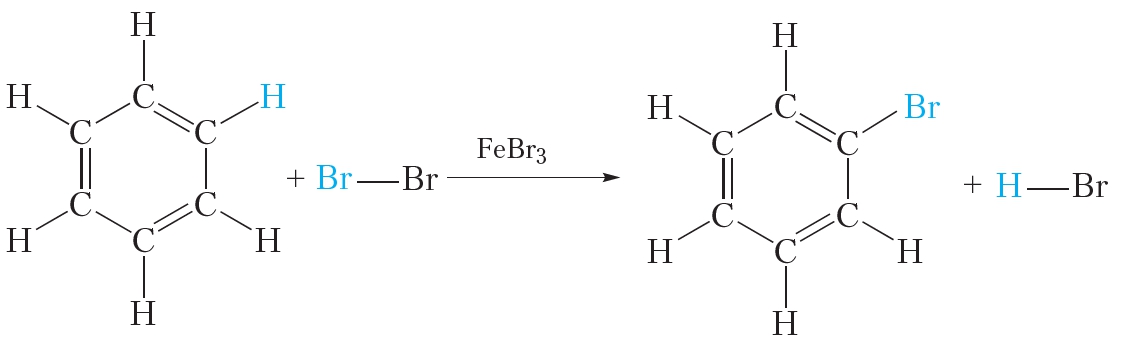
Делокализация π-электронов придаёт молекуле бензола дополнительную устойчивость. Поэтому для бензола характерны реакции, в которых сопряжённая система π-связей в молекуле сохраняется. Такими реакциями являются реакции замещения (см. уравнение реакции с бромом).
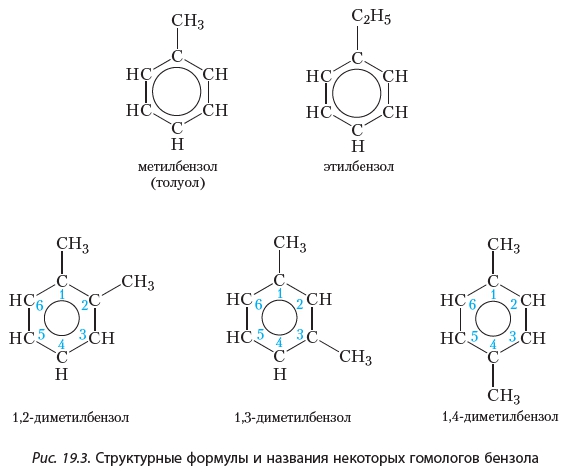
Как уже отмечалось, бензол является простейшим представителем ароматических углеводородов. Его гомологи могут рассматриваться как продукты замещения одного или нескольких атомов водорода в молекуле бензола на углеводородные радикалы. Формулы и названия некоторых гомологов бензола приведены на рисунке 19.3.
Как видно, для построения названий веществ, в молекулах которых с бензольным кольцом соединено несколько углеводородных радикалов, атомы углерода бензольного кольца нумеруют таким образом, чтобы заместители получили наименьшие номера, и при помощи цифр в названии указывают положение заместителей.
Бензол С6Н6 — простейший представитель класса ароматических углеводородов.
Молекула бензола имеет плоское строение, валентные углы равны 120°, длины всех связей углерод-углерод одинаковы.
π -Электроны в молекуле бензола делокализованы и образуют единую сопряжённую систему π -связей.
Сопряжённая система π -связей придаёт молекуле бензола повышенную устойчивость, поэтому для бензола характерны реакции, в которых сопряжённая система сохраняется.
Какие утверждения относительно строения молекулы бензола справедливы
ХИМИЯ – это область чудес, в ней скрыто счастье человечества,
величайшие завоевания разума будут сделаны
именно в этой области.(М. ГОРЬКИЙ)
Таблица
Менделеева
Универсальная таблица растворимости
Коллекция таблиц к урокам по химии
Бензол: электронное и пространственное строение, изомерия и номенклатура
На данном уроке будет рассмотрена тема «История развития представлений о строении бензола, его строение, понятие об ароматичности». Вы узнаете, как с течением времени менялись представления о строении бензола. Вы познакомитесь с новым понятием – ароматичность.
I. Характеристика аренов
История представлений о строении бензола
Ароматические углеводороды (aрены) – это органические соединения, в молекулах которых имеется одно или несколько бензольных колец.
Бензольное кольцо, или ядро, – циклическая группа атомов углерода с особым характером связей.
1865 г. – Август Кекуле (Рис. 1) предположил, что атомы углерода могут замыкаться в цикл.
1872 г. – Кекуле предложил гипотезу, согласно которой в бензольном кольце происходит непрерывный обмен местами простых и двойных связей:
Структурные формулы, соответствующие составу С6Н6
Современные представления о строении бензола
Появление физических методов анализа веществ и квантовомеханических подходов к описанию молекул позволило установить, что атомы углерода в молекуле бензола составляют плоский правильный шестиугольник; связи между всеми атомами углерода имеют равную длину – 0,14 нм, которая больше, чем длина двойной связи (0,132 нм), но меньше, чем длина простой связи (0,154 нм). Рис. 2.

Рис. 2. Молекула бензола
II. Строение бензола
Видео: “Строение молекулы бензола”
Все атомы углерода находятся в состоянии sp2-гибридизации. Рис. 2. Шесть π-электронов образуют общее электронное облако, которое принадлежит всем шести атомам углерода:
Рис. 3. Образование связей в молекуле бензола
Запомните!
В структурной формуле Кекуле – три одинарные и три двойные чередующиеся углерод-углеродные связи. Но такое изображение не передает истинного строения молекулы. В действительности углерод-углеродные связи в бензоле равноценны. Это объясняется электронным строением его молекулы.
Третья p-орбиталь атома углерода не участвует в гибридизации. Она имеет форму гантели и ориентирована перпендикулярно плоскости бензольного кольца. Такие p-орбитали соседних атомов С перекрываются над и под плоскостью кольца.
Рис. Негибридные 2p-орбитали углерода в молекуле бензола
Рис. Молекула бензола. Расположение π -электронного облака
В молекуле бензола они одинаковы и равны 0,139 нм. В случае простой и двойной связи эти расстояния составили бы соответственно 0,154 и 0,134 нм. Значит, в молекуле бензола нет чередования простых и двойных связей, а существует особая связь – “полуторная” – промежуточная между простой и двойной, так называемая ароматическая связь. Чтобы показать равномерное распределение p-электронного облака в молекуле бензола, корректнее изображать ее в виде правильного шестиугольника с окружностью внутри (окружность символизирует равноценность связей между атомами С):
Прочность связи между атомами углерода в цикле должна быть промежуточной между прочностью двойной и одинарной связи. Но связь между атомами С в бензольном кольце оказывается значительно прочнее! Поэтому соединения ряда бензола не вступают во многие реакции, характерные для непредельных соединений.
Ароматичность – способность циклической молекулы с системой сопряженных двойных связей образовывать единое p-электронное облако с увеличением стабильности молекулы.
На основе квантовомеханических расчетов Э. Хюккель сформулировал критерии ароматичности:
1. Молекула (или ее часть) должна быть циклической и плоской.
2. Она должна содержать сопряженные p-электроны. Это могут быть электроны двойных связей или неподеленных электронных пар атомов.
3. Число p-электронов должно быть равным 4n + 2, где n = 0,1,2… (правило Хюккеля)
III. Классификация аренов
1. Моноядерные
1. С6 H 6 – бензол, родоначальник гомологического ряда аренов ( Бензол – плоская циклическая система, содержащая 6 p-электронов (n = 1).
3. С6 H 5 – CH =С H 2 – стирол (винилбензол)
2. Многоядерные (конденсированные)
IV. Изомерия, номенклатура
Изомеров такого состава может быть очень много. Например:
Изомерия обусловлена изомерией углеродного скелета имеющихся радикалов и их взаимным положением в бензольном кольце. Положение двух заместителей указывают с помощью приставок: орто- (о-), если они находятся у соседних углеродных атомов (положение 1, 2-), мета- (м-) для разделенных одним атомом углерода (1, 3-) и пара-(п-) для находящихся напротив друг друга (1, 4-).
Например, для диметилбензола (ксилола):

мета-ксилол (1,3-диметилбензол)
Радикалы ароматических углеводородов называют арильными радикалами. Радикал С6Н5 — называется фенил.
Урок по химии на тему «ЭЛЕКТРОННОЕ И ПРОСТРАНСТВЕННОЕ СТРОЕНИЕ МОЛЕКУЛЫ БЕНЗОЛА» (10 класс)
Ищем педагогов в команду «Инфоурок»
Тема урока: «ЭЛЕКТРОННОЕ И ПРОСТРАНСТВЕННОЕ СТРОЕНИЕ МОЛЕКУЛЫ БЕНЗОЛА»
Тип урока: сообщение новых знаний с испльзованием исторического подхода
Вид урока: лекция + элементы беседы.
Систематизирующий материал: 

История Открытия Бензола
История Открытия Строения Молекулы Бензола
это наука с удивительным расцветом
Способствовать расширению у учащихся научных знаний о электронном и пространственном строении бензола;
Ознакомить учащихся с историческими сведениями о бензоле;
Формирование научно-теоретического мышления;
Изучение нового материла.
ИСТОРИЯ ОТКРЫТИЯ БЕНЗОЛА
Важнейший ароматический углеводород бензол C6H6
Впервые бензол описал немецкий ученый Иоганн Глаубер по профессии аптекарь в 1649 году, получив вещество перегонкой каменноугольной смолы.
ГЛАУБЕР (Glauber) Иоганн Рудольф
1604 г. – 10 марта 1670 г.
Открыт бензол был впервые в 1825 году Майклом Фарадеем.
В 1812 – 1815 годах в Лондоне впервые появилось газовое освещение. Светильный газ, добывавшийся из жира морских животных, доставлялся в железных баллонах. Эти баллоны помещались обычно в подвале дома, из них газ по трубкам распределялся по всему помещению. Вскоре было замечено крайне неприятное обстоятельство – в сильные холода газ терял способность давать при горении яркий свет. Владельцы газового завода в 1825 г. обратились за советом к Фарадею, который нашёл, что те составные части, которые способны гореть ярким пламенем, собираются на дне баллона в виде прозрачного жидкого слоя. Английский ученый заинтересовался странным явлением, происходившим со светильным газом.. Обнаружилось, однако, что при длительном хранении газ постепенно терял свои осветительные и тепловые свойства, а на дне баллона скапливалась жидкость, легко воспламеняющаяся. Ее то и исследовал Фарадей, а в результате выделил неизвестный углеводород, элементный состав, а так же физические и химические свойства которого попытался определить. На основании анализа он приписал ему формулу C2H, назвал двууглеродистым водородом и доложил об открытии нового вещества Лондонскому Королевскому обществу 16 июня 1825 года.
При исследовании этой жидкости Фарадей открыл новый углеводород – бензол.
.Некоторое время бензол не привлекал особого внимания химиков. В 1833-35 годах немецкий химик Эйльхард Митчерлих обстоятельно исследовал это вещество, В 1835 году, когда немец Эйльхард Митчерлих (1796-1863) нагрел негашеную известь CaO с бензойной кислотой C6H5COOH (она содержится во многих ягодах, в частности, в клюкве и бруснике, и препятствует их гниению) и получил неизвестную, легкокипящую жидкость с резким запахом. Вот тогда и вспомнили об открытии Фарадея. Он назвал его «бензином» (от арабского слова, которое означает благовоние).
Эйльхард МИЧЕРЛИХ (МИТЧЕРЛИХ)
ЛИБИХ (von Liebig), Иоганн Юстус фон
12 мая 1803 г. – 18 апреля 1873
ЛОРАН (Laurent), Огюст
14 ноября 1807 г. – 15 апреля 1853 г.
Структурная формула бензола была предложена в 1865 году Августом Кекуле. В результате синтеза бензол впервые был получен французским химиком Марселеном Бертло в 1866 году.
Пьер-Эжен-Марселен БЕРТЛО (Berthelot)
КЕКУЛЕ Фридрих Август
(Kekule F. A.)
Далее перехожу к изложению строения молекулы бензола.
В 1865 г. немецким учёным Кекуле была предложена структура молекулы бензола.
ИСТОРИЯ ОТКРЫТИЯ СТРОЕНИЯ МОЛЕКУЛЫ БЕНЗОЛА
Формулу бензола он привел в статье, опубликованной в мае 1865 года. Шесть атомов углерода образовывали замкнутую цепь и были связаны друг с другом попеременно то одной, то двумя связями (единицами сродства). По мнению ученого, такая формула позволяла изобразить строение всех соединений, относящихся к ароматическим.
В последствии Кекуле вспоминал, как у него возникло представление о строении бензола: Есть два мнения
1. «Я сидел и писал учебник, но работа не двигалась, мои мысли витали где-то далеко. Я повернул мой стул к огню и задремал. Атомы снова запрыгали перед моими глазами. На этот раз небольшие группы скромно держались на заднем плане. Мой умственный взгляд мог теперь различить длинные ряды, извивающиеся подобно обезьянам. Но смотрите! Одна из обезьян захватила своих хвостом хвост соседки и в таком виде, как бы дразня, завертелась перед моими глазами. Как будто вспышка молнии разбудила меня: и на этот раз я провел остаток ночи, разрабатывая следствие из гипотезы»
Немецкий химик Фридрих Август Кекуле утверждал, что приснившееся ему кольцо в форме уробороса
ДЬЮАР (Dewar), Джеймс
20 сентября 1842 г. – 27 марта 1923
ЛАДЕНБУРГ (Ladenburg), Альберт
2 июля 1842 г. – 15 августа 1911 г.
АРМСТРОНГ (Armstrong), Генри Эдуард
6 мая 1848 г. – 13 июля 1937 г.
БАЙЕР (Baeyer), Адольф фон
31 октября 1835 г. – 20 августа 1917 г.
Нобелевская премия по химии, 1905 г.

Но они не получали подтверждения. Дальнейшие экспериментальные обсуждения подтвердил правоту Кекуле
Но эта формула, соответствуя элементарному составу бензола, не отвечает многим его особенностям:
бензол не даёт качественных реакций на непредельность;
для бензола характерны реакции замещения, а не присоединения;
формула Кекуле не в состоянии объяснить равенства расстояний между углеродными атомами, что имеет место в реальной молекуле бензола.
Чтобы выйти из этого затруднения, Кекуле допустил, что в бензоле происходит непрерывное перемещение двойных связей.
ПОЛИНГ (Pauling), Лайнус Карл
28 февраля 1901 г. – 19 августа 1994 г.
Нобелевская премия по химии, 1954 г.
Нобелевская премия мира, 1962 г.
При этом оказывается, что энергия, вычисленная для этой комбинации, меньше энергии, вычисленной для каждого из частных состояний (вот почему делокализация электронов ведет к энергетическому выигрышу!
Иначе говоря, с точки зрения теории резонанса формулы Кекуле следует рассматривать как две из нескольких возможных структур реального бензола, и поэтому нет ничего удивительного в том, что вычисленная для них энергия образования оказывается меньше действительной.
Использование современных физических и квантовых методов исследования дало возможность создать исчерпывающее представление о строении бензола.
Атомы углерода в молекуле бензола находятся во втором валентном состоянии (sp 2 ). Каждый атом углерода образует 

Рис. 1. Схема образования 
в молекуле бензола
Каждый атом углерода имеет одну негибридную р-орбиталь. Шесть таких орбиталей располагаются перпендикулярно плоскости 


Рис 2. Негибридные 2p-орбитали
углерода в молекуле бензола
Рис 3. Молекула бензола.
Расположение 
В результате такого равномерного перекрывания 2р-орбиталей всех шести углеродных атомов
происходит “выравнивание” простых и двойных связей – длина связи составляет 0,139 нм. Эта величина является промежуточной между длиной одинарной связи в алканах (0,154 нм) и длиной двойной связи в алкенах (0,133 нм). То есть, в молекуле бензола отсутствуют классические двойные и одинарные связи.
Круговое сопряжение дает выигрыш в энергии 150 кДж/моль. Эта величина составляет энергию сопряжения – количество энергии, которое нужно затратить, чтобы нарушить ароматическую систему бензола.
Физические методы исследования показали:
Тип гибридизации атомов углерода
Правильный плоский шестиугольник
Такое электронное строение объясняет все особенности бензола.
В настоящее время нет единого способа графического изображения молекулы бензола с учётом его реальных свойств. Но, чтобы подчеркнуть выравненность 
Проверка усвоения темы урока
В конце урока провожу фронтальный опрос по вопросам:
Какое количество 

Какие связи в молекуле бензола локализованы?
Почему длина связи между атомами углерода в молекуле бензола является промежуточной между одинарной и двойной?
Какая из схем правильно показывает образование 
Объясните, какая схема верно отображает расположение