so4 что это сульфат
Сульфаты
Содержание
Свойства
Происхождение (генезис)
Образуются в условиях повышенной концентрации кислорода и при относительно низких температурах, то есть вблизи земной поверхности. Большей частью экзогенные, хемогенные (в месторождениях солей). Сульфаты Cu, Zn и других близких элементов образуются при разрушении сульфидов. В природе встречается 180 минералов сульфатов и на их долю приходится
Использование
Некоторые из сульфатов добывают для различных технических целей (гипс, барит и др.). для химической промышленности (мирабилит и др.), как руды Mg и др.
Качественные реакции
См. также
Литература
Ссылки
Примечания
Полезное
Смотреть что такое «Сульфаты» в других словарях:
СУЛЬФАТЫ — (ново лат., от sulfur сера). Серно кислые соли. Словарь иностранных слов, вошедших в состав русского языка. Чудинов А.Н., 1910. СУЛЬФАТЫ новолатинск., от sulfur, сера. Серноватистокислые соли. Объяснение 25000 иностранных слов, вошедших в… … Словарь иностранных слов русского языка
СУЛЬФАТЫ — соли или эфиры серной кислоты Н2SO4. Соли Средние (напр., К2SO4) и кислые, или гидросульфаты (КНSO4), кристаллы. Средние соли распространены в природе (см. Сульфаты природные). Эфиры диорганилсульфаты ROSO2OR и органилсульфаты ROSO2ОМ (R… … Большой Энциклопедический словарь
СУЛЬФАТЫ — СУЛЬФАТЫ, соли и эфиры серной кислоты H2SO4. Соли средние (например, K2SO4) и кислые, или гидросульфаты (KHSO4), кристаллы. Средние соли распространены в природе (например, гипс). Эфиры применяют в органическом синтезе, как растворители … Современная энциклопедия
СУЛЬФАТЫ — СУЛЬФАТЫ, ов, ед. сульфат, а, муж. (спец.). Соли серной кислоты. | прил. сульфатный, ая, ое. Толковый словарь Ожегова. С.И. Ожегов, Н.Ю. Шведова. 1949 1992 … Толковый словарь Ожегова
Сульфаты — СУЛЬФАТЫ, соли и эфиры серной кислоты H2SO4. Соли средние (например, K2SO4) и кислые, или гидросульфаты (KHSO4), кристаллы. Средние соли распространены в природе (например, гипс). Эфиры применяют в органическом синтезе, как растворители. … Иллюстрированный энциклопедический словарь
СУЛЬФАТЫ — соли серной кислоты H2S04, содержащие ион SO2 ; или ион HSO гидросульфаты, а также природные минералы (С. меди, цинка, железа, свинца и др.), образующиеся при разрушении (см.). Большинство С. (за исключением CaS04, SrS04 и BaS04) хорошо… … Большая политехническая энциклопедия
сульфаты — ов; мн. (ед. сульфат, а; м.). [от лат. sulphur сера] Хим. Соли серной кислоты. Природные с. (класс минералов). * * * сульфаты соли или эфиры серной кислоты H2SO4. Соли средние (например, K2SO4) и кислые, или гидросульфаты (KHSO4), кристаллы.… … Энциклопедический словарь
Сульфаты — (от лат. sulphur, sulfur сера) сернокислые соли, соли серной кислоты H2SO4. Имеются два ряда С. средние (нормальные) общей формулы Mg2SO4 и кислые (Гидросульфаты) MHSO4, где М одновалентный металл. С. кристаллические вещества,… … Большая советская энциклопедия
СУЛЬФАТЫ — соли или эфиры серной кислоты H2SO4. Соли средние (напр., K2SO4) и кислые, или гидросульфаты (KHSO4),кристаллы. Средние соли распространены в природе (см. Сульфаты природные). Эфиры диорганилсульфаты ROSC2OR и органилсульфаты ROSO2OM (R органич.… … Естествознание. Энциклопедический словарь
Соли кислот сульфаты. Состав. Минералы
Автор текста Анисимова Е.С. Из курса по химии. См. сначала файлы «Кислоты».
Авторские права защищены. При копировании и распространении обязательна ссылка на источник и страницу https://vk.com/bch_5
Соли кислот: сульфаты. Состав. Минералы.
Серная кислота (понятие)
1. В природе есть атомы разных типов (с разным числом протонов).
2. Есть такое сочетание атомов: два атома Н, один атом S и четыре атома О.
3. Сочетание из 2Н, одного атома S и четырёх атомов О записывают так: Н2SO4.
4. Н2SO4 – это формула молекулы.
5. Молекулы состава Н2SO4 называют молекулами серной кислоты.
6. Серная кислота – это вещество, молекулы которого имеют состав Н2SO4.
Соли серной кислоты
Калий вместо водорода
7. Если буквы Н в Н2SO4 поменять на буквы К, то получится К2SO4.
8. Два атома Н в Н2SO4 можно заменить двумя атомами К: К2SO4.
9. К2SO4 – это соль серной кислоты. (Не путать с пищевой солью!)
10. К – это атом калия.
11. К2SO4 – это калиевая соль серной кислоты.
12. К2SO4 – удобрение! Помогает сделать пищу и избежать голода людей!
13. К2SO4 даёт почве (и растениям) одновременно и серу, и калий, в которых растения нуждаются. Калийное удобрение.
14. 2Н в Н2SO4 можно заменить не атомами К, а атомами Na или другого металла – будут другие соли.
Натрий вместо Н
15. Два атома Н в Н2SO4 можно заменить двумя атомами Na: будет Na2SO4.
16. Na2SO4 – это натриевая соль серной кислоты.
17. В природе есть сочетание Na2SO4 и десяти молекул Н2О. Его формула: Na2SO4*10Н2О.
18. Na2SO4*10Н2О в природе называется минералом мирабилитом (глауберова соль).
Соли. Понятие.
19. Замена атомов Н на атомы металлов в молекуле кислоты превращает кислоту в соль.
20. Замена всех атомов Н кислоты на атомы металла даёт среднюю соль.
21. Соль – это продукт замены атомов Н на атомы металла в молекуле кислоты.
22. Соли серной кислоты называют сульфатами.
Сульфаты
23. Меняя атомы Н на атомы металлов в молекуле Н2SO4, мы получаем соли серной кислоты – сульфаты.
24. К2SO4 и Na2SO4 – сульфаты.
25. Соли серной кислоты называются сульфатами.
26. К2SO4 – это калиевая соль серной кислоты или сульфат калия.
27. Na2SO4 – это натриевая соль серной кислоты или сульфат натрия.
28. К2SO4 и Na2SO4 – примеры средних солей. (Без атомов Н).
Кальций вместо Н в Н2SO4 (сульфаты кальция)
29. Два атома Н можно заменить не двумя атомами К, а одним атомом кальция (Са).
30. Замена двух атомов Н одним атомом Са превращает Н2SO4 в СаSO4.
31. СаSO4 – это формула, она показывает состав молекулы вещества.
32. Вещество с формулой СаSO4 называется сульфатом кальция.
33. СаSO4 – это кальциевая соль серной кислоты или сульфат кальция.
Минералы сульфата кальция
34. Вещество СаSO4 в природе есть в виде минерала ангидрит.
35. Ангидрит – минерал, состоящий из молекул состава СаSO4.
Гидраты сульфата кальция
36. СаSO4 бывает связан с Н2О.
37. Соединения СаSO4 с водой называются гидратами СаSO4.
38. Гидраты СаSO4 – это сочетания СаSO4 и Н2О.
39. Если на две молекулы СаSO4 приходится одна молекула Н2О (полугидрат сульфата кальция), то минерал с таким составом называется алебастром.
40. Состав алебастра: СаSO4*0,5Н2О.
41. Схема образования алебастра (не реакция): 2СаSO4 + Н2О = 2(СаSO4*0,5Н2О)
42. Если на одну молекулу СаSO4 приходится две молекулы Н2О, то минерал с таким составом называется гипсом.
43. Состав гипса: СаSO4*2Н2О.
44. Схема образования гипса (не реакция): СаSO4 + 2Н2О = СаSO4*2Н2О.
45. Если смочить порошок алебастра – он соединится с водой и станет твёрдым (гипсом).
46. Гипс используют в медицине, в строительстве, в скульптуре.
Магний вместо Н в Н2SO4 (сульфат магния)
47. Два атома Н можно заменить не двумя атомами К, а одним атомом магния (Mg).
48. Замена двух атомов Н одним атомом Mg превращает Н2SO4 в MgSO4.
49. MgSO4 – это формула, она показывает состав молекулы вещества.
50. Вещество с формулой MgSO4 называется сульфатом магния.
51. MgSO4 – это магниевая соль серной кислоты или сульфат магния.
Гидраты сульфата магния
52. MgSO4 бывает связан с Н2О.
53. Соединения MgSO4 с водой называются гидратами MgSO4.
54. Гидраты MgSO4 – это сочетания MgSO4 и Н2О.
55. На одну молекулу MgSO4 приходится семь молекул Н2О: минерал с таким составом называется горькой или английской солью.
Медь (Cu) в Н2SO4 (сульфаты меди)
56. Два атома Н можно заменить не двумя атомами К, а одним атомом кальция меди (Сu).
57. Замена двух атомов Н одним атомом Сu превращает Н2SO4 в СuSO4.
58. СuSO4 – это формула, она показывает состав молекулы вещества.
59. Вещество с формулой СuSO4 называется сульфатом меди.
60. СuSO4 – это медная соль серной кислоты или сульфат меди.
Минералы сульфата меди
61. СuSO4 бывает связан с Н2О.
62. Соединения СuSO4 с водой называются гидратами СuSO4.
63. Гидраты СuSO4 – это сочетания СuSO4 и Н2О.
64. Про пять (пента) молекул Н2О говорят «пента гидрат».
65. Пентагидрат – это пять молекул воды.
66. Соединение одной молекулы СuSO4 и пяти молекул Н2О записывают так: СuSO4*5Н2О.
67. Соединение СuSO4 и пяти молекул Н2О (СuSO4*5Н2О) называется пентагидратом сульфата кальция.
68. Вещество с формулой СuSO4*5Н2О есть в природе в виде минерала.
69. Минерал состава СuSO4*5Н2О называют цианозитом или халькантитом.
70. Цианозит имеет синий цвет.
Железо (Fe) в FeSO4 (сульфат железа)
71. Два атома Н можно заменить не двумя атомами К, а одним атомом железа (Fe).
72. Замена двух атомов Н одним атомом Сu превращает Н2SO4 в FeSO4.
73. FeSO4 – это формула молекулы.
74. Формула FeSO4 показывает состав молекулы вещества.
75. Вещество с формулой FeSO4 называется сульфатом железа.
76. Сульфат железа FeSO4 – это соль серной кислоты. (Продукт замены Н в кислоте).
Минералы сульфата железа
77. Вещество с формулой FeSO4 есть в природе в виде минерала.
78. Минерал состава FeSO4 называют мелантеритом.
Стронций (Sr) в SrSO4 (сульфат стронция)
79. Два атома Н можно заменить не двумя атомами К, а одним атомом стронция (Sr).
80. Замена двух атомов Н одним атомом Sr превращает Н2SO4 в SrSO4.
81. SrSO4 – это формула молекулы.
82. Формула SrSO4 показывает состав молекулы вещества.
83. Вещество с формулой SrSO4 называется сульфатом стронция.
84. Сульфат стронция SrSO4 – это соль серной кислоты. (Продукт замены Н в кислоте).
Минералы сульфата стронция
85. Вещество с формулой SrSO4 есть в природе в виде минерала.
86. Минерал состава SrSO4 называют целестином.
87. Ищите картинки целестина!
Минералы сульфаты
88. Примеры минералов – рубин, песок, мел, мрамор, мирабилит, цианозит, целестин и т.д.
89. К минералам относят только твёрдые тела, только природного происхождения, с определённым химическим составом, неорганические.
90. Одна из групп минералов – это сульфаты разных металлов.
91. Минерал, который является сульфатом стронция – целестин.
92. Формула целестина – SrSO4.
93. Минерал, который является сульфатом железа – мелантерит.
94. Формула мелантерита (молекулы) – FeSO4.
95. Минерал, который является сульфатом кальция – ангидрит.
96. Формула ангидрита (молекулы) – СаSO4.
Гидраты сульфатов
97. Часто сульфаты связаны с водой, то есть являются гидратами.
98. Минерал, который является гидратом сульфата натрия – мирабилит.
99. В формуле мирабилита на одну молекулу сульфата натрия – десять молекул воды.
100. Формула молекулы мирабилита – Na2SO4*10Н2О.
101. Минерал, который является гидратом сульфата меди – цианозит (халькантит).
102. В формуле цианозита на одну молекулу сульфата натрия – пять молекул воды.
103. Формула молекулы цианозита – СuSO4*5Н2О.
104. Минерал, который является гидратом сульфата магния – английская соль.
105. В формуле английской соли на одну молекулу сульфата магния – семь молекул воды.
106. Формула молекулы горькой английской соли – MgSO4*7Н2О.
107. Минерал, который является гидратом сульфата кальция – гипс и алебастр.
108. В формуле гипса на одну молекулу сульфата кальция – две молекулы воды.
109. Формула молекулы гипса – СаSO4*2Н2О.
110. В формуле алебастра на две молекулы сульфата кальция – одна молекула воды. (Или на одну – половинка)
111. Формула молекулы алебастра – СаSO4*0,5Н2О. (Полугидрат).
112. Из минералов сульфатной группы можно добыть серу, но есть более удобные источники серы (сульфиды, самородная сера).
113. Ищите картинки минералов!
Состав веществ: схемы, а не реакции.
114. S + 3О = SO3 (оксид серы VI)
115. SO3 + H2O = H2SO4 (серная кислота)
К
116. Меняем в H2SO4 2Н на 2К, получаем: К2SO4.
117. H2SO4 + 2К = К2SO4 (сульфат калия).
Na
118. Меняем в H2SO4 2Н на 2Na, получаем: Na2SO4.
119. H2SO4 + 2Na = Na2SO4 (сульфат натрия).
Fe
120. Меняем в H2SO4 2Н на 1 Fe, получаем: FeSO4.
121. H2SO4 + 1 Fe = FeSO4 (сульфат железа).
122. FeSO4 – формула вещества минерала мелантерит, его хим состав.
Sr
123. Меняем в H2SO4 2Н на 1 Sr, получаем: SrSO4.
124. H2SO4 + Sr = SrSO4 (сульфат стронция).
125. SrSO4 – формула вещества минерала целестин, его хим. состав.
Ca
126. Меняем в H2SO4 2Н на 1 Са, получаем: СаSO4.
127. H2SO4 + 1 Са = СаSO4 (сульфат кальция).
128. СаSO4 – формула вещества минерала ангидрит, его хим состав.
129. Добавляем 2 Н2О к CаSO4, получаем: CаSO4*2Н2О.
130. CаSO4 + 2Н2О = CаSO4*2Н2О (дигидрат сульфата кальция).
131. CаSO4*2Н2О – формула вещества минерала гипс, его хим состав.
132. Добавляем 0,5 Н2О к CаSO4, получаем: CаSO4*0,5Н2О.
133. CаSO4 + 0,5Н2О = CаSO4*0,5Н2О (полугидрат сульфата кальция).
134. То же самое: 2CаSO4 + 1Н2О = 2CаSO4*Н2О.
135. CаSO4*0,5Н2О – формула вещества минерала алебастр, его хим состав.
Mg
136. Меняем в H2SO4 2Н на 1 Mg, получаем: MgSO4.
137. H2SO4 + 1 Mg = MgSO4 (сульфат магния).
138. Добавляем 7 Н2О к MgSO4, получаем MgSO4*10Н2О.
139. MgSO4 + 7Н2О = MgSO4*7Н2О (гепта-гидрат сульфата магния).
140. MgSO4*7Н2О – формула вещества минерала горькая английская соль, его хим состав.
Cu
141. Меняем в H2SO4 Н на 1 Cu, получаем: CuSO4 (сульфат меди)
142. H2SO4 + Сu = CuSO4 (сульфат меди).
143. Добавляем 5 Н2О к CuSO4, получаем: CuSO4*5Н2О
144. CuSO4 + 5Н2О = CuSO4*5Н2О (пентагидрат сульфата меди).
145. СuSO4*5H2O – формула вещества минерала цианозит, его хим состав.
Методы определения сульфатов в сточной и питьевой воде
О сульфатах
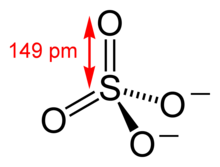
Термином «сульфат» в специальной литературе обозначают анион (SO4 2- ) сильной двухосновной серной кислоты (неорганические сульфаты) и эфиры серной кислоты с различными ароматическими и алифатическими спиртами (органические сульфаты).
Растворимые и нерастворимые
Сульфаты в своем большинстве хорошо растворяются в воде (FeSO4, MgSO4, K2SO4, Na2SO4). Исключение составляют сульфаты металлов главной подгруппы второй группы таблицы Д. И. Менделеева: CaSO4, SrSO4, BaSO4, RaSO4, а также PbSO4. Сульфаты этих металлов выпадают в виде кристаллических осадков, которые не растворяются даже в присутствии соляной или азотной кислоты.
Неорганические ионные соединения
Неорганические сульфаты — это ионные соединения, в составе которых есть анион SO₄²⁻. Выделяют три ряда сульфатных солей:
BaSO4, RaSO4;
CaSO4, SrSO4, PbHSO4.
· кислые сульфаты не щелочных металлов при нагревании образуют оксиды, разлагаясь с выделением SO3.
Неорганические сульфаты способны образовать кристаллогидраты — вещества, в кристаллы которых входят молекулы воды. Наиболее известны кристаллогидраты:
Органические сульфаты
Сложные эфиры серной кислоты и этилового спирта, название которых заканчиваются на суффикс «сульфат», могут называть сульфатами:
Среди органических сульфатов различают:
Сульфаты органической природы являются мощными алкилирующими агентами (диметилсульфат) и используются в органическом синтезе. Соли сульфоновой кислоты (сульфонаты) и сложные эфиры с протяженными углеводородными остатками нашли широкое применение в качестве моющих средств.
Моющая способность сульфонатов обусловлена строением молекулы, полярная часть которой ( — SO 3- Na + ) обеспечивает её растворимость в воде, а крупная алкильная часть, расположенная в п-положении, придает молекуле способность растворяться в жире.
В результате этого частички жира вместе с загрязнителями диспергируются в виде мицелл и переходят в водную фазу.
Сульфаты в воде
В природных водах сульфаты присутствуют всегда. Некоторые сульфатсодержащие минералы (гипс) постоянно растворяются под действием осадков. Также в природные воды попадают сульфаты из атмосферного воздуха, где идут реакции окисления оксида серы (IV) до оксида серы (VI), процессы образования серной кислоты и ее полной или частичной нейтрализации. Преумножают сульфатное загрязнение и стоки с промышленных предприятий.
Откуда берутся в питьевой
Сульфаты обнаруживаются не только в реках, ручьях и озерах. Избыточное содержание сульфатов наблюдается в подземной воде, добытой даже из глубоких водоносных горизонтов.
Риск появления нежелательных примесей в питьевой воде возрастает, если скважина расположена:
Сульфаты попадают в водоносные горизонты, когда происходит:
Опасность представляют и реагенты, применяемые для зимней обработки дорог, и подтекающие свалки отходов, и сточные воды производств, сбрасываемые без тщательной очистки. Загрязненные воды в период снеготаяния устремляются в поверхностные водоемы и могут попасть в зоны водозаборов, откуда потом попадают в водопровод.
Источники появления в сточных водах
Под термином «сточные воды» согласно российскому Водному кодексу объединены сточные воды централизованной системы водоотведения, дождевая и талая воды, стоки со свалок, а также другая вода, которая сбрасывается или отводится в природные водоемы после использования или которая стекает с водосборной площади.
Сульфаты обнаруживаются в стоках, образовавшихся в результате:
Избыточное содержание сульфатов наблюдается в стоках предприятий, использующих в технологическом цикле серную кислоту. На коксохимических заводах из аммиака и H2SO4 в больших количествах получают сельскохозяйственное удобрение — сульфат аммония. Из почвы (NH4)2SO4 вымывается с осадками в поверхностные водоемы. В зимний период дороги посыпают сульфатсодержащим противогололедным реагентом, который из ливневой канализации массово уходит в реки.
Нормы содержания и ПДК
Повышенные концентрации сульфатов ухудшают органолептические показатели водопроводной воды, оказывают влияние на здоровье человека.
В ГОСТ 31940-2012 закреплены методы измерения концентрации сульфатов в питьевой воде, в том числе разлитой в бутылки. Если содержание солей серной кислоты превышает нормативы, воду перед использованием необходимо очистить.
Польза и вред сульфатов
В зависимости от преобладания в сульфатной воде того или иного компонента выделяют воды:
Влияние на организм человека
Особенность сульфатных вод проявляется в их выраженном воздействии на пищеварительную систему. Употребление минеральной воды с преобладанием сульфатов (более 25%) способствует:
Избыточное количество сульфатов (более 500 мг/дм 3 ) придает питьевой воде горький вкус, а в концентрации 1-2 г на литр сульфатная вода оказывает слабительное действие. Отмечен эффект тормозящего влияния сульфатов на реакцию утоления жажды (Егорова, 2002), в конечном итоге приводящий к увеличению нагрузки не на почки, а на кишечник.
Водопроводы и стоковые коммуникации
С кальцием сульфаты образуют прочную накипь. С повышением температуры воды растворимость сульфата кальция снижается, соль выделяется из воды, оседая на поверхностях труб и нагревательных элементах. Незначительные отложения состоят преимущественно из двуводного гидрата CaSO4 2H2O (гипса), но утолщение накипи приводит к нагреванию прилегающего к металлу слоя. При 100 °С гипс превращается в полуводный гидрат
CaSO4 1/2H2O, снять который крайне затруднительно даже промыванием системы кислотой.
Круговорот сульфатов в природе
Основным резервом сульфатов, вовлекаемых в природный круговорот, в настоящее время выступает самородная сера и сульфатсодержащие минералы. Осадочные породы, особенно органические сланцы, дают большие количества сульфатов путем окисления минералов с одинаковой химической формулой FeS₂ —лучистого колчедана (марказита) и пирита.
В почвенных слоях постоянно идет окислительно-восстановительный обмен серой между сульфидами серы, находящимися в бескислородных условиях в толще почвы, и доступными сульфатами вблизи поверхности. Сульфид окисляется до сульфата в присутствии воздуха, а сульфат восстанавливается до сульфида в анаэробных условиях.
В морях в результате деятельности бактерий происходит восстановление глубоководных сульфатных отложений. Образовавшийся при этом сероводород мигрирует к поверхности воды, где окисляется кислородом атмосферного воздуха до сульфат-иона.
Значительное количество сероводорода остается в подземных водах. Если в воде присутствует железо, образовавшийся FeS способен выпасть в осадок, в результате чего из воды удаляются как ионы железа, так и сульфиды.
В почве за восстановление сульфатов отвечают почвенные бактерии, в этом случае большие количества сероводорода поступают непосредственно в атмосферу.
Сульфат-ион — основная форма серы, доступная организмам-автотрофам. Сульфаты поглощаются живыми существами, благодаря метаболизму которых восстанавливаются и входят в состав белков. При гниении отмерших организмов сера возвращается в круговорот.
Количественные методики определения по ГОСТу
Химическое титрование
С трилоном Б
В питьевой воде концентрацию сульфатов определяют по ГОСТ 31940-2012 титриметрически, с ЭДТА-Na2 (трилоном Б) (метод 1).
К пробе анализируемой воды прибавляют соляную кислоту для подкисления среды, а затем барий хлористый. Происходит осаждение сульфат-ионов и образование сернокислого бария BaSO4 с появлением в растворе характерной белой мути.
Сульфат бария BaSO4 в аммиачной среде растворяют в растворе ЭДТА-Na2 (трилона Б). Избыток ЭДТА-Na2 затем титруют раствором, содержащим ионы магния, в присутствии индикатора эриохрома черного. Титрование прекращают, когда произойдет смена окраски — синий цвет сменится на лиловый. Количество ЭДТА-Na2, израсходованного на растворение BaSO4, эквивалентно количеству сульфат-ионов во взятом объеме воды.
С хлоридом бария
По методу 2 из ГОСТ 31940-2012 сульфаты определяют титрованием анализируемой пробы воды раствором соли бария в водно-ацетоновой среде (или водно-спиртовой) при рН 1,5-2,0. Индикатором служит нитхромазо (или ортаниловый К, или хлорфосфоназо). Ионы бария связывают сульфат-ионы, образуется BaSO4 — слаборастворимый осадок. В точке эквивалентности избыток ионов бария взаимодействует с индикатором, образуя комплексное соединение. В этот момент жидкость в колбе меняет фиолетовый цвет на голубой. Чтобы устранить влияние катионов аликвотную часть раствора предварительно обрабатывают катионитом КУ-2.
Фотометрические методы определения сульфатов
Определение сульфатов нефелометрическим и турбидиметрическим методами основано на измерении интенсивности рассеянного света (нефелометрия) или света, прошедшего через мутную среду (титриметрия).
Оба метода предполагают наличие в исследуемом растворе частиц определяемого вещества, находящегося в растворе во взвешенном состоянии.
Нефелометрия
Определение сульфатов нефелометрическим методом базируется на осаждении сульфат-ионов BaCl2 в присутствии HCl и реагента-стабилизатора (желатина, крахмала). В реакции образуется сульфат бария, медленно выпадающий в осадок и образующий суспензию.
Оптическую плотность суспензии измеряют на нефелометре, а концентрацию сульфатов в воде затем рассчитывают по предварительно построенному градуировочному графику.
Турбидиметрия
Сульфаты турбидиметрическим методом определяют на фотометре или спектрофотометре, способным измерить интенсивность помутнения водной пробы. Мутность развивается после взаимодействия находящихся в пробе сульфатов с осадительной смесью, в состав которой входит BaCl2, стабилизирующий реагент (этиленгликоль), а также этанол для снижения растворимости. Прибор фиксирует оптическую плотность помутневшего раствора относительно дистиллированной воды. Точное содержание сульфат-ионов в отобранной на анализ воде, как и в случае нефелометрии, рассчитывают по градуировочному графику.
Очистка вод от сульфатов
Удаление в быту
Вода с избытком сульфатов кроме неприятных вкусовых ощущений и расстройства кишечника, способна вывести из строя бытовую технику.
Удалить сульфаты из воды народными средствами не получится. Лучше всего установить в квартире или коттедже фильтр с системой обратного осмоса. Вода с растворенными в ней солями под давлением проходит через полупроницаемую мембрану фильтра, на которой оседают минеральные соли, бактерии и тяжелые металлы, а очищенная вода беспрепятственно проходит дальше. Фильтр обратного осмоса позволяет очистить воду на 98%, снизив жесткость и устранив риск для здоровья и бытовых приборов.
Предприятия водоподготовки
Очистка больших объемов загрязненной сульфатами воды осуществляется на производствах тремя основными способами:
Сточную воду обрабатывают известковым молоком в присутствии коагулянта и флокулянта. При взаимодействии оксида кальция CaO с водой образуется гидроксид кальция Ca(OH)2, осаждающий сульфаты из сточной воды.
Коагулянт повышает эффективность сорбции сульфатов на хлопьевидном осадке. Добавление флокулянта сокращает дозу коагулирующего реагента, повышает плотность образующихся хлопьев и, в конечном итоге, облегчает отделение плотного осадка от остальной воды в момент фильтрации.
Сульфаты, присутствующие в питьевой воде в допустимых СанПиН концентрациях, для человека не опасны. Увеличение содержания сульфат-ионов в воде ухудшает качество жизни, со временем выводит из строя бытовую технику и водопроводные коммуникации. Поэтому так важно точно знать концентрацию сульфатов в воде и при малейшем подозрении на превышение санитарных и технических нормативов делать анализ этого параметра в аккредитованной лаборатории.