streptococcus epidermidis что это такое
Кожный стафилококк — симптомы, лечение, исследование. Что такое Staphylococcus epidermidis?
Кожный стафилококк — симптомы, лечение, исследование. Что такое Staphylococcus epidermidis
Кожный стафилококк (Staphylococcus epidermidis) является потенциально смертельной бактерией, которая обычно встречается на коже, слизистой оболочке полости рта и в мочеполовых путях. Кто подвергается риску заражения кожным стафилококком? Какие заболевания вызывает кожный стафилококк? Как лечить инфекцию Staphylococcus epidermidis?
Бактерии кишечной палочки и метициллинрезистентный золотистый стафилококк (бактерии MRSA) являются опасными и очень быстро распространяющимися бактериями. Инфекция Staphylococcus aureus может вызывать такие заболевания, как пневмония, миокардит, флебит и менингит. В свою очередь, бактерия Escherichia coli (кишечная палочка), причина для инфекций мочевыводящих путей, уретрита, цистита. Последствия инфекции E.coli в значительной степени зависят от штамма бактерий.
Бактерия Escherichia coli
Бактерия Escherichia coli
» data-medium-file=»https://i0.wp.com/medcentr-diana-spb.ru/wp-content/uploads/2020/07/Бактерия-Escherichia-coli.jpg?fit=400%2C300&ssl=1″ data-large-file=»https://i0.wp.com/medcentr-diana-spb.ru/wp-content/uploads/2020/07/Бактерия-Escherichia-coli.jpg?fit=733%2C550&ssl=1″ loading=»lazy» src=»https://i0.wp.com/medcentr-diana-spb.ru/wp-content/uploads/2020/07/%D0%91%D0%B0%D0%BA%D1%82%D0%B5%D1%80%D0%B8%D1%8F-Escherichia-coli.jpg?resize=900%2C675&ssl=1″ alt=»Бактерия Escherichia coli» width=»900″ height=»675″ srcset=»https://i0.wp.com/medcentr-diana-spb.ru/wp-content/uploads/2020/07/Бактерия-Escherichia-coli.jpg?w=900&ssl=1 900w, https://i0.wp.com/medcentr-diana-spb.ru/wp-content/uploads/2020/07/Бактерия-Escherichia-coli.jpg?resize=400%2C300&ssl=1 400w, https://i0.wp.com/medcentr-diana-spb.ru/wp-content/uploads/2020/07/Бактерия-Escherichia-coli.jpg?resize=733%2C550&ssl=1 733w, https://i0.wp.com/medcentr-diana-spb.ru/wp-content/uploads/2020/07/Бактерия-Escherichia-coli.jpg?resize=768%2C576&ssl=1 768w» sizes=»(max-width: 900px) 100vw, 900px» data-recalc-dims=»1″ /> Бактерия Escherichia coli
Между тем оказывается, что Staphylococcus epidermidis, то есть кожный стафилококк, является гораздо более опасной бактерией. Эта бактерия становится все более устойчивой к антибиотикам и вызывает опасные для жизни инфекции после операции.
Что такое кожный стафилококк?
Этот тип стафилококка часто игнорируется в клинических испытаниях, и из-за его повсеместного распространения он может очень быстро эволюционировать и генетически мутировать между бактериями.
Проблема с кожным стафилококком возникает, когда снижается иммунитет — тогда инфекция Staphylococcus epidermidis может вызвать ряд осложнений и стать фактором риска для многих заболеваний. Кожный стафилококк особенно опасен для людей, прошедших инвазивные процедуры.
Кожный стафилокок — симптомы
Симптомы активации стафилококковой инфекции :
» data-medium-file=»https://i0.wp.com/medcentr-diana-spb.ru/wp-content/uploads/2020/07/Стафилококковая-инфекция.jpg?fit=440%2C300&ssl=1″ data-large-file=»https://i0.wp.com/medcentr-diana-spb.ru/wp-content/uploads/2020/07/Стафилококковая-инфекция.jpg?fit=806%2C550&ssl=1″ loading=»lazy» src=»https://i0.wp.com/medcentr-diana-spb.ru/wp-content/uploads/2020/07/%D0%A1%D1%82%D0%B0%D1%84%D0%B8%D0%BB%D0%BE%D0%BA%D0%BE%D0%BA%D0%BA%D0%BE%D0%B2%D0%B0%D1%8F-%D0%B8%D0%BD%D1%84%D0%B5%D0%BA%D1%86%D0%B8%D1%8F.jpg?resize=900%2C614&ssl=1″ alt=»Стафилококковая инфекция» width=»900″ height=»614″ srcset=»https://i0.wp.com/medcentr-diana-spb.ru/wp-content/uploads/2020/07/Стафилококковая-инфекция.jpg?w=900&ssl=1 900w, https://i0.wp.com/medcentr-diana-spb.ru/wp-content/uploads/2020/07/Стафилококковая-инфекция.jpg?resize=440%2C300&ssl=1 440w, https://i0.wp.com/medcentr-diana-spb.ru/wp-content/uploads/2020/07/Стафилококковая-инфекция.jpg?resize=806%2C550&ssl=1 806w, https://i0.wp.com/medcentr-diana-spb.ru/wp-content/uploads/2020/07/Стафилококковая-инфекция.jpg?resize=768%2C524&ssl=1 768w» sizes=»(max-width: 900px) 100vw, 900px» data-recalc-dims=»1″ /> Стафилококковая инфекция
Симптомы кожного стафилококка неспецифичны — каждый случай кожного стафилококка может иметь немного разные симптомы в зависимости от того, какая часть тела поражена. Люди, которым предстоит операция, должны обратить внимание на симптомы кожного стафилококка.
Кожный стафилококк у ребенка
Иммунная система ребенка более чувствительна, чем у взрослого, поэтому кожный стафилококк может быть опасным даже для самых маленьких. Если у ребенка есть повреждения кожи — его следует тщательно обработать, одеть и защитить от внешних факторов, чтобы избежать инфекции. Если у вашего ребенка изменения кожи без причины — обратитесь к врачу.
Стафилококки у ребенка могут вызвать фолликулит, стафилококковый сикоз, множественные абсцессы. Такие заболевания, как буллезное импетиго, буллезное воспаление и шелушение кожи, могут возникать в результате стафилококковой инфекции у новорожденных.
Кожный стафилококк — как можно заразиться?
Кожная стафилококковая инфекция возникает у пациентов с ослабленным иммунитетом,например, после тяжелой инфекции, после операции, после химиотерапии, у реципиентов органов и костного мозга. Бактерия попадает в кровоток и приводит к генерализованной инфекции, то есть к стафилококковой бактериемии.
Кожный стафилококк — какие заболевания может вызывать Staphylococcus epidermidis?
Проникнув в организм, стафилококк вызывает:
Кожный стафилококк — диагностика
Как выявить инфекцию Staphylococcus epidermidis? Для этого проводятся анализы крови, мочи и ткани из зараженной области кожи.
» data-medium-file=»https://i0.wp.com/medcentr-diana-spb.ru/wp-content/uploads/2020/07/Диагостика-стафилококка.jpg?fit=450%2C300&ssl=1″ data-large-file=»https://i0.wp.com/medcentr-diana-spb.ru/wp-content/uploads/2020/07/Диагостика-стафилококка.jpg?fit=825%2C550&ssl=1″ loading=»lazy» src=»https://i0.wp.com/medcentr-diana-spb.ru/wp-content/uploads/2020/07/%D0%94%D0%B8%D0%B0%D0%B3%D0%BE%D1%81%D1%82%D0%B8%D0%BA%D0%B0-%D1%81%D1%82%D0%B0%D1%84%D0%B8%D0%BB%D0%BE%D0%BA%D0%BE%D0%BA%D0%BA%D0%B0.jpg?resize=900%2C600&ssl=1″ alt=»Диагностика стафилококка» width=»900″ height=»600″ srcset=»https://i0.wp.com/medcentr-diana-spb.ru/wp-content/uploads/2020/07/Диагостика-стафилококка.jpg?w=900&ssl=1 900w, https://i0.wp.com/medcentr-diana-spb.ru/wp-content/uploads/2020/07/Диагостика-стафилококка.jpg?resize=450%2C300&ssl=1 450w, https://i0.wp.com/medcentr-diana-spb.ru/wp-content/uploads/2020/07/Диагостика-стафилококка.jpg?resize=825%2C550&ssl=1 825w, https://i0.wp.com/medcentr-diana-spb.ru/wp-content/uploads/2020/07/Диагостика-стафилококка.jpg?resize=768%2C512&ssl=1 768w» sizes=»(max-width: 900px) 100vw, 900px» data-recalc-dims=»1″ /> Диагностика стафилококка
Кожный стафилококк — лечение
Ученые из Центра эволюции Милнера при Университете Бата определили в стафилококковых бактериях кожи 61 ген, которые могут вызывать смертельные заболевания. Пробы были взяты у пациентов, перенесших инфекции после операции по замене тазобедренного или коленного сустава и фиксации перелома, и были сопоставлены с образцами мазков кожи от здоровых добровольцев.
Удивительно, что у некоторых здоровых людей, принявших участие в исследовании, были обнаружены еще более смертельные формы бактерий. Также было обнаружено, что Staphylococcus epidermidis образует биопленки, которые повышают сопротивляемость организма к антибиотикам.
Лечение кожного стафилококка предполагает использование антибиотиков. К сожалению, некоторые антибиотики не действуют против некоторых типов кожного стафилококка — лекарственная устойчивость кожного стафилококка аналогична таковой у золотистого стафилококка.
В случае штаммов с высокой лекарственной устойчивостью используются ванкомицин или тейкопланин, эффективные против стафилококков, включая штаммы, устойчивые к метициллину.
Streptococcus epidermidis что это такое
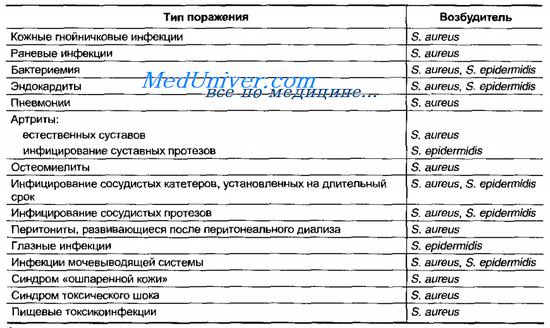
Эпидермальные стафилококки ( Staphylococcus epidermidis ) колонизируют гладкую кожу и поверхность слизистых оболочек и обычно слабо вирулентны. Подавляющее большинство инфекций носит госпитальный характер, их чаще выявляют у пациентов с пониженной резистентностью (табл. 12-1).
Типичными для эпидермального стафилококка считают поражения, обусловленные инфицированием различных устройств (протезов, катетеров, дренажей) либо гематогенным диссеминированием возбудителя после хирургических вмешательств. Например, он вызывает до 50% эндокардитов у больных с протезированными клапанами сердца.
Достаточно часто микроорганизм обусловливает поражения мочевыводящей системы (особенно у лиц старше 50 лет с различными формами урологической патологии в анамнезе) и суставные инфекции, чаще развивающиеся не позднее 1 года после имплантации протеза (50% всех случаев).
Факторы патогенности эпидермального стафилококка
Способность вызывать поражения обусловливают гидрофобные свойства поверхности эпидермального стафилококка, облегчающие адгезию к субстратам, и поверхностный полисахарид-ный слизистый слой, предохраняющий бактерию от действия микробицидных и цитотоксических агентов. Подобно поражениям, вызываемым S. aureus, важное патогенетическое значение имеют компоненты клеточной стенки S. epidermidis, стимулирующие развитие воспалительных реакций и оказывающие многостороннее действие на ткани.
Микробиологическая диагностика эпидермального стафилококка
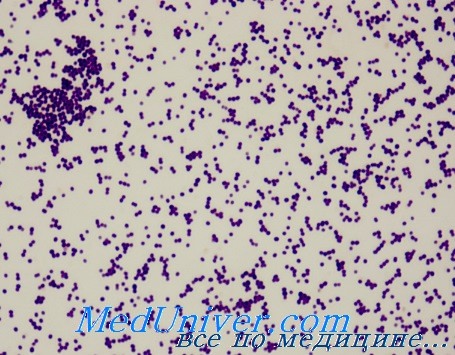
Микроскопия окрашенных мазков клинического материала эпидермального стафилококка позволяет выявить скопления грамположительных кокков и полиморфно-ядерных лейкоцитов. Микроорганизм не проявляет гемолитической активности, на КА образует беловатые гладкие выпуклые колонии. Основное отличие от S. aureus — отсутствие коагулазной активности.
Выделенные коагулаза-отрицательные стафилококки следует дифференцировать от других стафилококков, иногда выделяемых из мочи (например, S. saprophyticus). Для дифференцировки учитывают их резистентность к новобиоцину (МИК более 1,6мкг/мл), к которому S. epidermidis чувствителен. Следует помнить о появлении и увеличении удельного веса метициллин-резистентных штаммов эпидермального стафилококка (MRSE). Они обычно чувствительны к ванкомицину, особенно в комбинации с гентамицином и рифампицином.
Содержание
Дерматология в России
Зарегистрируйтесь!
Если Вы врач, то после регистрации на сайте Вы получите доступ к специальной информации.
Если Вы уже зарегистрированы, введите имя и пароль (форма в верхнем правом углу или здесь).
Эпидермальный стафилококк: потенциальный новый игрок в физиопатологии акне?
Эпидермальный стафилококк: потенциальный новый игрок в физиопатологии акне?
Введение
Два разных типа микроорганизмов присутствуют на коже и придатках. Один из них состоит из резидентных микроорганизмов или комменсалов, которые, в большинстве случаев, являются безвредными и непатогенными, а иногда и полезны для хозяина. Вторая группа состоит из транзиторных микроорганизмов, которые могут оказывать вредное и патогенное воздействие и колонизируют кожу после травмы, что приведет к воспалению и развитию инфекции кожи [1–3].
Благодаря доступности биоинформационных технологий, ведущих к обнаружению новых филогенетических подходов, в последние годы было сделано много открытий. Проведены исследования по изучению разнообразия и топологии микробиотеы кожи, по выявлению различных комменсальных микроорганизмов, присутствующих на коже. Это позволило оценить относительную численность каждой популяции, и понять их полезную роль или вклад в дерматологические состояния, такие как акне[4–6].
Метагеномный анализ и секвенирование рибосом 16S РНК гена являются преобладающими бактериологическими методами для анализа бактериального состава микробных сообществ и для выбора наиболее эффективного дизайна исследования, имеющее решающее значение для получения значимых результатов анализа [7].
Из них C. acnes и S. epidermidis являются двумя основными комменсальными кожными бактериями [3, 10–12].
До недавнего времени исследования в области акне были в основном сосредоточены на роли C. acnes, тогда как роль S. epidermidis обсуждалась в течение нескольких лет, но ее еще предстоит выяснить [10, 13].
Целью настоящей статьи является обзор опубликованных данных о роли S. epidermidis в физиопатологии акне и представление будущих перспектив лечения на основании имеющихся данных и доказательств.
Методы
Был произведен обзор литературы, опубликованной между началом 2000 и 2018 гг. и доступная в PubMed, с использованием следующих ключевых слов: акне, вульгарное акне + микробиота, кожа + микробиота, акне + микробиота + Propionibacteria acnes + Staphylococcus epidermidis, бактериальная устойчивость, кожные комменсалы + Propionibacterium acnes + Staphylococcus epidermidis.
Результаты
Взаимодействие кожи хозяина и кожной микробиоты
Более того, специфичность может быть достигнута путем совместного распознавания патоген-ассоциированных молекул через их рецепторы распознавания [6].
Таким образом, оба таких признанных комменсала C. acnes и S. Epidermidis взаимодействуют с хозяином, помогая защитить здоровую кожу от колонизации патогенами [9, 16].
Рис. 1. Здоровая кожа и кожа с акне. а. Здоровая кожа. В здоровой коже S. epidermidis контролирует пролиферацию C. acnes. b Образование микрокомедона после чрезмерной колонизации кожи C. acnes, приводящей к дисбиозу. Чрезмерная колонизация C. acnes в период полового созревания приводит к дисбактериозу и угревой болезни. AMP, антимикробные пептиды; TLR, Toll-подобные рецепторы; PAR, протеазоактивированные рецепторы.
Однако состав кожной микробиоты постоянно развивается и меняется со временем. Например, нарушение баланса или дисбактериоз ранее здоровой кожи, вызванный внешними факторами, такими как травма, стресс или загрязнение, или эндогенными факторами (гормональные изменения, изменения pH), может вызывать воспалительные заболевания кожи, такие как акне, атопический дерматит, розацеа и псориаз [13, 17–21].
Это чрезмерное размножение может быть связано с доступностью питательных веществ [22].
Роль C. acnes
В здоровой коже C. acnes играет полезную роль в микробиоте пилосебацейного комплекса. Он ограничивает рост S. aureus, метициллин-устойчивых штаммов S. aureus, а также S. pyogenes при поддержании кислого рН в пилосебацейном комплексе путем гидролиза триглицеридов кожного сала и секреции пропионовой кислоты [6, 23, 24].
Тем не менее, в период полового созревания чрезмерная колонизация пилосебацейного комплекса C. acnes может привести к потере разнообразия и дисбиозу, что приводит к развитию акне [6, 25–27].
Недавнее клиническое исследование, в котором использовался метод типирования на основе однолокусной последовательности, изучало подгруппы C. Acnes на лице и спине у пациентов с тяжелым акне и у здоровых людей [28].
Почти у 75% пациентов с угревой сыпью филотипы C. acnes были идентичны на лице и спине, тогда как это было только у 45% здоровых людей. В здоровой группе филотипы IA1 (39%) и II (43%) были основными филотипами, тогда как в группе акне филотип IA1 (84%), особенно на спине (96%), был основным. Это может подтвердить гипотезу о том, что тяжесть акне может быть связана с потерей разнообразия филотипов C. acnes и выбора основного филотипа IA1 среди пациентов с акне [28–30].
Следовательно, различные воспалительные профили зависят от филотипа (то есть филотипа IA1, который в основном наблюдается на лице и спине пациентов с акне), который активирует врожденный иммунитет посредством экспрессии протеазоактивируемых рецепторов (PAR), фактора некроза опухоли-α и интерферон-γ и интерлейкинов (ИЛ-8) [28, 31–37].
Кроме того, C. acnes активирует высвобождение липаз, матриксных металлопротеиназ и гиалуронидаз, приводя к гиперкератинизации пилосебационной единицы и, наконец, к комедонам, папулам и пустулам [31–34, 38].
На рис. 1 показана разница между здоровым микробиомом и микробиомом с дисбиозом.
Роль S. epidermidis
S. epidermidis – это наиболее часто выделяемый из эпителия комменсальный вид [25, 39].
Он колонизирует преимущественно подмышечные впадины, голову, носовые ходы и обычно непатогенен для человека[11, 39].
Большинство клинических изолятов относятся к CC2, из которых часто выделяется ST2. Возможно, успешное распространение ST2 может быть связано с тем, что все изоляты ST2 содержат IS256 последовательность и гены ica – эти два фактора коррелируют с инвазивностью S. epidermidis [42, 43].
Тем не менее, до сих пор существует спор о том, является ли icaA полезным маркером биопленки S. epidermidis [44].
Лечение осложняется специфическими антибиотикорезистентными генами и образованием биопленок, многоклеточных агломераций, которые обладают внутренней устойчивостью и толерантностью к антибиотикам и механизмам защиты хозяина [46].
Кроме того, исследования выявили специфические молекулярные детерминанты, позволяющие иммунную инвазию S. epidermidis и способность вызывать хронические заболевания [47].
Предполагается, что S. epidermidis имеет свои, оригинальные функции для неинфекционного образа жизни, подчеркивая случайную природу инфекций S. epidermidis, что позволяет проводить различие между носительством, заражением и инфекцией. Лучшее понимание физиологии S. epidermidis важно для оценки терапевтических стратегий против инфекций S. epidermidis [39].
Некоторые штаммы S. epidermidis могут модулировать врожденный иммунный ответ хозяина, особенно TLR 2, и, таким образом, позволяют хозяину бороться с патогенами [6, 28].
Было показано, что фенорастворимые модулины, продуцируемые S. epidermidis, избирательно ингибируют кожные патогены, такие как S. aureus и Streptococcus группы A, и вместе с антимикробными пептидами хозяина(AMP) усиливают их элиминацию [48–50].
Кроме того, S. epidermidis активирует экспрессию AMP кератиноцитов через TLR2-зависимый механизм [51].
Это подтверждает, что этот комменсал тесно взаимодействует с врожденным иммунитетом хозяина [48, 49].
Это также было показано через микродиссекцию эпидермиса, дермы, жировой ткани с последующим секвенированием 16S рибосомальной РНК, демонстрирующим, что колонизация S. epidermidis регулирует перемещение Т-клеток и их функции через IL-1 [52, 53].
В другой недавней исследовательской работе сообщалось, что S. epidermidis может также защищать от новообразований кожи путем производства 6-N-гидроксиаминопурина, молекулы, которая ингибирует активность ДНК-полимеразы [54].
Кроме того, масляная кислота, выделяемая S. epidermidis, позволяет стволовым клеткам жировой ткани дифференцироваться в адипоциты и накапливать липиды в цитоплазме, что приводит к увеличению дермального слоя [55].
Взаимодействие между S. epidermidis и C. acnes при акне
S. epidermidis и C. acnes используют глицерин в качестве общего источника углерода для производства различных короткоцепочечных жирных кислот (SCFA), используемых в качестве противомикробных средств для конкуренции друг с другом. Эти два микроорганизма играют роль в патогенезе и развитии акне. [56, 57].
Пока нет никаких доказательств того, что S. epidermidis играет активную роль в патогенезе акне,но преимущественно C. acnes в настоящее время ассоциируется с угрями [9].
Среди штаммов S. epidermidis с повышенной антимикробной активностью наблюдались различия в диаметре ингибиторных зон, что указывает на то, что антимикробные вещества имели различную природу. Большинство штаммов S. epidermidis имели небольшие зоны ингибирования (2–4 мм) против C. acnes, а некоторые штаммы создавали светонепроницаемые зоны ингибирования. Один штамм, FS1 продуцировал очень большие ингибирующие зоны (> 10 мм), но не был активен против всех протестированных штаммов C. acnes. Другой штамм, 14.1.R1, ингибировал все штаммы C. acnes, но продуцировал только небольшие зоны ингибирования (2–5 мм). Не было отмечено различий в противомикробной активности штаммов S. epidermidis, выделенных из нормальной и кожи с акне, соответственно. Аналогичным образом, происхождение штаммов C. acnes не определяло их восприимчивость к антимикробной активности S. epidermidis, поскольку штаммы, выделенные из очагов угревой сыпи и здоровой кожи существенно не отличались по характеру восприимчивости к S. epidermidis. Наоборот, исследование показало более высокую антимикробную активность среди C. Acnes филогруппы I-2, против S. epidermidis. Авторы выдвинули гипотезу о возможном наличии и секреции бактериоцина или бактериоцино подобного вещества, специфичного для филогруппы I-2 C. acnes [13].
Зависимость степени тяжести акне(легкая, умеренная или тяжелая ) от антимикробной активности варьировала от 29 до 39%. Следовательно, штаммы C. acnes типа IA1 CC18, в основном участвующие в акне, не проявляли более высокой антимикробной активности по сравнению со здоровыми штаммами.
Так как на коже присутствуют как С. acnes, так и S. epidermidis, подавление воспаления, вызванного С. Acnes, может зависеть от активации на кератиноцитах стафилококком LTA miR-143 пути, необходимого для снижения воспалительной реакции. Исследования показали, что механизм LTA-miR-143-опосредованной супрессии передачи сигналов TLR2 осуществляется с помощью miR-143, нацеленного на 3’UTR TLR2. Тем самым уменьшается количество белка TLR2, и уменьшается воспаление, вызванного С. acnes [58–60].
Таким образом, он помогает регулировать гомеостаз кожи и подавлять воспаление, вызыванное C. acnes [58, 61].
Соответственно, несбалансированное равновесие между C. acnes и S. epidermidis в пилосебациальных единицах пациентов с акне в пользу филотипа IA1 CC18 C. acnes (75–80 случаев) может не позволить S. epidermidis в полной мере играть свою роль в качестве регулятора естественного кожного гомеостаза и ограничении роста C. acnes. На рисунке 2 визуально показано взаимодействие между C. acnes и S. epidermidis.
Рисунок 2. Бактериальные взаимодействия на коже. AMP, антимикробные пептиды.
S. epidermidis и его значение в выборе текущих и будущих методов лечения акне
Современное местное лечение акне включает в себя различные ретиноиды, такие как адапален и третиноин, которые уменьшают воспаление путем изменения врожденного иммунитета, активируемого C. acnes [62–65].
Помимо бензоилпероксида, применение антибактериальных средств, таких как эритромицин и клиндамицин, в монотерапии привело к развитию устойчивых к антибиотикам штаммов не только C. acnes, но и S. epidermidis в течение 4–6 недель [30, 57, 66].
Системные антибиотики, как сообщается, вызывают лишь небольшую резистентность, но могут привести к побочным эффектам в микробиоте кишечника [30, 33, 67].
Пероральный изотретиноин нормализует реакцию врожденной иммунной системы на C. acnes путем ингибирование ее пролиферации [68].
Таким образом, устранение только С. acnes может способствовать пролиферации S. aureus, вызывая воспаление кожи и полиферацию S. epidermidis, приводя к другому несбалансированному гомеостазу кожи и риску нозокомиальных инфекций.
AMP являются эффекторными молекулами врожденной иммунной системы кожи. Они являются амфипатическими (одновременно липофильные и липофобные) и разрушают липидную мембрану бактерии, приводя к лизису и гибели клеток, взаимодействуя преимущественно с отрицательно заряженными бактериальными мембранами, а не с нейтрально заряженными мембранами клеток млекопитающих. Важность вклада AMP в иммунитет человека неоспорим, поскольку изменения в экспрессии AMP связаны с различными патологическими процессами. Тем не менее, данные о роли AMP в обыкновенных угрях ограничены. Недавно опубликованное исследование сообщает, что AMPs hBD-1 и кателицидины играют важную роль в патогенезе угрей [69].
AMP показали активность против широкого спектра грамположительных и грамотрицательных бактерий, а также некоторых грибов, паразитов и вирусов с оболочкой [70].
Они производятся как ответ кератиноцитов и себоцитов. Однако они также способствуют развитию дополнительных воспалительных реакциий. Продукция AMP включает в себя β-дефензины, РНКазу 7, белок псориазин S100 и кателицидины и опосредуется путем MyD88 и передачей сигналов IL-1. Кроме того, было продемонстрировано, что все больше клеток экспрессируют TLR-2 по мере увеличения тяжести акне[33].
Это может быть одним из объяснений того, почему средства, нацеленные на TLR-2, такие как местные ретиноиды, обладают большей эффективностью у пациентов с более тяжелой степенью акне [71].
Цитокины также продуцируются в результате взаимодействия между C. acnes и TLR-2, дефензинами и матриксной металлопротеиназой посредством активации PAR-2R [72].
Другим подходом к лечению может быть регулярное пероральное или местное добавление в микробиоту кожи полезных микроорганизмов (пробиотиков) для пациентов с угревой сыпью для уравновешивания микробиоты кожи [73, 74].
С этой точки зрения, исследования показывают, что S. epidermidis может контролировать дисбактериоз, вызванный C. Acnes и уменьшать тяжесть акне [27, 56].
Однако до сих пор остается неясным, какой SCFA в продуктах ферментации глицерина S. epidermidis в первую очередь способствует анти-С. acnes эффект. Также не определено, действуют ли SCFA вместе с другими антимикробными молекулами в продуктах ферментации, чтобы оказать анти-С. acnes эффект. Анти-С. acnes эффект ферментированной среды сохранялась после кипячения указанной среды, что позволяет предположить, что антимикробные белки / пептиды могут не вносить основной вклад в анти-С. acnes эффект ферментированных сред [56].
Пролекарства, такие как пивалоилметилбутират SCFA (AN-9), были разработаны для достижения фармакологических концентраций таких SCFA in vivo [84].
Более того, живой S. epidermidis потенциально может быть использован в качестве активного компонента в пробиотиках для акне[27, 56].
Обсуждение и вывод
Однако нарушение равновесия в пользу S. epidermidis может также привести к другим последствиям для здоровья, таким как внутрибольничные инфекции. Следовательно, сбалансированный гомеостаз кожи должен быть конечной целью любого лечения акне.
В этом ракурсе можно рассмотреть другие варианты лечения, такие как пробиотики, полученные из S. epidermidis, позволяющие восстановить естественную, сбалансированную микробиоту, и регуляция медиаторов AMP хозяина без увеличения местной популяции S. Epidermidis эпидермиса.