streptococcus salivarius что это такое
Зеленящие стрептококки
Темой сегодняшнего разговора будет группа зеленящих стрептококков – наименование не очень легитимное, но прочно вошедшее в практику. Под наименованием «Зеленящие стрептококки или S.viridans» прячется целая группа микроорганизмов, относящихся к альфа-зеленящим стрептококкам семейства Streptococcaceae.
Автор: Трубачева Е.С., врач – клинический фармаколог
Темой сегодняшнего разговора будет группа зеленящих стрептококков – наименование не очень легитимное, но прочно вошедшее в практику, как и обзывательство антибактериальной терапии – антибиотикотерапией, а кто мы такие, чтобы отменять традиции.
Под наименованием «Зеленящие стрептококки или S.viridans» прячется целая группа микроорганизмов, относящихся к альфа-зеленящим стрептококкам семейства Streptococcaceae. Эта группа является очень важным компонентом в составе нормально микрофлоры полости рта, слизистых оболочек дыхательных путей, пищеварительного тракта и половых органов. Поэтому обнаружив следующих ее представителей (S.gordonii, S.oralis, S. mutants, S.sanguis и S.salivarius) в посеве из полости рта, не надо немедленно начинать это лечить – этим вы только навредите организму, выбив из его состава важный компонент его нормальной микрофлоры.
Рассмотрим основных представителей семейства, на которых больше всего шансов наткнуться в антибиотикограммах.
Диагностические аспекты
Освоив вышеприведенный материал, мы видим, что только обнаружение данных микроорганизмов в стерильных средах может указывать на них как на потенциальных возбудителей. Почему все-таки потенциальных? Да потому, что в 80% случаев это может оказаться банальной контаминацией в связи с несоблюдением техники забора материала (все мы дышим, и если материал забирается с нарушением правил асептики и антисептики и без использования закрытых систем, то налететь в пробирку может много чего и не только из наших рта и носов). Таким образом, посевы нужно повторять.
Обнаружение этого же зоопарка в местах естественного его обитания не говорит нам практически ничего, если только пациент совсем не следит за полостью рта, и тогда ему можно настоятельно рекомендовать посещение стоматолога.
Аспекты антибактериальной терапии
Группа зеленящих стрептококков природно резистентна к тетрациклинам, макролидам и клиндомицину (до 50% штаммов), к биссептолу резистентно более 75%. Таким образом об этих группах мы даже не вспоминаем.
Само лечение должно быть комплексным и часто в сочетании с хирургическим. Выбор конкретных препаратов будет зависеть от локализации процесса, тяжести состояния пациента и выделенного возбудителя
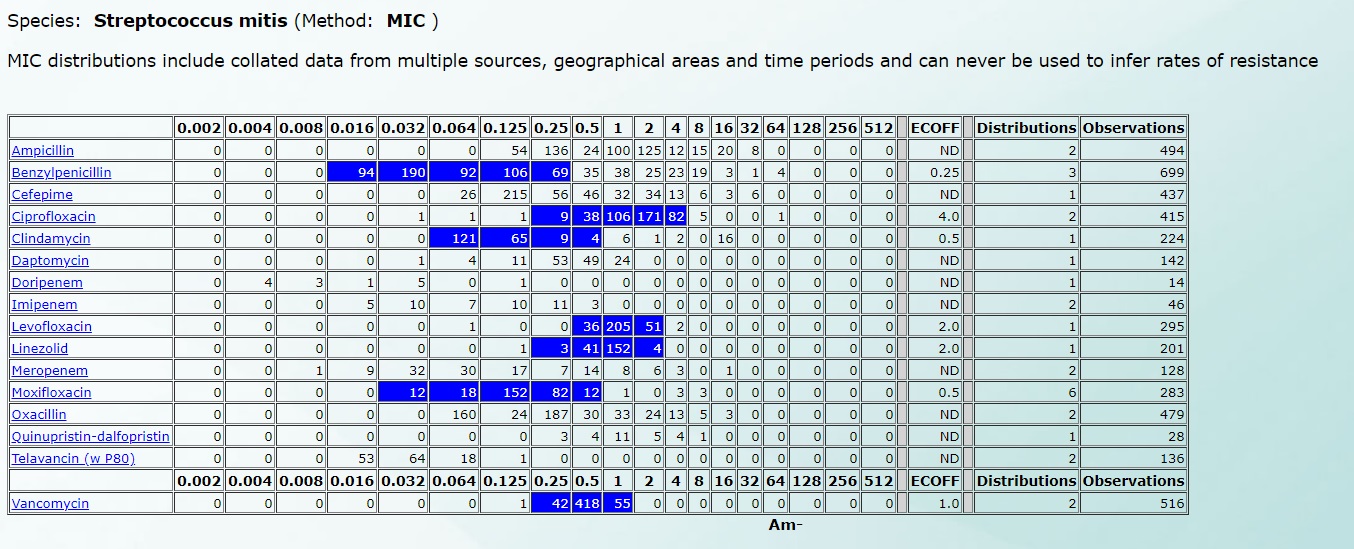
Например, чувствительность Streptococcus mitis будет выглядеть так (нажмите на картинку для увеличения):
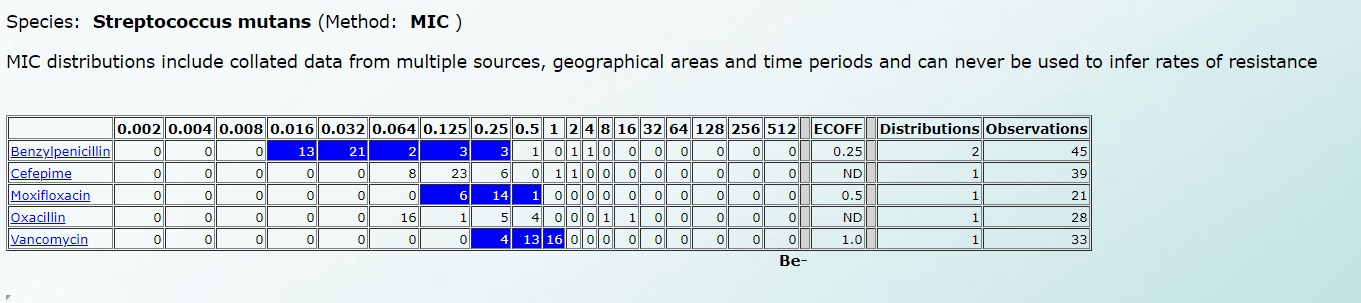
А чувствительность к Streptococcus mutans – вот так (нажмите на картинку для увеличения):
Подробнее все рассмотреть можно по этой ссылке, ведь именно на этой базе данных работают автоматические и полуавтоматические анализаторы в микробиологических лабораториях.
Препаратами выбора будут являться:
Как и в случае с любым стрептококком, крайне важно соблюдать длительность лечения, и она должна быть не менее 10-14 дней. Исключение составляет бактериальный эндокардит, там сроки лечения как минимум удваиваются.
В заключение хотелось бы сказать, что как ни прискорбно это сознавать, но недоступность, в первую очередь финансовая, адекватной стоматологической помощи вновь привела к всплеску заболеваний связанных с неблагополучием в полости рта, таким образом, мы вновь вынуждены вспоминать, что инфекционный эндокардит – это не только болезнь наркоманов и лиц со сниженным иммунным статусом, но и тех, у кого недостаточно средств на хорошего стоматолога, а потому и нам не лишне иногда осматривать полость рта у пациентов с инфекциями кровотока или абсцессами в головном мозге или печени.
Посев на Стрептококк (идентификация агента и чувствительность к а/б)
Описание исследования
Стрептококки – это факультативно-аэробные бактерии, паразитирующие в организме человека и животных. Основные места их локации – дыхательная и пищеварительная системы (особенно полость носа, рта, толстый кишечник).
Классификация бактерий данной группы проводится по типу гемолиза (разрушения красных кровяных клеток с выделением в окружающую среду гемоглобина):
Существует также деление бета-гемолитических стрептококков на подгруппы: А, В и т.д. до U.
Наиболее клинически значимыми являются несколько видов:
1. Бета-гемолитический (пиогенный) стрептококк группы А (S.pyogenes) является широко распространенным неподвижным, не образующим споры, грамположительным микроорганизмом.
Наиболее часто он образует колонии на коже и слизистых оболочках. В отдельные периоды после наступления холодов носителем S.pyogenes является почти каждый 4-й ребенок школьного возраста. Источником заражения может быть как больной человек, так и носитель инфекции. Передача возбудителя может происходить воздушно-капельным путем, при контакте с больным и с пищей. Зарождение и развитие болезни может происходить под действием токсинов, которые вырабатывает бактерия. К ним, в частности, относятся дезоксирибонуклеаза, стрептолизин, гиалуронидаза, гемолизин, стрептокеназы (А и В).
Болезни, причиной которых является инфицирование пиогенным стафилококком, можно разделить на три группы: поверхностные заболевания, внутренние инфекции; токсинопосредствованные (причиной развития которых стали вырабатываемые микроорганизмом токсины).
К поверхностным инфекциям относятся:
Внутренние инфекции, вызываемые стрептококком группы А:
Инфекция, вызванная токсинами, продуцируемыми бактериями:
Для детей заражение S.pyogenes чревато психическими расстройствами или появлением нервного тика.
100%-ное уничтожение пиогенного стрептококка возможно посредством бета-лактамных антибиотиков, к которым относятся пенициллины, цефалоспорины, карбапенемы – бактерия так и не выработала к ним «иммунитета». S.pyogenes проявляет устойчивость к макролидам (лекарственным препаратам, в большинстве антибиотикам), что является на сегодняшний день значимой проблемой.
Лицам с аллергией к пенициллину и другим бета-лактамным противобактериальным средствам рекомендуется при проведении анализа исследовать чувствительность к антибиотикам.
2. Streptococcus pneumoniae. Пневмококк Streptococcus pneumoniae является представителем рода стрептококков S. pneumoniae. Бактерия вызывает инфекционные заболевания разной локации и степени тяжести. Так, в результате присутствия бактерии может развиться пневмония, бронхит, тонзиллит (ангина), фарингит (воспаление слизистой и лимфоидной тканей глотки), риносинусит (воспаление слизистой носа и околоносовых пазух). Также пневмококк является причиной обострения хронических болезней (бронхит, обструктивная болезнь легких). Способность проникать в кровь вызывает развитие:
Наибольшую опасность Streptococcus pneumoniae представляет для детей, пожилых людей и пациентов с иммунодефицитом. Заражение женщин происходит в 2 раза реже, чем мужчин. Заболевание менингитом, вызванным пневмококком, наблюдается среди пациентов самого разного возраста. Симптомы инфекции чаще всего проявляются при снижении сопротивляемости организма (переохлаждение – как частный случай).
Инфекция передается воздушно-капельным путем. Не исключено заражение ребенка в утробе от инфицированной матери. Вспышки инфекции не имеют какой-либо системы, появляются от случая к случаю, но наиболее часто – в холодное время года.
3. Бета-гемолитический стрептококк группы В (Streptococcus group В) является неподвижной, не образующей спор, грамположительной бактерией, чаще всего создающей колонии в желудочно-кишечном тракте, носоглотке, влагалище. В подавляющем количестве случаев в роли изолятора выступает S. agalactiae. Все стрептококки, входящие в группу В, разделены на несколько серотипов, в частности на la, lb, Ic, II и III.
Представители серотипов la и III привязаны к тканям дыхательного тракта и центральной нервной системы. Они являются возбудителями менингита (воспаления оболочек мозга) и пневмонии (воспаления легких) у новорожденных детей. В то же время присутствие стрептококков группы В во влагалище является нормальным – они выявляются у 5-35% обследованных беременных. Колонизация влагалища, не сопровождаемая симптомами, наблюдается в 20 случаев из 100. Особенно характерно присутствие бактерии у женщин, моложе 20 лет, которые ведут интенсивную половую жизнь с предохранением внутриматочными средствами.
Чаще всего заражение инфекцией происходит от матери к ребенку при прохождении его через родовые пути, в которых присутствуют стрептококки. Из всех детей, входящих в группу риска, половина заражена именно таким образом. Если колонизация родовых путей значительна, то в течение пяти суток велика опасность развития менингита. При большом количестве возбудителя, попавшего в детский организм, не исключено развитие болезни в период от 6 до 90 суток.
Хотя опасность заражения высока, фактическая частота развития стрептококковой инфекции с явными симптомами составляет в возрасте до недели 1,3-3:1000, после недели – 1-1,7:1000. По данным наблюдений в среднем из 100 зараженных детей только у одного обнаруживаются явные признаки инфекции.
Кроме матери, которая представляет для ребенка потенциальную опасность, заражение стрептококком может произойти от медперсонала роддома – 16-47% сотрудников родильного отделения являются носителями инфекции. Также не исключено заражение одним младенцем другого. Если даже мать ребенка здорова, то риск заразиться стрептококковой инфекцией в больнице достаточно велик – от 13 до 43%.
Во избежание послеродовых осложнений беременным женщинам рекомендуется на 33-37 неделе пройти профилактическое обследование. Это позволит своевременно выявить стрептококковую инфекцию для последующего лечения антибиотиками при родах.
Streptococcus viridans состоит в основном из непатогенных бактерий, некоторые из которых при гемолизе окрашивают среду в зеленый тон.
При выявлении агента (агентов) инфекции определяется его (их) чувствительность к следующим антибиотикам:
Подготовка к исследованию
Соскоб берется только в ротовой полости. Оптимальным является отбор материала утром натощак, после сна.
Перед взятием соскоба запрещается:
Допускается отбор материала также через 2-3 часа после еды.
Показания к исследованию
Целью посева на стрептококк является:
Поскольку бактерии S.pyogenes и S. agalactiae на 100% чувствительны к бета-лактамным антибиотикам, возможно проведение обследования без определения чувствительности к противобактериальным препаратам.
Если у пациента наблюдается непереносимость бета-лактамы или аллергическая реакция на нее, то возможен индивидуальный подбор препарата. В таком случае определение чувствительности к противомикробным средствам проводить необходимо.
Интерпретация исследования
Данный тест является полуколичественным. В случае выявления стрептококков любых групп дается количественная оценка образовавшихся колоний (измеряется в колониеобразующих единицах на тампоне (КОЕ/тамп.)). Если бактерии не обнаружены, то ответ формулируется «не обнаружено» или «рост отсутствует».
Результат исследования выдается на бланке лаборатории «Наука». Примеры отбора проб различных локаций приведены в нижеследующих таблицах. В графе «нормы интерпретации» отмечены референсные значения.
Ф.И.О.: Иванов Сидор Петрович Пол: м Дата рождения: хх.хх.хххх
Дата исследования: хх.хх.хххх
Исследование
Результат
Нормы интерпретации
Примечание
[405] Посев на Стрептококк (дых. пути) (идентификация агента и чувствительность к а/б)
Дата выдачи (дата исследования): хх.хх.хххх
Стрептококки: чем опасны, как выявлять и лечить
Род бактерий, относящихся к условно патогенной микрофлоре. Носителями различных стрептококков являются практически все люди, включая младенцев. В норме активность микробов подавляет иммунитет. При ослаблении его защиты или получении извне большой заражающей дозы развиваются стрептококковые инфекции: воспалительные заболевания, поражающие слизистые дыхательных путей, ткани внутренних органов, зубы или оболочки мозга. Стрептококки очень устойчивы к факторам внешней среды, способны вырабатывать резистентность к антибактериальным препаратам.
Что такое стрептококки
Род Streptococcus объединяет разнообразные грамположительные микроорганизмы, способные размножаться в анаэробных условиях. Бактерии имеют шаровидную форму, их оболочки чрезвычайно устойчивы к агрессии внешней среды. В высушенных образцах биологических материалов стрептококки сохраняются жизнеспособными более года. Погибают при кипячении, химические дезинфицирующие препараты убивают их в течение 20 минут. По этой причине поверхностного антисептирования часто бывает недостаточно.
Источник распространения стрептококков — носители: зараженные или больные люди. В большой концентрации инфекция содержится на поверхности слизистых оболочек, в жидкостных выделениях: гное, экссудате, слюне. Микробы передаются от человека к человеку воздушно-капельным путем при чихании или кашле. В отличие от вирусов стрептококки разлетаются на относительно небольшое расстояние от источника: в радиусе не более трех метров. Высокая устойчивость бактерий во внешней среде определяет также алиментарный путь заражения: через грязные руки, продукты питания. Стрептококки длительное время сохраняются в молоке, мясных и морепродуктах, которые являются для этой группы инфекций питательную среду.
При размножении в организме человека стрептококки провоцируют интенсивные воспалительные реакции:
микробы группы А чаще поражают слизистые носа, ротовой полости, гортани, бронхов и легких, слухового аппарата, кожи, становятся возбудителями синуситов, тонзиллита, кариеса, ангины, пневмонии, дерматитов, рожи, скарлатины, осложнения ран и ожогов;
стрептококки группы В обычно провоцируют воспаления тканей мочевыделительной системы, суставных структур, соединительной ткани, вызывают цистит, адрекситы, инфекционные нефриты, ревматические процессы, послеродовые осложнения у женщин, эти микробы могут передаваться при половых контактах.
Развитию стрептококковых инфекций способствуют различные системные патологии и повреждения тканей. В том числе: сахарный диабет, злокачественные опухоли, иммунодефицитные, послеоперационные состояния, гиповитаминозы, открытые раны.
Признаки инфицирования
Распространенные симптомы стрептококковых инфекций:
повышение местной или общей температуры тела;
зуд, жжение, сухость в области гортани;
отечность и покраснение миндалин, образование желтого или сероватого налета на слизистых;
заложенность носа с последующими густыми выделениями зеленоватого или желтого цвета;
резкая боль и заложенность слухового прохода, серозные выделения с примесью гноя.
У большинства людей природная высокая склонность к заражению стрептококками. При передаче того или иного вида инфекции воспаляются так называемые входные ворота. Возникают ларингит, фарингит, ангина, отит. При распространении микробов из очагов заражения страдают нижние дыхательные пути, мозг, почки, кишечник и другие органы. К инфекциям вторичной формы можно отнести процессы с включением аутоиммунных механизмов: ревматоидный артрит, стрептококковый васкулит, гломерулонефрит.
Стрептококки — частые провокаторы токсических и некротических осложнений, в том числе тяжелой лихорадки, абсцессов и сепсиса.
Диагностика и лечение стрептококковых инфекций
Специфическая диагностика патогенов требует проведения бактериологического анализа соскобов слизистых, образцов слюны, мочи, мокроты, гнойного отделяемого и других биоматериалов. Кроме того, часто бывает необходимо тестирование крови на антитела к стрептококкам. Лабораторные исследования устанавливают вид возбудителя болезни в течение 20–30 минут.
Кроме этиологических анализов при различных патологиях требуется диагностика общего состояния поражениях органов: обследование у отоларинголога, проведение УЗИ, флюорографии и некоторых других.
Тактику лечения подбирают с учетом выявленных нарушений и устойчивости микробов к медикаментам. Терапию проводят врачи различных профилей: гинекологи, терапевты, пульмонологи, дерматологи. Для подавления активности инфекционной микрофлоры больным назначают курс антибиотиков. Против стрептококков эффективны Азитромицин, Эритромицин,препараты из ряда фторхинолонов: Ципрофлоксацин, Левофлоксацин. Покупать и применять медикаменты важно по назначению врача. Самодеятельность в этом вопросе приводит к развитию суперинфекций. Терапию дополняют также иммуномодулирующими средствами.
Предотвратить развитие стрептококковых заболеваний помогают санитарные меры, закаливание, использование антисептических средств.
Все представленные на сайте материалы предназначены исключительно для образовательных целей и не предназначены для медицинских консультаций, диагностики или лечения. Администрация сайта, редакторы и авторы статей не несут ответственности за любые последствия и убытки, которые могут возникнуть при использовании материалов сайта.
Авторизуйтесьчтобы оставлять комментарии
Возрастные ограничения 18+
Лицензия на осуществление фармацевтической деятельности ЛО-77-02-011246 от 17.11.2020 Скачать.
Предварительные исследования колонизации пробиотика Streptococcus salivarius K12 на слизистых оболочках верхних дыхательных путей у младенцев
D. A. Power & J. P. Burton & C. N. Chilcott & P. J. Dawes & J. R. Tagg
Аннотация:
В исследования были включены 19 детей с отитом среднего уха, в схему лечения которых после трехдневного курса амоксициллина, назначенного в качестве предподготовки больных детей к установке тимпаностомической трубки, был включен Streptococcus salivarius K12 (препаративная форма – порошок). У двух детей штамм K12 оказывал эффект подавления природных популяций ингибитора S. salivarius. У других детей колонизация штамма K12 распространялась за пределы полости рта, захватывая носоглотку или лимфоидную ткань. У относительно небольшого количества пациентов (33%) колонизация была характерным признаком неудачного применения амоксициллина для предподготовки больных, что значительно уменьшило количество местных популяций S. salivarius перед применением штамма K12 в форме порошка.
Received: 14 April 2008 /Accepted: 29 May 2008
©Springer-Verlag 2008
D. A. Power : J. R. Tagg
Department of Microbiology and Immunology,
University of Otago, P.O. Box 56, Dunedin, New Zealand
e-mail: john.tagg@stonebow.otago.ac.nz
J. P. Burton : C. N. Chilcott : J. R. Tagg
BLIS Technologies Ltd., Dunedin, New Zealand
P. J. Dawes
Otolaryngology and Head and Neck Surgery,
Department of Medical and Surgical Sciences,
University of Otago, Dunedin, New Zealand
Отит среднего уха – одно из распространенных бактериальных заболеваний детей во всем мире. Частые рецидивы болезни могут привести к хирургическому вмешательству или к такому серьезному осложнению, как потеря слуха[1]. В последнее время, все чаще, в качестве альтернативы антибиотикотерапии используются пробиотики, уменьшающие случаи рецидивов заболевания[2,3].
Главными претендентами, которые могли быть использованы в качестве пробиотиков являются альфа-гемолитические стрептококки: Streptococcus mitis, Streptococcus sanguinis и Streptococcus oralis [2], благодаря их способности препятствовать росту главных патогенов, вызывающих инфекции респираторного тракта in vitro. К сожалению, каждый из этих видов относительно часто влияет на развитие инфекционного эндокардита [4].
Совсем недавно негемолитический Streptococcus salivarius K12 (бактерия, которая имеет низкий патогенный потенциал) [5], стала широко использоваться в качестве пробиотика ротовой полости для поддержания в здоровом состоянии слизистой оболочки полости рта и контроля неприятного запаха изо рта.
Сильная ингибиторная активность штамма K12 обусловлена его способностью производить несколько бактериоцинов, включая лантибиотик саливарицин A2 и саливарицин B, закодированные в мегаплазмиде (180-kb) [6, 7].
Доступная форма штамма K12 в виде таблеток, которые состоят из сублимированных и спрессованных клеток, не подходит для младенцев. Применение таблетированной формы может вызвать удушение. В данном исследовании для детей была выбрана порошкообразная форма, вследствие ее эффективной доступности для верхних дыхательных путей.
Порошкообразная форма, которая содержит мальтодекстрин, ксилит и лиофилизированные клетки штамма K12, была предоставлена BLIS Technologies Ltd (Dunedin, New Zealand). Продукт был протестирован на стабильность при 4°С и 25 °С в течение 6 месяцев и показал стабильную жизнеспособность клеток штамма при 4°С, а при 25°С – уменьшение колонийобразующих единиц на грамм с 1,7 × 10 в 10 степени до 5,0 × 10 в 9 степени. Перед началом исследования этическое одобрение было получено от Комитета по Этике города Отаго (Новая Зеландия).
В исследование были включены девятнадцать детей, которые находились в госпитале города Дунедина (возрастной диапазон от 6 месяцев до 5 лет), которых готовили для введения тимпаностомической трубки. За две недели до операции данным пациентам был назначен амоксициллин (125 мг, два раза в день в течение 3 дней), для временного снижения уровня природных популяций стрептококков в ротовой полости, чтобы облегчить последующую колонизацию штаммов K12 в пробиотической форме.
После предварительной терапии антибиотиками, язык ребенка обрабатывали 1 г порошкообразной формы штамма K12 (эквивалентной одной чайной ложке порошка) два раза в день, в течение 10 дней до операции. Для исследования был взят соскоб микробиоты с языка перед антибиотикотерапией, а также во время операции получали материал микробиоты с языка и носоглотки. В некоторых случаях (с согласия родителей) были взяты образцы микробиоты лимфоидной ткани.
Специфическое определение наличия стрептококка в образцах проводилось на питательной среде Mitis Salivarius Agar (Becton, Dickinson and Company, Baltimore,MD). Уровень колонизации пробиотических штаммов первоначально оценивался с помощью метода одновременного антагонистического теста, определяя свойства типичных (больших мягких и бледно голубых) колоний S.salivarius, присутствующих в mitis-sаlivarius культуре.
Исследовалась агаровая культура с широкими зонами ингибирования в «газонной культуре» индикаторного штамма I1 (Micrococcus luteus) и штамма I3 (Streptococcus anginosus)[8]. Использовался метод ERIC-ПЦР-генотипирования (9) по консенсусу энтеробактериального повтора (ERIC), представленного устойчивым ингибированием колоний с целью отличия колоний, имеющих характеристики ERIC-профиля штамма K12 от других устойчиво ингибирующих S. salivarius, которые могли присутствовать в биоматериале до применения штамма K12. Для дальнейшей характеристики выделенных объектов исследования был использован ПЦР-метод для структурирования генов штаммов К12 лантибиотиков SaLA2 и SalB (7).
В последующих исследованиях штамма K12 у 10 из 19 детей было обнаружено необратимое стойкое ингибирование колониями S.salivarius. ПЦР тестирование показало, что K12-подобные ЕRIC профили у всех представителей сильно ингибировали пост-колонии, изолированные у шести детей, первоначально имеющих скрытые неподдающиеся ингибированию группы негативных популяций S. Salivarius.
Реакции на добавление штамма K12 были различны у каждого из четырех детей, которые имели ранее популяции, сильно ингибирующие S. salivarius. У ребенка под номером 2 не было отмечено повышение ингибирующей способности при низком содержании S.salivarius.
У ребенка под номером 8, уже имелась популяция бактерий подобных K12 (по данным ERIC) и их соотношение с K12-подобным S. salivarius существенно увеличилось, после воздействия штаммом K12.
У ребенка под номером 9 так же преобладали устойчивые ингибирующие колонии S. salivarius, но они отличались от K12-ERIC. В общей численности колоний не выявлено изменений при воздействии штаммом K12.
Анализ пробы взятой у ребенка под номером 15, показал значительное увеличение в пропорции популяций, отличных от штамма K12- ингибирующих колоний S. salivarius.
Очевидно, увеличение популяций, ранее образованных BLIS-производящими предшественниками, напоминает более ранние результаты исследования детей на SalA-производящие колонии S. Salivarius, которые, как уже было показано, заметно увеличивают их соотношение. Только одна из проб из носоглотки была положительна культуре штамма K12. Из 7 проб аденоидов только 3 были положительны.
Исследования показали, что применение порошкообразного K12-подобного S.salivarius приводит к образованию колоний у 6 из 18 детей (33%). Эти показания существенно ниже, чем при применении BLIS K12 ThroatGuard™, производительность которых составляет 80%. Более низкие показатели, могут быть обоснованы меньшим временным контактом порошкообразной формы с полостью рта, в отличие от таблетированной формы.
Так как штамм K12 чувствителен к амоксициллину, показатели колонизации, достигнутой при применении штамма в день применения амоксициллина, могут быть относительно низкими. Другая возможная причина низких показателей колонизации – неудачный режим предварительной антибиотикотерапии, направленной на уменьшение содержания врожденного S. salivarius.
Восстановление многих преколонизаций S. salivarius в полости рта у детей, включенных в эти исследования, показывает определенную степень устойчивости к амоксициллину (результат не показан). Таким образом, относительно высокое содержание амоксициклин-устойчивых колоний S.salivarius может быть результатом традиционного лечения этих детей. Участвующие в эксперименте дети многократно болели отитом среднего уха. Как показывает практика, данные инфекции обычно лечатся амоксициллином.
Таб. Колонизация Streptococcus salivarius K12
Участник
исследования
Предварительния
колонизация