suv max накопление что это
Соотношение SUVmax с патологическими характеристиками первичной опухоли и значение отношения SUVmax к опухолевому / лимфатическому узлу для прогнозирования метастазов в лимфатические узлы у пациентов с резецированным НМРЛ
Мы стремились исследовать корреляцию максимального стандартизированного значения поглощения (SUVmax) с патологическими характеристиками первичной опухоли и определить отношение SUVmax опухолевого / лимфатического узла (T / LN), предсказывающее метастазы в лимфатические узлы у пациентов с НМРЛ.
Ретроспективно оценивали 80 пациентов с НМРЛ, у которых была проведено ПЭТ / КТ-исследование при начальной постановке, а затем была проведена хирургическая резекция. Было 100 ПЭТ / КТ позитивных медиастинальных или внутригрудных лимфатических узлов. Патологические характеристики опухоли, такие как наибольший диаметр опухоли, гистология опухолей, дифференцировка, число митозов, степень воспаления стромы, некроз; этиология PET / CT положительных станций лимфатических узлов; Было зарегистрировано SUVmax первичных опухолей и положительных станций лимфатических узлов. Для каждой станции лимфатических узлов рассчитывали отношение SUV max к T / LN.
SUVmax первичной опухоли положительно коррелировал с наибольшим диаметром опухоли (p = 0,001, r = 0,374), количеством митозов (p 0,05).
Отношение T / LN SUVmax 5 или ниже указывает на наличие злокачественного лимфатического узла с чувствительностью 92,8% и спецификой 47% (p = 0,01) (рисунок 2).
Кривая рабочих характеристик приемника (ROC) для оптимального значения обрезания для отношения SUVmax опухолевого / лимфатического узла. Площадь под кривой: 0,716; 95% доверительный интервал: 0,584-0,847; р = 0,01. Отношение T / LN SUVmax 5 или ниже указывает на то, что лимфатический узел является злокачественным с чувствительностью 92,8% и специфичностью 47%.
Настоящее исследование показало, что SUVmax первичной опухоли положительно коррелирует с наибольшим диаметром опухоли, количеством митозов и патологической стадией заболевания. Среднее значение SUVmax и количество митозов были выше в SCC по сравнению с AC. N ступеней были продвинуты в ГТК. Реактивная гиперплазия и антракоз были основной этиологией для положительных лимфатических узлов на ПЭТ / КТ. Отношение T / LN SUVmax 5 или ниже указывает на злокачественный лимфатический узел с высокой чувствительностью (92,8%), но с низкой специфичностью (47%).
Деятельность FDG, другими словами, SUVmax, измеренная на PET / CT, является полуколичественным значением, которое указывает на степень поглощения глюкозы при поражении. Точный механизм поглощения ФДГ остается неизвестным. Большинство раковых опухолей легких накапливают ФДГ преимущественно, что SUVmax может широко варьироваться [11,18]. SUVmax опухоли является продуктом нескольких фундаментальных факторов, включая метаболизм глюкозы и тип / количество клеток, присутствующих в опухоли. Более высокий SUVmax может быть результатом либо более высокой митотической активности опухолевых клеток, либо большего количества воспалительных клеток (лимфоцитов, макрофагов), которые конкурируют с использованием ФДГ-глюкозы. Альтернативно, может быть большое количество опухолевых клеток с низкой метаболической активностью или с низким числом опухолевых клеток с высокой метаболической активностью [11]. В настоящем исследовании мы обнаружили положительную корреляцию между опухолевым SUVmax и числом митозов, поддерживающим роль более высокой митотической активности в механизме поглощения ФДГ. Не было корреляции между опухолевым SUVmax и степенью воспаления стромы.
Размер опухоли и наличие некроза являются другими факторами, которые влияют на SUVmax опухоли. Предыдущие исследования продемонстрировали положительную корреляцию между диаметром опухоли и SUVmax 21. Увеличение диаметра опухоли также коррелировало с увеличением экспрессии глюкозы-транспортера-1 (Glut-1) на поверхности опухолевых клеток, что привело к увеличению поглощения ФДГ [23]. В этом исследовании наибольший диаметр опухоли был положительно коррелирован с SUVmax в AC, SCC и всей исследуемой группе. Как и ожидалось, более крупные опухоли были более некротическими. Вопреки общепринятой мудрости, что некроз опухоли разбавляет стандартную величину поглощения, больше некроза не связано с более низким SUVmax. Не было никакой корреляции между SUVmax и степенью некроза. Это условие можно объяснить тем, что SUVmax рассчитывается из самых высоких областей поглощения ФДГ опухоли.
В соответствии с предыдущими исследованиями [6,19,21,22,24] это исследование показало, что SCC имеет более высокие значения SUVmax по сравнению с AC. Это можно объяснить двумя способами. Во-первых, ГТК являются быстро растущими опухолями с более коротким периодом удвоения, что приводит к более высоким уровням метаболизма глюкозы [18]. Во-вторых, экспрессия Glut-1 выше в SCC. Локализация Glut-1 также важна в процессе поглощения FDG. Хотя Glut-1 в основном находится в цитоплазме опухолевых клеток в AC, он в основном расположен на клеточных мембранах опухолевых клеток в SCC. Локализация клеточной мембраны более важна в процессе поглощения ФДГ [25, 26].
Связь между опухолевым SUVmax и дифференцировкой противоречива в литературе. Некоторые исследования показали, что опухоль SUVmax была выше в слабо дифференцированных НМРЛ [22,28]. В другом исследовании не было обнаружено корреляции между SUVmax и степенью дифференцировки в SCC [19]. В настоящем исследовании не было никакой связи между опухолевым SUVmax и дифференцировкой в SCC. Но степень стромального воспаления была выше при плохо дифференцированных опухолях.
Установлено, что более высокий SUVmax первичной опухоли является сильным предиктором инвазии лимфатических сосудов и метастазирования лимфатических узлов в исследованиях, состоящих из ранних пациентов с НМРЛ раннего периода [21,29]. В исследовании, проведенном на небольшой группе резецированных пациентов с раком легких, авторы исследовали корреляцию SUVmax с вероятностью метастазирования лимфатических узлов и сообщили, что, когда SUVmax первичной опухоли больше 12, вероятность метастазирования лимфатических узлов была высокой, достигая 70%, независимо от степени активности ФДГ в узлах лимфатических узлов [6]. В настоящем исследовании опухоль SUVmax коррелировала с патологическим T-этапом, стадией заболевания, но не с N-стадией. Средняя опухоль SUVmax не отличалась у пациентов с метастатическими лимфатическими узлами и без них (таблица 6). В отличие от текущей литературы, в которой сообщается о гистологии AC как фактор риска для оккультных метастазов лимфатических узлов N2 [12,13], в этом исследовании N-этапы были продвинуты в SCC, которые имеют более высокий SUVmax по сравнению с AC.
В настоящее время ПЭТ / КТ считается наиболее точным методом визуализации в N-постановке рака легких. Однако существует значительное количество ложной позитивности и ложной негативности. Основной причиной ложной негативности является микроскопический метастаз вне пространственного разрешения ПЭТ / КТ. Основными причинами ложной положительности являются вовлечение лимфатических узлов подстилающим воспалительным заболеванием (туберкулез, гистоплазмоз), лимфаденопатиями, вторичными по отношению к обструктивной пневмонии, иммунной реакцией из-за наличия опухоли легкого, антракоза и силикотических узлов [6,8]. Основная причина ложной позитивности может варьироваться от региона к региону. В исследовании из Алабамы инфекция гистоплазмоза была наиболее распространенной причиной ложной позитивности [7]. Было установлено, что силикоз является причиной ложной позитивности в исследовании из Германии [30]. В настоящем исследовании, в 40% случаев положительных лимфоузлов ПЭТ / КТ наблюдался антракоз, вероятно, из-за интенсивного загрязнения воздуха внутри помещений или воздействия биомассы. Гранулематозное воспаление (4%) и силикоз (3%) были низкими.
В настоящем исследовании, отличном от литературы, мы рассматривали станцию лимфатических узлов как положительную, если было обнаружено поглощение ФДГ выше, чем окружающая средостенная ткань, в связи с идеей о том, что опухоль с низкой активностью ФДГ может иметь метастатический лимфатический узел с низкая активность FDG. Таким образом, мы устанавливаем низкий порог (любое поглощение ФДГ выше, чем окружающий медиастинальный пул крови), чтобы избежать ложноотрицательных лимфатических узлов и принимать более высокую частоту ложных срабатываний. Все метастатические лимфатические узлы имели SUVmax выше 2,5. Чувствительность (63,6%) и специфичность (72,4%) ПЭТ / КТ была ниже, чем текущая литература, из-за более низкого порога, который мы выбираем для позитивности ПЭТ / КТ.
В настоящем исследовании мы предположили, что отношение T / LN SUVmax может быть предиктором метастазирования лимфатических узлов. Эта гипотеза была основана на клиническом наблюдении, что значение отсечки 2,5 для прогнозирования метастазов слишком низкое в странах, где воспалительные реакции более предрасположены. Кроме того, в клинической практике мы поняли, что некоторые опухоли с низкими значениями SUVmax имеют метастатические лимфатические узлы после резекции, несмотря на более низкие значения SUVmax, чем 2,5 на PET / CT, полученные до операции. Настоящее исследование одобряет эту гипотезу. Как показано в таблице 6, в то время как средние значения SUVmax не различались между метастатическими и неметастатическими лимфатическими узлами, отношение T / LN было значительно ниже в метастатических. Отношение T / LN SUVmax было сходным в антракотических и реактивных лимфатических узлах. Отношение T / LN SUVmax 5 или ниже указывает на злокачественный лимфатический узел с высокой чувствительностью, но с низкой специфичностью. Поскольку это исследование проводится в популяции, где распространенность воспалительных заболеваний высока, отношение T / LN SUVmax может демонстрировать вариации в разных популяциях пациентов.
В литературе Cerfolio et al также определили отношение LN / T SUVmax как универсального предиктора метастазирования лимфатических узлов, чтобы исключить изменение SUVmax среди разных сканеров ПЭТ, и задокументировали, что, когда отношение составляет 0,56 или выше, существует 94% вероятность того, что узел злокачественный [31].
Существуют некоторые ограничения настоящего исследования. Во-первых, это ретроспективное исследование с ограниченным числом пациентов. Исследовательская популяция состоит из пациентов, которые подверглись хирургическому вмешательству только, что может привести к смещению выбора. Поскольку во всех случаях были ранние раковые заболевания легких, которые были кандидатами на лечебную хирургию, количество метастатических лимфатических узлов было низким. Проспективные исследования, в том числе больше станций лимфатических узлов, необходимы для проверки валидации отношения SU / MAX T / LN для прогнозирования метастазов.
В заключение, SUVmax первичной опухоли связан с некоторыми патологическими характеристиками, такими как наибольший диаметр, гистология и число митозов. Коэффициент SUVmax T / LN ниже 5 предсказывает метастаз в лимфатические узлы с высокой чувствительностью.
SUVmax: максимальное стандартизированное значение поглощения; ПЭТ / КТ: позитронно-эмиссионная томография с компьютерной томографией; T / LN: опухоль / лимфатический узел; ФДГ: фтордезокси глюкоза; НМРЛ: немелкоклеточный рак легких; AC: аденокарцинома; SCC: Плоскоклеточная карцинома.
Все авторы раскрывают, что не существует какого-либо фактического или потенциального конфликта интересов, включая любые финансовые, личные или иные отношения с другими людьми или организациями, которые могут ненадлежащим образом влиять (предвзято) на их работу.
DK разработало исследование, собрало данные, интерпретировало результаты и разработало статью. FD провела патологическую оценку. HB задумал исследование, участвовал в его разработке и координации и помог разработать рукопись. OO провела интерпретацию изображений PET / CT. ET провела интерпретацию изображений PET / CT. BB участвовал в разработке исследования и проводил статистический анализ. КА участвовала в разработке исследования и координации. EY участвовала в разработке исследования и координации. Все авторы прочитали и утвердили окончательную рукопись.
Suv max накопление что это
Единый центр записи на ПЭТ/КТ в городах РФ.
Платно или по ОМС (только в Москве).
Все виды: глюкоза, холин, метионин, галлий.
ЕДИНЫЙ ЦЕНТР ЗАПИСИ НА ПЭТ/КТ
+7 (499) 753-77-85
ПЭТ/КТ с глюкозой делается в 15 городах России на платной основе и СРОЧНО!
ПЭТ с метионином делается только на платной основе и только в Санкт-Петербурге.
ПЭТ с тирозином делается только на платной основе и только в Уфе.
Помимо ПЭТ, всем нашим пациентам мы можем предложить эффективное лечение: пересмотр гистологии, лечение в ведущих клиниках Москвы и за границей.
20 интересных фактов о ПЭТ/КТ
1. Первые упоминания о ПЭТ появились в 50-х годах XX века.
2. Уже в 1972 году этот вид диагностики получил широкое распространение в США.
3. В России первое обследование ПЭТ было проведено в 1997 году.
20 интересных фактов о ПЭТ/КТ
4. Точность полученной при сканировании информации достигает 99%, тогда как при КТ и МРТ этот показатель в среднем составляет 70-85%.
5. В Европе лидер по ПЭТ/КТ исследованиям — Германия, где свыше 100 клиники имеет соответствующее оборудование, тогда как в России их число не превышает 30.
20 интересных фактов о ПЭТ/КТ
6. Результаты ПЭТ/КТ используют три отрасли медицины — онкология, кардиология, неврология.
7. Доза радиации при ПЭТ/КТ обследовании не превышает облучения при обычном рентгене.
8. Некоторые виды ПЭТ/КТ в России не проводятся. Например, обследование с галлием 68.
20 интересных фактов о ПЭТ/КТ
9. Диагностика ПЭТ/КТ выявляет опухоли на более ранних стадиях, чем КТ или МРТ, потому что метаболические нарушения можно зафиксировать тогда, когда структурные изменения еще отсутствуют.
10. В большинстве случаев информативность полученных снимков оказывается выше, чем у проведенной биопсии пораженного болезнью органа. Особенно это справедливо для обследования головного мозга с метионином.
20 интересных фактов о ПЭТ/КТ
11. ПЭТ/КТ — единственная возможность обнаружить метастазы при онкологии. При обследованиях с помощью КТ и МРТ метастазы выглядят только как затемнения на снимках. Врач может лишь предполагать о наличии онко-маркеров, тогда как при ПЭТ/КТ удается «увидеть» метастазы, получить исчерпывающую информацию об их расположении и качестве.
12. Методика позволяет обнаружить патологии размером до 1 мм.
20 интересных фактов о ПЭТ/КТ
13. В России ПЭТ/КТ есть только в 9 городах: Москве, Санкт-Петербурге, Воронеже, Екатеринбурге, Уфе, Курске, Орле, Тамбове, Липецке. Стоимость такого обследования в нашей стране намного дешевле, чем в Европе. Поэтому нет смысла ехать в Германию и Израиль где процедура стоит намного дороже.
14. с 2016 года в России ПЭТ КТ можно сделать бесплатно по полису ОМС. Для этого нужно получить соответствующее направление от врача и записаться на обследование в одной из клиник, где доступна эта услуга.
20 интересных фактов о ПЭТ/КТ
15. После ПЭТ/КТ нет необходимости в других видах диагностики — обычно это исследование дает ответы на все вопросы.
16. Ошибки при ПЭТ/КТ связаны только с человеческим фактором: неверной трактовкой результатов, неправильной подготовкой к обследованию, нарушением технологии сканирования и др.
20 интересных фактов о ПЭТ/КТ
17. Большинство опухолей активно питается глюкозой, поэтому для обследования чаще всего используют РФП 18F-фтордезоксиглюкозу — она накапливается в онкологическом очаге. Однако этот РФП не подходит для исследования головного мозга, который всегда активно поглощает это вещество.
18. Единственное абсолютное противопоказание для обследования — беременность. Остальные входят в разряд относительных.
20 интересных фактов о ПЭТ/КТ
19. В некоторых случаях проводят ПЭТ/КТ с контрастом — помимо радиоферментов пациенту вводят контрастное йодсодержащее вещество, повышающее точность и информативность обследования.
20. От качества подготовки к ПЭТ/КТ зависит и точность полученных данных. Пациенту предписывают соблюдать специальную диету и не перенапрягаться за 2-3 дня до сканирования.
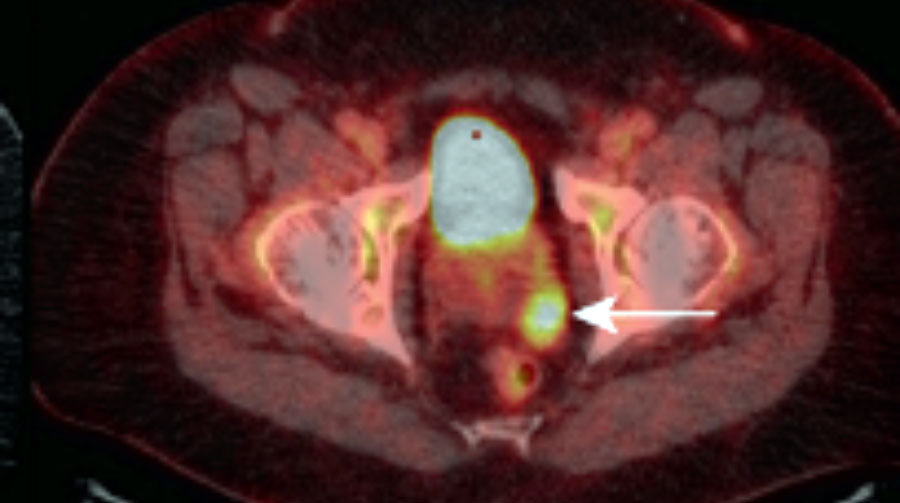
Стандартизированный уровень накопления (SUV) при ПЭТ-КТ
На фото: очаг рака в простате, выявляемый при ПЭТ – КТ
Так как же отличить здоровую ткань от «нездоровой»?
Для этого в медицине используется термин – SUV. Переводится Standardized Uptake Value с английского как оценка стандартизированного уровня накопления. Речь идет о полуколичественном измерении поглощения вещества в тканях. Для проведения ПЭТ – КТ пациенту вводят минимальное количество молекул (чаще всего глюкозы), меченых радиоактивным изотопом. Чем больше вещества, вводимого при исследовании, накапливается в тканях органа, тем выше вероятность, что в тканях есть злокачественные клетки. Многие факторы влияют на показатель поглощения, включая вес тела, движения пациента во время исследования, уровень глюкозы в крови и даже тип опухоли. SUV используется, чтобы отличить «нормальный» от «ненормального» уровни поглощения. При показателях SUV более 2,5 ткань чаще рассматривается как потенциально злокачественная, однако существуют и не злокачественные заболевания, для которых характерны показатели SUV более 2,5. Показатели SUV, имеющие диапазон от 2,0 до 2,5, считаются наиболее сложными для дифференциального диагноза.
Доброкачественные заболевания, такие как воспалительные или инфекционные, могут так же привести к увеличенному поглощению препаратов тканями при ПЭТ – КТ. Для дифференциальной диагностики доброкачественных и злокачественных образований необходимы данные анамнеза и дополнительных исследований, таких как УЗИ, КТ, МРТ, гистологическое исследование, анализ крови на онкомаркеры и т.д.
Согласно данным Katherine Mah MSc, опубликованным в журнале «PET-CT in Radiotherapy Treatment Planning», именно при опухолях легких наибольшее количество ошибок. Это связано с дыхательными движениями, которые и становятся основным источником ошибок.
Материалы конгрессов и конференций
X РОССИЙСКИЙ ОНКОЛОГИЧЕСКИЙ КОНГРЕСС
ПЭТ В ОНКОЛОГИЧЕСКОЙ КЛИНИКЕ
А.М. Гранов, Л.А. Тютин, Н.А. Костеников, Д.В. Рыжкова, М.С. Тлостанова,
А.А. Станжевский, Д.Б. Фрейдман, А.А. Балабанова
Центральный научно-исследовательский рентгенорадиологический институт Росздрава, Санкт-Петербург
Онкологические заболевания относятся к числу наиболее распространенных среди населения экономически развитых стран и занимают лидирующее положение по показателям смертности. Так, в США ежегодно регистрируются около 1,5 млн. случаев злокачественных опухолей и более 560 тыс. больных в год умирает. Хорошо известно, что исход онкологических заболеваний во многом зависит от своевременной диагностики и объективной оценки эффективности проводимого лечения. Однако, несмотря на внедрение в клиническую практику высокоинформативных методов диагностики (УЗИ, СКТ, МРТ и др.), большая часть больных поступает в медицинские центры уже с запущенными стадиями заболевания, а адекватность проводимых лечебных мероприятий своевременно не оценивается. В связи с этим дальнейшее совершенствование методов диагностики является весьма актуальным. По мнению специалистов, наиболее перспективным в этом отношении может быть всестороннее изучение и внедрение в клиническую практику позитронной эмиссионной томографии (ПЭТ), позволяющей получать уникальную информацию о метаболизме и перфузии нормальных и патологически измененных тканей на клеточно-молекулярном уровне. Эти данные могут иметь решающее значение для диагностики и дифференциальной диагностики злокачественных опухолей на ранних этапах их развития. Кроме того, с помощью ПЭТ удается своевременно установить изменения, происходящие в опухоли под влиянием лекарственной и лучевой терапии, а также выявить признаки продолженного роста или рецидива новообразования. Однако имеющиеся в литературе данные свидетельствуют о том, что многие аспекты использования ПЭТ в онкологии изучены недостаточно. В настоящее время весьма противоречивым является вопрос об эффективности ПЭТ при различных опухолях. Так, согласно данным систематизированного анализа возможностей ПЭТ в онкологии III всеобщей конференцией врачей ФРГ признана недоказанной эффективность использования этого метода при раке щитовидной железы, пищевода, опухолях костей и мягких тканей, рецидиве и оценке эффективности лечения рака молочной железы, феохромацитоме, опухолях головы и шеи, низкодифференцированной лимфоме Ходжкина. Однако в ряде других публикаций имеются сведения об успешном применении ПЭТ при большинстве из указанных онкологических заболеваний. Очевидно, что использование ПЭТ в онкологической клинике, по существу, находится в начале своего пути. Широкому внедрению метода должно предшествовать полное, всестороннее изучение его диагностических возможностей с применением различных технологий исследования и специфических туморотропных препаратов.
В настоящем сообщении нами обобщен коллективный 9-летний опыт применения ПЭТ при обследовании больных онкологического профиля.
Всего обследованы более 5000 пациентов, которым выполнены 7220 исследований. При этом опухоли различных локализаций выявлены у 2045 больных. Распределение онкологических больных в зависимости от нозологической формы опухолевого заболевания представлено в табл. 1.
Таблица 1.
Распределение онкологических больных по диагнозу.
| Нозологическая форма | Число обследованных больных | |
|---|---|---|
| Количество | % | |
| Объемные образования головного мозга | 542 | 26,5 |
| Рак молочной железы | 192 | 9,4 |
| Злокачественные опухоли печени | 381 | 18,6 |
| Рак поджелудочной железы | 240 | 11,7 |
| Лимфопролиферативные заболевания | 128 | 6,3 |
| Рак легкого | 117 | 5,7 |
| Герминогенные опухоли | 82 | 4 |
| Рак предстательной железы | 53 | 2,6 |
| Колоректальный рак | 119 | 5,8 |
| Меланома | 67 | 3,3 |
| Прочие | 124 | 6,1 |
| Всего | 2045 | 100 |
ПЭТ в нейроонкологии. Всего обследованы 542 больных с объемными образованиями головного мозга. Основную группу составили пациенты с опухолями глиального ряда (преимущественно злокачественными), метастатическим поражением головного мозга и менингиомами. Результаты ПЭТ больных со злокачественными новообразованиями головного мозга представлены в табл. 2 и 3.
Таблица 2.
КДН, полученные при ПЭТ с различными РФП у больных со злокачественными новообразованиями головного мозга.
Таблица 3.
Информативность ПЭТ с различными РФП при диагностике злокачественных новообразований головного мозга.
| Название методики | Чувствительность (%) | Специфичность (%) | Диагностическая точность (%) |
|---|---|---|---|
| ПЭТ с 18 F-ФДГ (n=385) | 82,2 | 99,6 | 94,8 |
| ПЭТ с 11 C-БН (n=159) | 94,1 | 82,4 | 88,7 |
| ПЭТ с 11 C-метионином (n=33) | 84,6 | 65,0 | 72,7 |
| ПЭТ с 18 F-ФДГ и 11 C-БН (n=36) | 96,0 | 100,0 | 97,2 |
Рак молочной железы (РМЖ). ПЭТ с 18 F-ФДГ выполнена 192 больным раком молочной железы. В 141 случае исследование проводилось до операционного вмешательства. При этом в 21 случае ПЭТ одним и тем же больным проводилась дважды: до начала и после завершения неоадъювантной химиотерапии. Кроме того, 51 больной ПЭТ с 18 F-ФДГ проведена после удаления первичного очага с целью определения регионарных и отдаленных метастазов.
Таблица 4.
Диагностические показатели ПЭТ с 18 F-ФДГ у пациенток в основной и контрольной клинических группах.
| Клиническая группа | Количество пациенток | Характер накопления РФП | SUVmax | SUVmean |
|---|---|---|---|---|
| Фиброзно-кистозная мастопатия | 55 | Диффузно-неравномерное | 1,50±0,08 | 1,12±0,03 |
| Рак молочной железы | 139 | Очаговое | 3,71±0,21 | 2,33±0,08 |
Во всех случаях для злокачественной опухоли было характерно повышенное накопление РФП в зоне поражения. Визуализировать злокачественное новообразование не удалось лишь в 3 случаях в связи с крайне малыми размерами первичного очага (ниже разрешающей способности метода). Ложноположительное заключение сделано в 1 случае при наличии у пациентки с фиброзно-кистозной мастопатией воспалительного процесса. Чувствительность, специфичность и диагностическая точность ПЭТ с 18 F-ФДГ при РМЖ составила 97,8%, 98,2% и 98,0%, а при поражении регионарных лимфоузлов – 92,0%, 100% и 97,8% соответственно.
Рак поджелудочной железы (РПЖ). Распределение обследованных больных по диагнозу представлено в табл. 5.
Таблица 5.
Распределение больных с объемными образованиями поджелудочной железы по диагнозу.
| Характер патологии | Количество больных | |
|---|---|---|
| n | % | |
| Рак поджелудочной железы | 150 | 62,5 |
| Хронический псевдотуморозный панкреатит в стадии ремиссии | 81 | 33,7 |
| Хронический псевдотуморозный панкреатит в стадии обострения | 9 | 3,8 |
| Всего | 240 | 100,0 |
Первичные опухоли печени и метастазы. Нами было обследован 381 пациент с первичными опухолями печени и метастазами. Контрольную группу составили 65 пациентов с нормальной паренхимой печени и доброкачественными новообразованиями. Распределение больных в зависимости от морфологического типа поражения и метаболической активности злокачественной опухоли представлено в табл. 6.
Таблица 6.
Распределение больных в зависимости от морфологического типа поражения и метаболической активности злокачественной опухоли.
| Морфологический тип опухоли | Количество больных | SUVмакс | SUVср | |
|---|---|---|---|---|
| n | % | |||
| Холангиоцеллюлярный рак | 31 | 8,1 | 3,00±0,15 | 2,05±0,09 |
| Гепатоцеллюлярный рак | 54 | 14,2 | 2,22±0,25 | 1,63±0,13 |
| Метастатическое поражение печени | 296 | 77,7 | 4,76±0,21 | 2,86±0,11 |
| Всего | 381 | 100 | ||
В 189 из 192 случаев злокачественного поражения паренхимы печени нами были получены истинноположительные результаты. Ложноположительные данные определялись у 2 пациентов с локальным нарушением перфузии печени. Таким образом, чувствительность, специфичность и диагностическая точность метода составили 98,4%, 96,9% и 98,0% соответственно.
Таблица 7.
Распределение больных лимфопролиферативными заболеваниями в зависимости от метаболического ответа опухоли на проводимое лечение (n=54).
| Выраженность метаболического ответа | Количество больных | SUVмакс до лечения | SUVмакс после лечения | SUVср до лечения | SUVср после лечения | |
|---|---|---|---|---|---|---|
| n | % | |||||
| Полная метаболическая ремиссия | 28 | 51,8 | 3,00±0,15 | Отсутствие накопления | 2,22±0,25 | Отсутствие накопления |
| Частичная метаболическая ремиссия | 14 | 25,9 | 4,76±0,21 | 4,1±0,18 | 2,31±0,15 | 2,10±0,10 |
| Стабилизация процесса | 8 | 14,9 | 3,93±0,25 | 3,89±0,27 | 2,67±0,21 | 2,56±0,19 |
| Прогрессирование заболевания | 4 | 7,4 | 3,84±0,16 | 5,1±0,19 | 2,93±0,18 | 3,11±0,17 |
Таким образом, представленные данные свидетельствуют о том, что ПЭТ является высокоинформативным методом диагностики большинства наиболее социально значимых злокачественных новообразований, в т.ч. на ранних стадиях их развития, и, как правило, позволяет установить истинные размеры, распространенность и степень злокачественности опухолевого поражения, а также объективно оценить эффективность проводимого лечения. Вместе с тем, накопленный опыт показал относительно низкие диагностические возможности ПЭТ с 18 F-ФДГ при некоторых опухолях головы и шеи, раке почки, предстательной железы (выявление первичного опухолевого узла), раке мочевого пузыря и др. Мировой клинический опыт по использованию для диагностики специфических туморотропных РФП, в силу целого ряда причин, крайне ограничен. До настоящего времени не решен вопрос об оптимальных сроках выполнения контрольных исследований при лечении различных онкологических заболеваний. Требует совершенствования и технология проведения ПЭТ сканирования. Другими словами, очевидно, что диагностические возможности ПЭТ еще далеко не исчерпаны. На базе проводимых исследований эффективность метода должна быть существенно повышена.