vlcad синдром что это
Дефицит ацил-коа дегидрогеназы жирных кислот с очень длинной углеродной цепью
Иллюстрация Георгия Сапего
Генетический механизм заболевания состоит в возникновении мутаций в гене ACADVL, картированном на 17р.13. В результате, дефицит фермента приводит к нарушению процесса расщепления и метаболизма высших жирных кислот, которые поступают в организм с пищей. Как следствие, жирные кислоты накапливаются в организме. Накопление этих соединений оказывает негативное влияние на ткани головного мозга, сердца, печени, ингибирует ряд ферментов. В то же время, организму не хватает энергии, которая должна была бы образоваться в результате распада высших жирных кислот.
Запуск патологических процессов происходит в условиях метаболического стресса – например, при интеркурентных инфекционных заболеваниях, голодании или приеме жирной пищи, физической или эмоциональной перегрузке.
Клинические формы заболевания очень разнообразны. Классифицируют:
· системное заболевание с поражением сердца и печени;
По другой классификации выделяют:
· неонатальную (около половины всех больных);
· детскую с манифестацией на протяжении первых двух лет жизни (около 40% больных);
Для каждой из форм заболевания характерен свой набор симптомов.
Системная форма болезни характеризуется дебютом в новорожденном или раннем возрасте. Заболевание имеет тяжелое течение и высокую летальность, риск внезапной детской смерти. У больных с этим диагнозом появляется резкая мышечная гипотония, приступы рвоты и судорог, прогрессирующая вялость, сонливость. Развивается гипертрофическая или дилатационная кардиомиопатия, желудочковая тахикардия, блокада сердца, гепатомегалия, жировая инфильтрация печени.
Печеночная форма имеет менее тяжелое течение с периодическими приступами гипокетотической гипогликемии.
Миопатическая форма манифестирует у школьников или у взрослых. Ее основные проявления: непереносимость физической нагрузки, боли в мышцах, рабдомиолиз, изменение цвета мочи вследствие миоглобинурии.
В целом, отмечается, что при детской форме первые симптомы появляются, как правило, на протяжении первого года жизни. Поздняя форма характеризуется более благоприятным течением, клинически проявляется болями в мышцах, при этом сердце не вовлекается в патологический процесс.
Наследование аутосомно-рецессивное. Частота встречаемости заболевания в среднем составляет 1:30 000 новорожденных. В России первый лабораторно подтвержденный случай заболевания описан в 2008 г..
При своевременном начале лечения прогноз благоприятный. Возможна пренатальная диагностика с помощью молекулярно-генетического исследования биоптата хориона с выявлением мутации гена ACADVL.
Vlcad синдром что это
Наследуемый дефицит карнитин пальмитоилтрансферазы входит в группу митохондриальных болезней с нарушением бета-окисления жирных кислот. Врождённые дефекты оксидации жирных кислот, особенно интенсивно изучающиеся в последние 10–15 лет, насчитывают, по меньшей мере, 12 заболеваний, согласно количеству ферментов, участвующих в процессе окисления. Указанные метаболические дефекты могут иметь серьезные клинические последствия в виде гипогликемических судорог, повреждения мышц, метаболи ческого ацидоза и поражения печени. Считается, что такие клинические состояния, как рабдомиолиз после физической нагрузки, неясная печеночная энцефалопатия и гипокетонемическая гипогликемия с судорожным синдромом в раннем младенческом возрасте, в большинстве случаев ассоциированы с врожденными дефектами митохондриального окисления жирных кислот. Кроме того, известно, что часть случаев синдрома внезапной смерти младенческого возраста асс оциирована с наличием мутаций, характерных для митохондриальных болезней.
● Митохондриальные болезни (в том числе, болезни нарушения бета-окисления жирных кислот) – 20.3 на 100 000;
● Лизосомальные болезни накопления – 19.3 на 100 000;
● Нарушения обмена аминокислот (исключая фенилкетонурию) – 18.7 на 100 000;
● Органические ацидемии – 12.6 на 100 000;
● Фенилкетонурия – 8.1 на 100 000;
● Пероксисомные болезни – 7.4 на 100 000;
● Болезни накопления гликогена – 6.8 на 100 000;
● Болезни нарушения цикла мочевины – 4.5 на 100 000.
Жирные кислоты (ЖК) с различной длиной углеродной цепи (коротко-, средне- и длинноцепочеч ные) являются компонентами триглицеридов и фосфолипидов. Ос новным источником жирных кислот во время голодания являются триглицериды жировой ткани, которые расщепляются под влиянием липаз (ингибируются инсулином), далее жирные кислоты поступают в печень и активируются путем присоединения ацетил-КоА и формирования комплекса ацетил-КоА-ЖК (процесс этерификации, специфический для каждой жирной кислоты). Комплекс ацетил-КоА-ЖК формируется в цитоплазме гепатоцитов, но для проникновения в митохондрии длинноцепочечных ЖК необходим отдельный метаболический путь с участием карнитина и специфических ферментов.
Метаболический путь с участием карнитин пальмитоилтрансферазы (CPT). Во время фазы насыщения организма фермент ацетил-КоА карбоксилаза активен и конвертирует ацетил-КоА (коэнзим А) в малонил-КоА, которы й ингибирует активность CPT 1 типа. Во время фазы голодани я глюкагон деактивирует ацетил-КоА карбоксилазу путём фосфорилирования. Концентрация малонил-КоА падает, что активирует CPT1, которая, находясь на внешней стороне мембран митохондрий, заменяет молекулы КоА на карнитин в цитоплазматически х длинноцепочечных жирных кислотах (ДЖК). Комплекс карнитин-ДЖК перемещается на внутреннюю часть мембран митохондрий, где посредством CPT 2 типа происходит обратная замена карнитина на ацетил-КоА и комплекс ацетил-КоА-ДЖК поступает во внутренние компартаменты митохондрий для участия в процессе бета-оксидации жирных кислот. Процесс переноса длинноцепочечных ЖК через мембрану митохондрий с участием карнитина и соответствующих ферментов носит условное название «карнитиновый шаттл» (рис. 1).
В отличие от длинноцепочечных жирных кислот (C16-18), коротко- и среднецепочечные жирные кислоты не нуждаются в «карнитиновом шаттле» и способны прямо проникать через митохондриальную мембрану. Эта их способность используется в терапевтических целях путем диетического замещения при состояниях, которые связаны с тем или иным нарушением «карнитинового шаттла» (системный дефицит карнитина, дефицит CPT 1 и 2 типов и т.д.).
Дефекты бета-окисления длинноцепочечных жирных кислот можно разделить на 4 группы, имеющие различающиеся клинические проявления и подходы к терапии:
1. Дефект карнитинового траспортера, ведущий к дефициту карнитина – дефицит OCTN2 (organic cation carnitine transporter 2).
2. Дефекты вышеописанного «карнитинового шаттла» – дефициты CPT1 и CPT2 (carnitine palmitoyl-CoA transferase 1 and 2), дефицит CACT (carnitine acylcarnitine translocase).
3. Дефекты непосредственно процесса бета-оксидации – дефицит VLCAD (very-long-chain acyl-CoA dehydrogenase), дефицит LCHAD (long-chain 3-hydroxyacyl-CoA dehydrogenase), дефицит mTFP (mitochondrial trifunctional protein), дефицит LKAT (long-chain 3-ketoacyl-CoA thiolase), дефицит ACAD9 (acyl-CoA dehydrogenase 9).
4. Множественный дефицит ацетил-КоА дегидрогеназ – MAD (multiple acyl-CoA dehydrogenase) дефицит.Митохондриальные болезни с нарушением бета-окисления жирных кислот в большинстве случаев имеют аутосомно-рецессивный характер наследования, клинические проявления чаще всего интермиттирующие и выявляются в периоды повышенной энергетической потребности. Кризы могут быть связаны с голоданием, стрессом (например, инфекцией) и интенсивной физической нагрузкой. Для большинства указанных метаболических дефектов описаны одна или несколько каузальных мутаций, формирующие различающиеся по степени выраженности клинических проявлений фенотипы.
N. Gregersen с соавт. [6] предложили выделять три клинических фенотипа наследуемого дефицита окисления длинноцепочечных жирных кислот:
2. Манифестация в первые годы жизни с относительно нетяжелым течением. В основном проявляется гипокетонемической гипогликемий при стрессовых условиях (голодание, инфекции) и гепатомегалией вследствие гепатостеатоза. Клинические проявления весьма похожи на MCAD дефицит (см. выше). При соответствующем лечении прогноз благоприятный с полной реверсией стеатоза. Терапия такая же, как и при первом фенотипе.
3. Поздняя манифестация (подростки, взрослые) с преобладанием мышечных симптомов. Характеризуется эпизодами мышечной слабости, болей в мышцах и рабдомиолиза после физической нагрузки. Характерна острая или персистирующая гиперферментемия (увеличение концентраций креатинфософкиназы, аминотрансфераз). Анамнез иногда указывает на наличие признаков 1 или 2 фенотипов в раннем детстве. Соответствующие протективные меры (легкоусвояемые углеводы перед предполагаемой нагрузкой, запрет на занятия профессиональным спортом) позволяют избежать потенциально фатального рабдомиолиза.
Ассоциация клинических проявлений с метаболическим дефектом при врожденных нарушениях митохондриального окисления жирных кислот показана в таблице.
Проведенный в последние годы неонатальный скрининг показал, что многие дети с наличием метаболического дефекта окисления длинноцепочечных жирных кислот (VLCAD – оказался самым частым выявляемым дефектом из этой группы, а также CPT1 и CPT2) остаются бессимптомными на протяжении длительного периода наблюдения [12]. Некоторые VLCAD позитивные пациенты со временем развивают симптомы миопатии. Считается, что в основе благоприятного клинического течения митохондриальных болезней может лежать относительно высокая резуидальная активность затронутого дефектом фермента [12].
Ассоциация клинических проявлений с метаболическим дефектом при врожденных нарушениях митохондриального окисления жирных кислот)
Гипокетонемическая гипогликемия после голодания/катаболического стресса
PCD = primary carnitine deficiency, CACT. CPT1, CPT2, LCHAD, MCAD, SCAD, MTP, VLCAD, ACAD9
Vlcad синдром что это
а) Биохимические изменения. Общие пути митохондриального окисления жирных кислот и различные известные дефекты ферментов представлены на рисунке ниже. Длинноцепочечные жирные кислоты, трансформированные в соответствующие эфиры кофермента А, транспортируются в митохондрии с помощью специфического карнитинового переносчика ацил-карнитина, который включают карнитин-пальмитоилтрансферазу I и II (КПТ-1 и КПТ-II) и карнитин-ацил-карнитин транслоказу (КАТ). Ацилкофермент А со средними и короткими цепями легко диффундирует в митохондрии. Первичный дефицит карнитина, КПТ-I, КПТ-II и транслоказы нарушают митохондриальный транспорт длинноцепочечных жирных кислот и следовательно, бета-окисление и кетогенез.
Дальнейшее бета-окисление затрагивает четыре последовательных этапа с участием ферментов, специфичных к длине цепи. На первом этапе необходима специфическая ацил-кофермент А дегидрогеназа, дегидрогеназы очень-длинно-, длинно-, умеренно-длинно- и короткоцепочечного ацил-кофермента A (VLCAD, LCAD, MCAD, SCAD), которые трансформируют жирные кислоты ацил-кофермента А в еноил-кофермент А. Все четыре дегидрогеназы высвобождают электроны, которые проходят через систему транспорта электронов дыхательной цепи. Специфическая система переноса электронов распределена между другими дегидрогеназами флавопротедов: глутарил-кофермент А и изовалерил-кофермент А дегидрогеназами.
Три оставшихся этапа бета-оксиления длинноцепочечных жирных кислот могут протекать под действием единственного трехфункционального белка (ТФБ) для субстратов с длинными цепями или под действием монофункциональных ферментов — для субстратов с короткими и умеренными цепями. Каждый четырехэтапный цикл бета-окисления приводит к высвобождению ацетил-кофермента А, который участвует в цикле Кребса в таких тканях, как сердце и мышцы. В печени в случае голодания ацетил-кофермент А превращается в кетоны (кетогенез), которые переносятся в периферические органы, такие как мозг, для окончательного окисления (кетолиза) и высвобождения энергии. Известные дефекты митохондриального бета-окисления приведены в таблице ниже. Дефицит множественной ацил-кофермент А дегидрогеназы (МАД), также называемой глутаровой ацидурией II типа, вызван дефектом системы передачи электронов. Несколько альтернативных путей приобретают значимость при нарушении митохондриального бета-окисления.
Омега-оксиление в микросомах приводит к образованию характерных дикарбоновых кислот, а интрамитохондриальная конъюгация ацил-кофермента А с глицином и карнитином является важном механизмом детоксикации.
Биохимическая диагностика основана на выявлении аномальных дикарбоновых кислот и сопутствующих продуктов (глицина, карнитина) в моче. Глутаровая ацидурия и ацидурии органических кислот с разветвленными цепями сочетаются с дефицитом МАД. Следует подчеркнуть, что данные специфические показатели лучше всего выявляются при обострении, в то время как в стабильном состоянии наиболее достоверными тестами являются определение общего и эстерифицированного карнитина плазмы и аномальных показателей ацил-карнитина в плазме или в сухой капле крови. Определение скорости окисления жирных кислот в свежих лимфоцитах или культуре фибробластов используется для сужения диапазона поиска специфического дефекта, затем можно провести прямое ферментное исследование для уточнения диагноза. Большая часть дефектов выявляется в культуре фибробластов; тем не менее, определенные отклонения (такие как дефицит мышечной КПТ-1 и SCHAD) могут быть тканеспецифичными (Sim et al., 2002).
б) Генетические изменения. Данные нарушения встречаются часто, но особенно распространены дефицит MCAD и СРТ-II. Все зарегистрированные нарушения наследуются аутосомно-рецессивным путем. У гетерозигот отклонений обычно не отмечается. Тем не менее, у гетерозиготных по гену LCHAD матерей, беременных больным плодом, к концу беременности может развиться острая жировая инфильтрация печени. Все пораженные гены были клонированы и зарегистрированы различные мутации, вызывающие заболевания. Преобладающие мутации связаны с MCAD, формой дефицита КПТ-II подростов и взрослых, и альфа-субъединицей ТФБ. Антенатальная диагностика возможна путем определения уровня ферментной активности в культуре амниоцитов или в образцах хорионических ворсин, более достоверна диагностика на основании молекулярного анализа. Высокая частота данных нарушений сочетается с высокой эффективностью лечения и/или профилактики, что является обоснованием для распространения скрининга новорожденных. Данный скрининг уже применяется во многих странах, особенно в отношении дефицита MCAD (Wilcken et al„ 2003).
в) Клинические проявления. У пациентов с нарушением окисления жирных кислот типичны клинические проявления, связанные с острым недостатком энергии, проявляющимся в любом возрасте, начиная с периода новорожденности до взрослого возраста (табл. 8.10). Тем не менее, новорожденные, младенцы и маленькие дети наиболее подвержены декомпенсации с связи с ограниченными запасами глюкозы. При рождении больные дети не способны справиться с энергетическими потребностями. У младенцев и маленьких детей длительное голодание и интеркуррентные инфекции являются наиболее частыми провоцирующими факторами. У детей старшего возраста декомпенсация может быть индуцирована инфекциями, лихорадкой и длительной физической нагрузкой.
Описанные неврологические последствия наблюдались при MCAD, заболевании, определяемом еще и как наименее выраженная форма нарушения окисления жирных кислот. У некоторых пациентов может отмечаться задержка развития, нарушения поведения, хронические припадки или двигательные нарушения, расцениваемые как детский церебральный паралич. По результатам небольшого количества нейровизуализационых исследований зарегистрированы следующие основные рентгенологические признаки: атрофия головного мозга, перивентрикулярная демиелинизация и повреждения базальных ганглиев (Brismar и Ozand, 1994а).
г) Специфические проявления. У новорожденных кроме острых проявлений также встречался аномальный органогенез с дисморфическими проявлениями. Кистозная дисплазия головного мозга и почек и полимикрогирия отмечаются в некоторых случаях дефицита MAD и КПТ-П (North et al., 1995). При дефиците SCAD основные неврологические отклонения такие как гипертония, гиперактивность, нистагм и задержка развития предполагают тяжелое нарушение созревания головного мозга, вероятно, вызванные специфическим нейротоксическим действием метаболитов короткоцепочечных жирных кислот (Bhala et al., 1995; Tein 2002).
Мышечная слабость и рабдомиолиз в результате нарушения энергопродукции являются основными проявлениями нарушения окисления жирных кислот. При таких заболеваниях, за исключением дефицита КПТ-1, описана хроническая мышечная слабость с миопатией и накоплением липидов. При дефиците КПТ-П описана тяжеля миопатия новорожденных без поражения органов (Land et al., 1995). Мышечная слабость в сочетании с прогрессирующей гипертрофической и/или дилатационной кардиомиопатией является характерным проявлением системного дефицита карнитина, распространенного в младенческом возрасте. Описаны случаи позднего начала заболевания во взрослом возрасте в сочетании с сердечной аритмией. Легкая форма MAD во взрослом и подростковом возрасте характеризуется прогрессирующей мышечной слабостью и непереносимостью нагрузок. Диагностика очень важна, так как у некоторых пациентов отмечается улучшение в ответ на применение рибофлавина.
При нарушениях, затрагивающих окисление длинноцепочечных жирных кислот (например КПТ-II, VLCAD, LCHAD, TFP, M/SCHAD и MAD), часто отмечаются эпизоды острого рабдомиолиза и серьезные осложнения. Чаще всего встречается легкая форма дефицита КПТ-II у подростков и взрослых. Заболевание характеризуется приступами рабдомиолиза без поражения других органов и без мышечной слабости в промежутках между приступами. Обострения провоцируются длительными нагрузками, голоданием, интеркурентными инфекциями или нахождением на холоде. Поиск дефектов окисления жирных кислот и особенно дефицита КПТ-П должен быть систематическим и включать диагностическое обследование всех пациентов, у которых впервые развился рабдомиолиз. Рецидивирующие эпизоды миолиза существенно замедляют течение заболевания у пациентов с дефицитом трифункционального протеина или LCAD, у которых в противном случае может развиться прогрессирующая аксональная нейропатия и пигментная ретинопатия (den Boer et al., 2003; Spiekerkoetter et al., 2004; Tyni et al., 2004).
д) Лечение. Основным методом лечения является предотвращение голодания и катаболических состояний. Во время обострения следует немедленно начать внутривенное введение глюкозы (10-12 мг/кг в минуту). Нет однозначных подтверждений, что ограничение потребления жира эффективно при дефиците MCAD. С другой стороны, для пациентов с нарушением метаболизма длинноцепочечных жирных кислот, может быть эффективна диета с низким содержанием жира и поддерживающим приемом триглицеридов. У пациентов с первичным дефицитом карнитина поддерживающее применение карнитина (100-300 мг/кг в сутки) является жизненно необходимым, так как в течение нескольких месяцев приводит к улучшению работы мышц и сердца. При всех других нарушениях вторичный дефицит карнитина обычно компенсируется при дозировке 50-100 мг/кг в сутки. У некоторых пациентов с легкими формами дефицита MAD и SCAD может отмечаться положительный эффект при поддерживающем применении рибофлавина (100 мг/кг в сутки). Доказано, что поддерживающее применение докозагексаеновой кислоты эффективно для предотвращения нейропатии и ретинопатиии у пациентов с LCHAD/TFP. Возможно предотвращение мышечной боли или непереносимости нагрузок путем предварительного приема кукурузного крахмала или триглицеридов с цепями средней длины (Gillingham et al., 2006; Ogier de Baulny и Superti-Furga, 2006).
Редактор: Искандер Милевски. Дата публикации: 14.12.2018
Велокардиофациальный синдром
Велокардиофациальный синдром – врожденное (иногда наследственное) заболевание, характеризующееся множественными пороками развития и расстройством когнитивных функций. Его основными симптомами являются дефекты твердого неба (явные и скрытые расщелины), сердечно-сосудистые нарушения, задержка умственного развития, характерные черты лица. Диагностика велокардиофациального синдрома производится на основании настоящего статуса пациента (в том числе и при обследовании новорожденных) и данных цитогенетических исследований. Специфического лечения заболевания нет, применяют симптоматическую терапию, в том числе и хирургические методики.
Общие сведения
Велокардиофациальный синдром – генетическое заболевание, основа которого лежит в нарушении внутриутробного развития многих органов и систем организма. Существует несколько сходных фенотипов с подобными проявлениями (например, синдромы Ди Джорджи и Шпринтцена), которые, к тому же, обусловлены похожими генетическими причинами. Поэтому одни исследователи в области генетики объединяют все эти состояния в группу «велокардиофациальный синдром», тогда как другие полагают, что это все-таки различные нозологические единицы. Например, отличием болезни Ди Джорджи являются иммунологические нарушения, которые слабо выражены при велокардиофациальном синдроме. Встречаемость составляет около одного случая на 3000-4000 родов, с равной вероятностью развивается как у мальчиков, так и девочек, в большинстве случаев патология возникает спонтанно и не имеется у родителей или близких родственников ребенка. Лишь в отдельных наблюдениях надежно доказана наследственная передача велокардиофациального синдрома по аутосомно-доминантному механизму.
Причины велокардиофациального синдрома
Непосредственной причиной развития велокардиофациального синдрома являются нарушения структуры длинного плеча 22-й хромосомы – локуса q11.2. Подобные дефекты возникают в процессе мейоза при образовании половых клеток, после чего передаются потомству. Чаще всего это микроделеции, которые сводятся к отсутствию небольшого участка хромосомы, при этом из генома больного исчезают важные гены, в частности TBX1. Роль этого гена в развитии велокардиофациального синдрома доказывает тот факт, что при некоторых формах заболевания отсутствует делеция участка 22-й хромосомы, но обнаруживаются точковые мутации в TBX1. Этот ген является одним из факторов регуляции транскрипции, наиболее активно участвующим в процессах эмбрионального развития.
Нарушение структуры TBX1 или тем более отсутствие в геноме в результате делеции приводит к патологиям эмбриогенеза, что становится причиной врожденных пороков развития. В частности, нарушаются процессы миграции клеток в области четвертого жаберного кармана и нервного гребня. По этой причине при велокардиофациальном синдроме затрагиваются именно те структуры, которые развиваются из данных эмбриональных зачатков. Сильнее всего это отражается на лице, сердечно-сосудистой, нервной и эндокринной системах. У больных велокардиофациальным синдромом возникают многочисленные нарушения в вышеуказанных системах органов, которые требуют длительного и иногда хирургического лечения. Иногда поражаются и другие структуры, не относящиеся к этим эмбриональным зачаткам – почки, мочеточники и мочевой пузырь, половые железы (крипторхизм). Такие проявления при велокардиофациальном синдроме обусловлены либо вторичными процессами, либо же тем обстоятельством, что при делеции могут повреждаться и другие гены помимо TBX1.
Делеция длинного плеча 22-й хромосомы или мутации гена TBX1 часто возникают в половых клетках родителей, то есть не встречаются у родственников пациента. Однако описаны случаи с аутосомно-доминантным механизмом наследования, по этой причине если один из родителей страдает велокардиофациальным синдромом, то вероятность рождения ребенка с данной патологией составляет 50%. Подмечено, что сходные с данным заболеванием синдромы Ди Джорджи и Шпринтцена чаще возникают не спонтанно, а именно передаются по наследству. И в этом случае механизм передачи нарушений аутосомно-доминантный.
Симптомы велокардиофациального синдрома
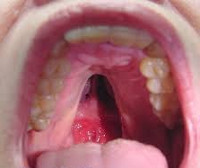
Проявления велокардиофациального синдрома можно обнаружить уже сразу при рождении ребенка, однако это не всегда позволяет сразу же поставить такой диагноз. Во-первых, это связано со схожестью проявлений заболевания с другими аналогичными синдромами (Ди Джорджи, Шпринтцена), во-вторых, часть симптомов начинает проявляться с возрастом и не регистрируется в младенчестве. Одним из наиболее явных проявлений велокардиофациального синдрома является характерный тип лица – выявляется отведение нижней челюсти назад, малый размер носа и рта, расширение переносицы. Могут наблюдаться деформации хрящей носа и ушных раковин. Расщелина твердого нёба присутствует у всех больных велокардиофациальным синдромом, но выраженность этого нарушения может быть различна – от резко явного до почти незаметного, выявляемого только при инструментальных исследованиях.
Помимо этого, уже в младенческом возрасте могут наблюдаться судороги, обусловленные низким уровнем кальция в крови по причине гипофункции паращитовидных желез. Их необходимо дифференцировать от судорожных припадков, обусловленных поражением ЦНС, что также может иметь место при велокардиофациальном синдроме – однако, чаще всего они возникают намного в более позднем возрасте. Из других неврологических нарушений могут встречаться задержка психического развития, психические заболевания. Нарушения речи могут иметь как неврологическую природу, так и быть обусловлены пороками развития нёба и лицевого скелета. Почти у четверти больных наблюдается недобор массы тела в грудном периоде, с возрастом практически у всех пациентов отмечается отставание в физическом развитии той или иной степени выраженности.
Диагностика велокардиофациального синдрома
Диагностика велокардиофациального синдрома производится на основании данных настоящего статуса пациента, изучения сердечно-сосудистой, эндокринной и нервной систем, а также генетических исследований. При этом для подтверждения диагноза без участия врача-генетика может потребоваться несколько лет наблюдений, так как многие из симптомов неспецифичны, а некоторые проявляются только по достижении больными определенного возраста. При осмотре новорожденного выявляют расщелину нёба той или иной степени выраженности, иногда она сопровождается и расщеплением верхней губы. У больных велокардиофациальным синдромом также определяется характерный внешний вид – широкая переносица, выступающий нос, маленький рот, низкорослость. У младенцев довольно часто обнаруживается недобор массы тела, а в дальнейшем – отставание в физическом развитии от сверстников. При пальпации может определяться мышечный гипотонус, заторможенность рефлексов.
Изучение функций сердечно-сосудистой системы при помощи ЭхоКГ почти в 70% случаев выявляет те или иные аномалии развития, которые ассоциируются с этим заболеванием. Это могут быть дефекты межжелудочковой перегородки, тетрада Фалло, необычное расположение артериальных сосудов. В редких случаях может выявляться такое состояние, как дестрокардия. Больным необходимо регулярное диспансерное наблюдение у врача-кардиолога, так как ряд нарушений может возникать или прогрессировать со временем. При развитии судорог необходимо провести анализ крови для определения уровня кальция и паратгормона – оба этих показателя могут быть значительно снижены. Изменение функций других желез внутренней секреции, как правило, не определяется.
Важным аспектом диагностики и лечения велокардиофациального синдрома является наблюдение за психофизическим развитием ребенка. В большинстве случаев в раннем детском возрасте больные дети значительно отстают от своих сверстников, медленнее растут, позже начинают говорить, имеют затруднения в усвоении новой информации. Это может иметь как первичные неврологические причины, так и быть обусловлено вторичными обстоятельствами – расщелиной твердого нёба (затрудняется питание новорожденных и речь у более старших детей), мышечным гипотонусом, проблемами с сердечно-сосудистой системой (хроническое кислородное голодание тканей). Однако при своевременной коррекции нарушений отставание в развитии при велокардиофациальном синдроме уменьшается к школьному возрасту.
Генетическая диагностика велокардиофациального синдрома включает в себя выявление участков микроделеций на длинном плече 22-й хромосомы и поиск точковых мутаций в гене TBX1. Так как делеции встречаются статистически чаще, то генетическое подтверждение заболевания начинают именно с их выявления. Для этой цели чаще всего используют различные варианты мультиплексной полимеразной цепной реакции. В отношении гена TBX1 применяют метод прямого секвенирования последовательности с целью определения дефектных участков. Дифференциальную диагностику велокардиофациального синдрома производят с другими патологиями, обусловленными микроделециями 22-й хромосомы (синдромы Ди Джорджи и Шпринтцена) и синдромом «кошачьего крика».
Лечение велокардиофациального синдрома
Специфического лечения велокардиофациального синдрома не существует, возможно только симптоматическое лечение и коррекция аномалий развития нёба, лица, сердечно-сосудистой системы. Самой частой паллиативной операцией при этом заболевании является коррекция расщелины твердого неба – нередко ее производят еще в младенческом возрасте, так как этот дефект значительно осложняет питание ребенка. Судороги, обусловленные гипокальциемией, устраняют назначением препаратов кальция – в большинстве случаев это позволяет полностью купировать данное проявление велокардиофациального синдрома. В ряде случаев необходима хирургическая коррекция аномалий сердца и сосудов, которая может производиться кардиохирургами в различном возрасте в зависимости от характера, выраженности и других обстоятельств.
Важным аспектом лечения велокардиофациального синдрома является помощь в психофизическом развитии ребенка. При гипотонусе мышц с раннего возраста показана физиотерапия и лечебная физкультура для улучшения координации движений и активности мышечных тканей. Особой проблемой при велокардиофациальном синдроме является развитие речи больного – она нарушена как из-за неврологических нарушений, так и по причине наличия расщелины твердого нёба. Поэтому хирургическое устранение этого дефекта и работа с логопедом необходимы для дальнейшей социализации ребенка. В ряде случаев требуется работа с психологом, коррекционным педагогом и вспомогательное обучение, часть детей со временем может посещать обычные школы и классы. У некоторых больных велокардиофациальным синдромом выявляется синдром дефицита внимания и гиперактивности (СДВГ), что требует применения дополнительных лекарственных и психотерапевтических мер.
Прогноз велокардиофациального синдрома
Прогноз заболевания часто неопределенный по причине широкого спектра выраженности симптомов – в особенности аномалий развития сердечно-сосудистой системы. При тяжелых формах велокардиофациального синдрома пороки развития сердца и сосудов могут приводить к смерти больного в раннем возрасте. Однако в большинстве случаев своевременная хирургическая коррекция и симптоматическое лечение значительно повышают как выживаемость пациентов, так и качество жизни. Так как данная патология является комплексной, то для контроля за ее течением и устранения нарушений нужна помощь множества медицинских специалистов. Необходимо регулярное посещение кардиолога, работа с психологом и логопедом, лечебная физкультура – все это позволит заметно снизить выраженность проявлений велокардиофациального синдрома.