аденовекторная генная терапия что это
Аденовекторная генная терапия что это
Генная диагностика имеет большое будущее в экспресс-диагностике инфекционных болезней. На ранних этапах инфекции, когда AT в организме ещё не выработаны, диагностика основана на идентификации Аг, в том числе специфических генов возбудителя. Для этого выявления наиболее часто применяют методы гибридизации и амплификации ДНК (см. также главу 11).
Генная терапия — метод лечения заболеваний, основанный на переносе в клетки организма определённых генов. Основная проблема генной терапии — разработка эффективного и безопасного способа переноса необходимых генов в дефектные клетки организма. В качестве «средств доставки» генов используют различные векторы, наиболее часто — различные вирусы (см. ниже). В настоящее время разработки генной терапии касаются только соматических клеток.
14 сентября 1990 г. была проведена первая успешная попытка коррекции генных дефектов при наследуемом Т-клеточном иммунодефиците, связанном с недостаточностью фермента аде-нозин дезаминазы. Двум больным девочкам провели пересадку собственных Т-лимфоцитов, в которые был внесён трансген — нормальный ген недостающего фермента. В результате нескольких проведённых инфузий у обеих пациенток наступило полное выздоровление. В настоящее время несколько тысяч больных несут в своём организме клетки, генетически изменённые искусственным путём.
В 1992 г. в США осуществили введение в клетки печени человека гена белка-рецептора, адсорбирующего липопротеины низкой плотности в гепатоциты женщины, страдающей выраженным атеросклерозом (патология была связана с дефицитом липопротеинов вследствие генных нарушений). Посредством трансфекции ген был введён в гомогенизированные клетки печени, которые затем переносили в печень пациентки. После такой процедуры состояние женщины улучшилось, хотя до пересадки «генно-инженерной печени» она перенесла инфаркт (в 16 лет) и операцию на сердце (в 26 лет).
Виды генной терапии
В настоящее время разработаны три основных вида генной терапии, различаемых по способу доставки вектора в поражённые клетки.
Генная терапия ex vivo. Поражённые клетки выделяют из организма пациента, инкубируют с вектором, после чего генно-инженерные (генетически изменённые) клетки вносят в организм. Наиболее часто метод применяют в отношении клеток крови. Это связано с простотой их выделения и последующего обратного введения.
Генная терапия in situ. В этом случае вектор вводят непосредственно в поражённые ткани. Например, пациентам с муковисцидозом аденовирусные векторы доставляют непосредственно в трахею и бронхи; в некоторые опухоли непосредственно инъецируют вектор, несущий цитокин или токсин; в мышцу больного, страдающего мышечной дистрофией, производят инъекцию вектора, несущего ген дистрофина.
Генная терапия in vivo — вектор вводят в кровоток. До настоящего времени на практике этот метод не применяли, однако метод прост и удобен, поэтому его считают наиболее перспективным.
Аденовекторная генная терапия что это
Препарат Zolgensma был разработан швейцарской фармацевтической компанией Novartis. Он применяется одноразово и стоит 2 млн долларов. Врачи считают, что лекарство может дать начало массовому применению генной терапии: только за первые три месяца 2019 года было зарегистрировано 372 новых клинических испытания генно-терапевтических препаратов.
Для многих наследственных заболеваний нет эффективного лечения, существующие препараты помогают облегчить жизнь пациентов. Причиной таких заболеваний являются изменения генетического материала – мутации. В результате мутаций с гена синтезируется либо изменённый белок, который не может правильно выполнять свою функцию, либо белок не синтезируется вовсе. Для полного излечения пациентов необходимо исправить в их клетках мутации. Задачу немного упрощает тот факт, что для многих наследственных заболеваний неработающий белок оказывается критически важен только в одном месте организма. Поэтому достаточно исправить ген только в этом органе или ткани.
Генно-терапевтический подход к лечению наследственных заболеваний разрабатывается уже 40 лет. Основная технология генной терапии основана на замещении гена с мутацией правильно функционирующей копией этого гена. Но есть еще две стратегии: выключение неправильно работающего гена и введение нового гена, который поможет организму победить заболевание.
Надо подчеркнуть принципиальное отличие генной терапии от редактирования генома, которое сейчас тоже активно разрабатывается для лечения наследственных заболеваний. Генная терапия доставляет ген в клетки, чтобы компенсировать дефектный ген. Но при этом не происходит удаление дефектной ДНК из клеток. При редактировании генома происходит удаление или изменение дефектной ДНК в клетках пациента.
В зависимости от цели генная терапия бывает соматической и фетальной. В первом случае вирус с геном вводят в клетки тела, во втором – в эмбрион на ранней стадии развития. В результате фетальной генной терапии генетический материал попадает во все клетки и может быть передан детям.
В ходе клинических испытаний препарат Zolgensma показал хорошие результаты у пациентов со спинальной мышечной атрофией: из 21 пациентов 19 смогли начать двигать головой и самостоятельно сидеть.
Препараты генной терапии могут стать эффективным средством лечения многих наследственных заболеваний, для которых не существовало лечения до этого. Так, в ближайшее время ожидает одобрения международного регулятора еще один новый генно-терапевтический препарат для лечения талассемии и серповидноклеточной анемии. Оба этих заболевания связаны с мутациями, результатом которых является синтез неправильно работающего гемоглобина – белка, переносящего кислород в крови.
Прежде всего, препараты генной терапии разрабатываются для заболеваний, причиной которых является одна в мутация в одном гене. Таких болезней 10 000. В связи с большими затратами на разработку генно-терапевтических препаратов, они очень дорогие. Но постепенно отработка технологии позволит значительно снизить стоимость таких лекарств и сделать их доступными большинству пациентов.
Аденовекторная генная терапия что это
В настоящее время генотерапия является одним из самых перспективных направлений в современной медицинской науке для лечения многих наследственных и других заболеваний. Однако, как показывает мировой опыт, при использовании этого метода лечения не следует ожидать абсолютной безопасности. В отдельных странах Европы и мира уже действующие законы по генно-инженерной деятельности дополнены разделами по генной терапии. В Российской Федерации регуляторные аспекты, относящиеся к изучению и применению генно-терапевтических препаратов, значительно менее развиты. В связи с этим необходимо разработать критерии оценки безопасности применения таких лекарственных средств и решить вопросы их регистрации соответствующими надзорными органами.
В настоящее время наиболее перспективные направления в современной медицине связаны с бурным развитием таких высокотехнологичных методик, как нанотехнологии, использование стволовых клеток и создание генно-терапевтических препаратов. Министерство здравоохранения и социального развития Российской Федерации уделяет должное внимание развитию этих технологий с целью обеспечения населения доступной персонифицированной, высокоспецифичной и эффективной медицинской помощью. С целью регулирования вопросов качества и безопасности применения биомедицинских технологий Минздравсоцразвития России был разработан проект Закона «О биомедицинских клеточных технологиях», который уже прошел процедуру согласования с федеральными ведомствами [1]. Другим аспектом этого направления является необходимость совершенствования регулирующих правоотношений для обеспечения безопасности использования новых генно-терапевтических лекарственных продуктов.
В современной медицине принято определение генотерапии в качестве способа лечения (коррекции) заболеваний (наследственных, многофакторных, приобретенных (инфекционных), онкологических) путем введения в ткани или клетки больного чужеродной (отсутствующей у него) генетической информации (генов) с целью направленного изменения генных дефектов или придания клеткам новых функций [2]. Изначально генотерапия рассматривалась как средство лечения наследственных заболеваний на генетическом уровне, т.е. как коррекция генома на уровне молекулы ДНК. Однако в настоящее время применение генотерапии значительно расширилось и включает в себя не только методы коррекции наследственных патологий и приобретенных заболеваний, но также и лечение вирусных инфекций на генетическом уровне путем введения в клетки полноценных функционально активных (терапевтических) генов или последовательностей ДНК, регулирующих активность генов.
По основным подходам в реализации целей генной терапии можно выделить различные виды генотерапии.
По основной стратегии лечения применение генной терапии может быть разделено на:
— внесение нормального, здорового гена в клетки, дефектные по этому гену (например, при наследственных болезнях);
— подавление патологической функции гена внутри клетки;
— усиление иммунного ответа аутологичных клеток реципиента ex vivo с последующим возвратом их в организм [3].
Основываясь на типе клеток-мишеней, генную терапию можно разделить на соматическую генную терапию, где объектом выступают соматические клетки, и фетальную генную терапию, объектом которой служат клетки плода.
В основе действия генно-терапевтических препаратов лежит принцип воздействия на болезнь с помощью генов, переносимых в клетки организма больного. Привнесение генного материала в организм реципиента может быть осуществлено непосредственно с помощью вирусных векторов или невирусных систем, либо в виде предварительно генетически модифицированных (ex vivo) клеток (например, донорских стволовых клеток пуповинной крови или аутологичных стволовых клеток костного мозга). Процедуру генотерапии можно разделить на три основных этапа: генно-инженерный — получение нужных продуктов (рекомбинантных ДНК и векторов, модифицированных клеток), доставка их в организм реципиента в виде инъекций, аэрозолей или с помощью клеточной трансплантации и, наконец, клинические испытания и лечение.
Генотерапии свойственны следующие риски, влияющие как на эффективность самого лечения, так и представляющие угрозу здоровью больного:
— вирусы-переносчики могут содержать протоонкогены;
— встраивание внешнего генетического материала в геном реципиента происходит неконтролируемо, из-за чего может быть нарушена экспрессия собственных клеточных протоонкогенов либо супрессоров опухолевого роста;
— экспрессия трансгенов подавляется провоспалительными цитокинами, такими как IFN-? и IFN-?, чья продукция активируется в ответ на инфекцию;
— иммунная система реципиента либо уничтожает самих переносчиков, либо уничтожает инфицированные клетки, либо вырабатывает антитела к ним, что затрудняет повторную трансфекцию;
— у реципиента еще до проведения терапии в организме могут присутствовать антитела к определенным типам вирусов;
— введение больших доз переносчиков может оказывать токсическое воздействие на организм реципиента [4,5].
В настоящее время проводятся активные исследования и клинические испытания средств генной терапии. По социальной значимости протоколов генотерапии лидируют злокачественные новообразования, нейродегенеративные и кардиологические заболевания, наследственные болезни, инфекции. Однако успехи оказались довольно скромными. Пока лечение с помощью генотерапии в лучшем случае лишь очень немного улучшает состояние больного, иногда вообще не дает результата, часто клинические испытания прерываются из-за серьезных иммуногенных реакций.
В мире насчитывается множество лабораторий, занимающихся созданием генно-терапевтических препаратов. Исследования в этой области расширяются, несмотря на их дороговизну. Ведь только, по официальным сведениям, в США на генную терапию тратится 8 млрд долл. в год, не считая того, что вкладывают биотехнологические и биомедицинские фирмы. А сколько средств тратят эти компании, не знает никто. Одна небольшая лаборатория (5–10 человек) тратит в год несколько миллионов долларов. Однако, судя по всему, лечение с помощью генотерапии в ближайшие годы не принесет никакой прибыли — ни один человек не способен оплатить такое лечение.
НЦССХ им. А.Н.Бакулева и Институтом биологии гена РАН был разработан генный препарат Ангиостимулин на основе плазмидной конструкции, содержащей ген VEGF165 человека. Доклинические исследования были выполнены на модели ишемии задних конечностей крыс [6]. Достоверный прирост количества капилляров был обнаружен исследователями через 1 месяц после внутримышечного введения суспензии плазмиды (250 мкг плазмиды на одно животное).
В 2002 г. в НЦССХ им. А.Н.Бакулева было начато клиническое исследование эффективности Ангиостимулина у больных с ишемической болезнью сердца [7]. Препарат вводили интромиокардиально в ишемизированную зону в общей дозе 1 000 мкг на одно введение. У всех больных в течение 2 лет было отмечено значимое клиническое улучшение в сравнении с дооперационной картиной.
В 2008 г. в ФГУ «Российский кардиологический научно-производственный комплекс МЗСР РФ» проведены I и IIа фазы клинического исследования препарата Корвиан у больных с критической ишемией нижних конечностей (20 человек) [8]. Корвиан представляет собой суспензию плазмиды, несущей кДНК фактора VEGF165, в физиологическом растворе (1 доза – 4 мл суспензии). Плазмида разработана в Институте экспериментальной кардиологии (ФГУ РКНПК Росздрава, Москва). В доклинических исследованиях было показано, что препарат стимулирует неоангиогенез и не токсичен. В случае получения положительных результатов испытаний I/IIa фаз планируется применение препарата при других патологиях, связанных с нарушением трофики тканей.
В том же году МГУ им. М.В.Ломоносова совместно с НИИЭМ им. Н.Ф.Гамалеи РАМН представили проект «Создание генно-терапевтических лекарственных препаратов для лечения заболеваний, обусловленных недостаточным кровоснабжением тканей и органов», рассчитанный на 3 года. В данном проекте использованы конструкции с генами шести факторов: фактор роста эндотелия сосудов (VEGF-А165), фактор роста гепатоцитов (HGF), ангиопоэтин-1, тромбоцитарный фактор роста (PDGF-BB), урокиназа, а также ген, кодирующий синтез белка нейрегулина-1 (NRG1). Выбор генов обусловлен свойствами кодируемых ими белков, которые взаимно дополняют друг друга во влиянии на ангиогенез и могут обеспечить достижение необходимых терапевтических эффектов. Авторы проекта надеются, что в результате будет создано опытно-промышленное производство по международным стандартам GMP.
В рамках федеральной целевой программы «Исследования и разработки по приоритетным направлениям развития научно-технологического комплекса России на 2007–2012 гг.» планируется разработка и выпуск опытных партий новых эффективных направленно-модифицированных терапевтических и диагностических средств постгеномной генерации для лечения рака легкого и пищевода. Проект объединяет крупнейшие научные центры страны: Институт молекулярной генетики РАН, Российский онкологический научный центр им. Н.Н.Блохина РАМН, Институт биоорганической химии им. М.М.Шемякина и Ю.А.Овчинникова, Новосибирский государственный университет, Институт биологии гена РАН, Институт эпидемиологии и микробиологии им. Н.Ф.Гамалеи РАМН, а также биотехнологические компании ЗАО «Евроген» и ЗАО «Биннофарм». В рамках проекта созданы конструкции, позволяющие осуществлять специфическую экспрессию терапевтических генов в раковых клетках, а также системы доставки терапевтических генов в опухоли.
В Новосибирском институте биоорганической химии разрабатываются подходы к созданию на основе олигонуклеотидов ген-направленных биологически активных веществ и терапевтических препаратов, открывающих возможность инактивации геномов инфекционных агентов и избирательного подавления экспрессии генов, ответственных за злокачественное перерождение клетки. Одним из разработчиков этой программы является академик РАН Евгений Свердлов, который 3 года назад возглавил проект по созданию первого в России противоракового препарата на основе методов генной терапии.
Таким образом, создание специфических препаратов для генотерапии может оказаться делом уже не столь отдаленного будущего, но говорить о радужных перспективах этого нового направления в медицине пока не представляется возможным, так как для доказательства эффективности хотя бы одного препарата нужно провести более широкие клинические исследования. Кроме того, не разработаны критерии оценки безопасности применения таких лекарственных средств и не решены вопросы их регистрации соответствующими надзорными органами.
Более того, вокруг генетической диагностики и терапии появилось множество околомедицинских мошенников и шарлатанов, которые выдают отдаленные перспективные ожидания и прогнозы ученых за уже свершившийся и активно используемый в медицине факт. По этому поводу группа ученых Evans J.P., Meslin E.M., Marteau T.M., Caulfield T. из США, Великобритании и Канады в своей недавней статье в журнале Science обратила внимание читателей на раздувающийся «генетический пузырь» – пока недостаточно обоснованные надежды людей на то, что достижения генетической медицины будут в ближайшее время воплощены в жизнь и найдут свое практическое применение. Авторы статьи призывают не поддаваться «генетической эйфории» [9].
На настоящий момент FDA не выдало ни одного разрешения на широкое клиническое применение генно-терапевтических лекарственных препаратов [10]. При этом Национальным институтом здоровья США официально опубликованы данные о проведении почти 2 тыс. клинических исследований с использованием генно-терапевтических препаратов на уровне от первой до третьей фаз [11].
Существующий нормативно-правовой «вакуум» в области генотерапии в России в начале ее становления был ей на благо, так как не становился преградой для новаторских исследований. Однако развитие и все более широкое овладение методами генной инженерии, возможность заниматься генотерапией в негосударственных структурах, общее нарастание криминальных тенденций в биомедицине настойчиво и безотлагательно требуют разработки механизмов контроля научной и клинической деятельности в области генотерапии.
Опубликовано: журнал «Вестник Росздравнадзора» №4 (2011)
Аденовекторная генная терапия что это
Московский научно-исследовательский онкологический институт им. П.А. Герцена — филиал ФГБУ «Национальный медицинский исследовательский радиологический центр» Минздрава России, Москва, Россия
Московский научно-исследовательский онкологический институт им. П.А. Герцена — филиал ФГБУ «Национальный медицинский исследовательский радиологический центр» Минздрава России, Москва, Россия
ФГБУ «Московский научно-исследовательский онкологический институт им. П.А. Герцена» Минздравсоцразвития России
ФГБУ «Московский научно-исследовательский онкологический институт им. П.А. Герцена» Минздрава России
Генная терапия — новое направление в медицине
Журнал: Онкология. Журнал им. П.А. Герцена. 2016;5(2): 64-72
Безбородова О. А., Немцова Е. Р., Якубовская Р. И., Каприн А. Д. Генная терапия — новое направление в медицине. Онкология. Журнал им. П.А. Герцена. 2016;5(2):64-72.
Bezborodova O A, Nemtsova E R, Iakubovskaia R I, Kaprin A D. Gene therapy is a new area in medicine. P.A. Herzen Journal of Oncology. 2016;5(2):64-72.
https://doi.org/10.17116/onkolog20165264-72
Московский научно-исследовательский онкологический институт им. П.А. Герцена — филиал ФГБУ «Национальный медицинский исследовательский радиологический центр» Минздрава России, Москва, Россия
В обзоре приведены сведения об истории и направлениях развития генной терапии. Обсуждены типы трансгенов, применяемые в лечении различных заболеваний, специфические и конституциональные промоторы, обеспечивающие экспрессию терапевтических трансгенов в клетках-мишенях, способы доставки генных конструкций в целевые клетки и механизмы внедрения генетического материала в ядро клетки. Рассмотрены преимущества и недостатки вирусных и невирусных векторов различных типов. Приведены данные последних лет о клиническом применении официнальных препаратов для генной терапии, зарегистрированных для лечения больных со злокачественными опухолями головы и шеи (Gendicine и Oncorine, Китай), с моногенным заболеванием — дефицитом липопротеиназы (Glybera, Нидерланды) и с ишемией нижних конечностей атеросклеротического генеза (неоваскулген, Россия), а также о клинических испытаниях препаратов для генной терапии в различных областях медицины.
Московский научно-исследовательский онкологический институт им. П.А. Герцена — филиал ФГБУ «Национальный медицинский исследовательский радиологический центр» Минздрава России, Москва, Россия
Московский научно-исследовательский онкологический институт им. П.А. Герцена — филиал ФГБУ «Национальный медицинский исследовательский радиологический центр» Минздрава России, Москва, Россия
ФГБУ «Московский научно-исследовательский онкологический институт им. П.А. Герцена» Минздравсоцразвития России
ФГБУ «Московский научно-исследовательский онкологический институт им. П.А. Герцена» Минздрава России
Достижения молекулярной биологии и генетики в изучении тонкой структуры генов эукариот, картирование генов на хромосомах млекопитающих, их идентификация и клонирование, обнаружение мутаций в генах, ассоциированных с наследственными и приобретенными заболеваниями, наряду с бурным ростом в области биотехнологий, клеточных технологий и успехами генной инженерии привели к тому, что в конце прошлого века начался бум в исследованиях по анализу молекулярно-биохимических дефектов, ассоциированных с определенной патологией, который привел к пониманию того, что большинство грозных заболеваний человека сопровождается серьезными изменениями в генетическом аппарате клетки. Особенно выражены и наиболее исследованы эти изменения при злокачественных новообразованиях. Из этих данных следует логичный вывод о том, что наиболее радикальным способом борьбы с заболеваниями, вызываемыми изменениями в генетическом аппарате клеток, должны быть мероприятия, направленные непосредственно на причину заболевания, а не ее последствия.
Генная терапия — это лечение наследственных, мультифакториальных и ненаследственных (инфекционных, злокачественных и др.) заболеваний путем введения генов в соматические клетки пациентов с целью направленного изменения генных дефектов или придания клеткам новых свойств.
История развития генной терапии началась в 1972 г., когда в США, в Стэндфордском университете, Стэнли Коэн и Герберт Бойер обнаружили явление прямого переноса фрагментов ДНК от одной бактерии кишечной палочки к другой при непосредственном контакте этих клеток. А уже в 1974 г. в США была учреждена первая в мире биотехнологическая компания «Genetech», где выращивали новые бактериальные культуры с чужими генами.
В 1976 г. в Университете Пенсильвания, США, Уильям Андерсон предложил использование вирусов в качестве носителей ДНК, а в 1990 г. этот исследователь в клинике Университета Пенсильвания ввел больной Ашанти ДеСильва с синдромом комбинированного иммунодефицита (СКИД) генетически модифицированные геном аденозиндезаминазы ее собственные лимфоциты, в последующие 3 года провел 23 внутривенных трансфузии и получил длительную ремиссию, а затем выздоровление.
В то же время метод генной терапии все шире распространялся по миру и к настоящему моменту в мире проведено и проводится более 2210 клинических испытаний по генной терапии. География их широка и разнообразна. Это — Америка (63,9%), Европа (24,1%), Азия (6,0%), Австралия (1,5%), международные (4,2%) [1]. По странам имеется распределение, свидетельствующее о том, что эта технология наиболее развита в США и ряде Европейских стран.
Спектр заболеваний, при которых проводятся клинические испытания по генной терапии, также чрезвычайно широк (табл. 1). Независимо от нозологии, в области соматической генной терапии имеются общие задачи. Это:

— выбор наиболее эффективного для лечения гена;
— разработка способов доставки требуемого гена в нужные клетки;
— изучение и обеспечение эффективных подходов и способов нужной регуляции гена;
— вопросы длительности существования и экспрессии введенного гена;
— обеспечение безопасности больного.
Типы генов, используемых при генной терапии, разнообразны, и их выбор определяется патогенетическими механизмами развития заболевания, идентификацией наиболее болезнетворных генов.
Наиболее простая задача в выборе гена стоит при моногенных наследственных заболеваниях, то есть там, где показано, что определенный дефект в данном гене вызывает патологический процесс. Совершенно другая задача по степени сложности в выборе гена для терапии стоит при многофакториальных заболеваниях, таких как злокачественные новообразования, кардиоваскулярные болезни, при которых в патогенезе заболеваний, во-первых, пока много неясного, во-вторых, задействован ряд генов.
Типы генов, описанные для клинических исследований, варьируют очень широко. Среди них 20,2% относятся к генам антигенов, 16,2% — цитокинов, 9,4% — различных рецепторов, 8,6% — факторов иммунодефицита, 7,4% — к «суицидным» генам, 7,4% — к генам факторов роста, 4,2%— ингибиторов репликации, 2,5% — маркеров, 13,2% — к генам других категорий белков, 2,5% — к неизвестным генам [1].
Для эффективной работы выбранный терапевтический ген снабжают сигнальными (регулирующими) элементами, которые необходимы для синтеза полноценной мРНК и целевого белка, а также позволяют управлять специфичностью экспрессии в определенном типе клеток или ткани, длительностью функционирования и нужной регуляцией гена в клетке (рис. 1) [2, 3].

Специфичность экспрессии генов в заданной клетке достигается конструированием векторов, несущих терапевтические гены под контролем промоторов, работающих только в данном типе клеток. К настоящему моменту выявлен ряд тканеспецифичных промоторов, обеспечивающих селективную экспрессию терапевтических трансгенов в клетках определенных органов. В экспериментальной генной терапии сердечно-сосудистых заболеваний в настоящее время используют промоторы, которые обеспечивают преимущественную экспрессию трансгена в миокарде (SM22α-промотор и др.) [4]. Разработан целый ряд тканеспецифичных промоторных систем, в которых использованы гены, высокоэкспрессированные, главным образом, в опухолевых клетках: простатспецифический и простатспецифический мембранный антигены при раке предстательной железы [5], гены, кодирующие сурфактантные белки, А и В, при раке легкого [6, 7], ген мембранно-связанного муцина MUC1/DF3 при раке молочный железы, трахеи, легкого, тонкого или толстого кишечника [8], ген α-фетопротеина — белка, синтезируемого в печени, при раке печени [9], промоторы гена сурвивина человека (hSurv) и гена обратной транскриптазы теломеразы человека (hTERT), обеспечивающих экспрессию трансгена в клетках широкого спектра опухолей [10, 11] (табл. 2).

Поскольку тканеспецифичные промоторы обладают общим недостатком — низким уровнем экспрессии гетерологичных генов, а также ограниченной областью применения, обусловленной их тканеспецифичностью, в настоящее время идет активный поиск промоторов генов человека, не обладающих тканевой специфичностью — универсальных или гибридных промоторов, направленных исключительно на пролиферирующие клетки и не затрагивающих нормальные дифференцированные клетки.
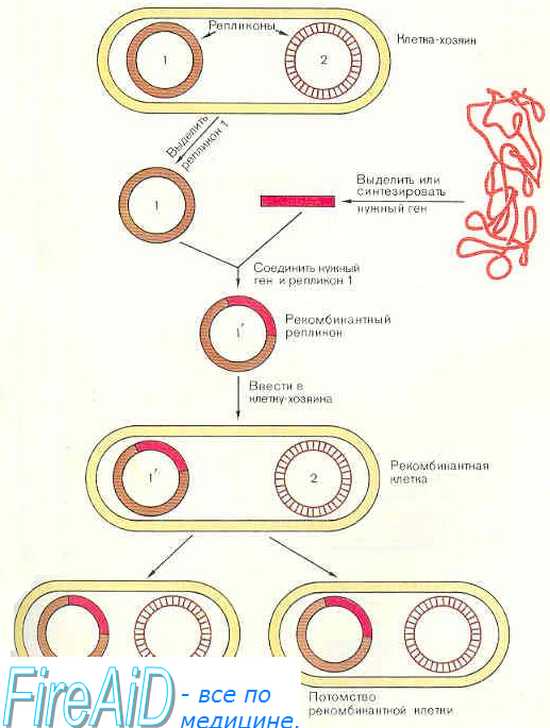
Одной из сложнейших проблем в генной терапии является доставка требуемого гена в нужные ткани при минимизации его контакта с биологическими средами организма до достижения клетки-мишени, а также обеспечение доставки гена в нужную клетку с целью его эффективной и безопасной работы в ней.
В настоящее время генетический материал доставляется в клетку либо в виде «голой» ДНК («naked DNA»)/плазмиды, в том числе в составе наночастиц и липосом, либо с использованием векторов вирусной и невирусной природы, защищающих ДНК от разрушения и имеющих тропность к определенным тканям (рис. 2) [12].

Самым простым способом доставки трансгенов является доставка «голой» ДНК/плазмиды. При этом для целей доставки генетического материала в ядро клетки используется арсенал различных средств. Это может быть физический метод доставки ДНК с применением таких приемов, как прямая инъекция «голой» ДНК, электропорация клеток и доставка ДНК через поры в обработанных мембранах, бомбардировка частицами с ДНК с использованием гидродинамической пушки [13].
На долю «голой» и плазмидной ДНК приходится всего 17,4% протоколов клинических испытаний в области генной терапии, что обусловлено их низкой трансфицирующей способностью. Это обстоятельство является большим ограничением для использования такого генетического материала в разработке метода генной терапии, несмотря на наличие у него ряда неоспоримых преимуществ: отсутствие инфекционности, низкая иммуногенность, высокая технологичность (доступность в получении в высокоочищенном состоянии в больших количествах, стандартность, стабильность при хранении и т. д.).
Альтернативным способом доставки терапевтических генов является использование векторов вирусной, бактериальной и химической природы. Вектор должен эффективно и специфически трансфицировать/трансдуцировать делящиеся и неделящиеся таргетные клетки, экспрессировать трансген в адекватных количествах в течение длительного времени, производиться легко и рентабельно по количеству и качеству, не быть иммуногенным и использоваться для повторного введения гена, являться безопасным при введении и не иметь побочных эффектов.
В качестве векторов для доставки генетического материала в клетку-мишень используют самые разнообразные вирусы, но наиболее распространены векторы на основе аденовируса (ADV), аденоассоциированного вируса, ретро- (RV), лентивируса (LV) и вируса простого герпеса (HSV) (табл. 3). При этом нативные полные вирусные частицы никогда не используются в качестве векторов, так как в этом случае есть опасность встраивания их генетического материала в клетки хозяина с целью приобретения метаболических и биосинтетических продуктов для вирусной транскрипции и репликации. Поэтому вирусы предварительно подвергаются существенной генетической модификации, приводящей к утере их репликационной способности и повышению тропизма к тканям и клеткам.

Вирусные векторы достаточно хорошо изучены, они имеют высокую эффективность трансфекции in vivo, для их наработки существуют коммерческие паковочные клеточные линии. Векторы на основе аденовируса и аденоассоциированных вирусов не встраиваются в геном клетки, а остаются эпихромосомными. Это уменьшает опасность мутагенеза, который может быть индуцирован при внедрении вируса в геном. При конструировании специфически направленных аденовирусных векторов эффективной оказалась замена вирусных промоторов, контролирующих основные транскрипционные области, так называемыми транскрипционными регуляторами, в результате чего экспрессия гена и репликация вируса происходят преимущественно в целевых клетках [14, 15].
Ретровирусные векторы интегрируют в геном хозяина, что при генной терапии обеспечивает стабильность и стойкую экспрессию трансгена в дочерних клетках, однако несет риск инсерционного мутагенеза, который может вызывать инактивацию генов-супрессоров опухолевого роста или активации онкогенов [16].
Необходимо отметить, что вирусные векторы обладают и другими недостатками. Так, они могут нести лишь небольшое количество генетического материала (до 30 кб). Кроме того, аденовирусные векторы 1-го поколения, в которых присутствуют все вирусные гены, обладают выраженной иммуногенностью, которая обусловливает развитие как клеточного, так и гуморального иммунного ответа, что приводит к разрушению не только самого вектора, но и клеток, трансдуцированных ими, и как следствие к ограничению срока экспрессии трансгена в 2—3 нед после трансдукции [17]. В настоящее время проблема иммуногенности таких векторов для генной терапии решается путем разработки конструкций, практически полностью лишенных вирусных генов, так называемых «gutless» вирусов или хелперзависимых (HD)/Ad векторов [18]. Исследования in vivo показали перспективность использования HD/Ad векторов для трансдукции клеток сосудистой системы и миокарда [19].
Несмотря на описанные недостатки, вирусный метод доставки трансгенов в клетки успешно развивается и в настоящее время является доминирующим: около 70% клинических исследований посвящено изучению генетических конструкций, снабженных вирусными векторами.
В то же время в последние годы активно разрабатываются невирусные системы доставки генетического материала с использованием высокомолекулярных химических соединений для конденсации с ДНК: липидсвязанные комплексы — липоплексы либо поликатионные комплексы, имитирующие поверхность вируса — полиплексы (табл. 4). Эти наночастицы защищают плазмидную ДНК в межклеточном пространстве от деградации нуклеазами и облегчают проникновение в клетки-мишени. Положительно заряженные комплексы связываются со специфическими рецепторами (при наличии на их поверхности макромолекул, обладающих свойствами специфического лиганда) или непосредственно с поверхностью клетки. Комплексы проникают в клетку по механизму эндоцитоза. После высвобождения из эндосомы и разборки комплекса нуклеиновая кислота проникает через поры в ядро клетки [20].

Невирусные системы на основе катионных липидов или полимеров имеют ряд преимуществ перед вирусными системами доставки: большой объем несущей ДНК, отсутствие какой-либо вирусной составляющей, а следовательно, низкая иммуногенность, высокая технологичность производства. Однако низкая трансфицирующая способность невирусных векторов и недостаток информации о безопасности у человека тормозят развитие исследований в этом направлении, только 5,2% приходится на клинические испытания, где в качестве системы доставки терапевтических генов используют липоплексы или полиплексы.
К настоящему моменту сформировалось два типа геннотерапевтического воздействия: индивидуализированный подход ex vivo — трансфекция стволовых гемопоэтических клеток, полученных из периферической крови и трансплантированных затем больному, и in vivo — трансфекция клеток внутри организма, куда генетический материал в составе вектора доставляется в результате внутривенной или внутриартериальной (в печеночную артерию) инфузии, внутримышечного, подкожного, интратуморального, интраназального или сублингвального введения. В практике лечения сердечно-сосудистых заболеваний испытываются прямые игольные инъекции конструкций в миокард, введение вирусных векторов при помощи разнообразных катетеров, использование стентов с покрытиями, обеспечивающими дозированный выход лекарственного средства. В онкологии используют, как правило, внутриопухолевое введение целевого гена в составе различных векторов.
На долю заболеваний, для которых разрабатываются методы генной терапии, большая часть приходится на злокачественные новообразования. Злокачественная трансформация клетки происходит в результате накопления генетических дефектов, приводящих к их аномальному росту, непосредственной причиной которых является дисбаланс в пролиферации и гибели клеток. Поэтому разработка способов коррекции этих дефектов является основой генной терапии злокачественных новообразований. Подходы к генной терапии рака включают в себя три основные стратегии: введение нормального гена в опухолевые клетки для замены «мутантного» гена, генетическую модификацию, преследующую цель заглушить «мутантный» ген, и генетические подходы, направленные на запуск гибели опухолевых клеток (табл. 5).

Представления о патогенезе злокачественных новообразований, в основе которого, в том числе, лежат активация онкогенов и инактивация генов-супрессоров опухолевого роста, позволяют искать пути подавления или восстановления функции этих генов.
К настоящему моменту известно более 24 генов-супрессоров, среди них наиболее изученным является ген р53, контролирующий клеточный цикл и поврежденный в ≈50% опухолей человека [21]. Так, коррекционная замена мутантного гена p53 в опухолевых клетках геном дикого типа (не содержащим мутаций) с помощью методов генотерапии приводила к восстановлению функций белка p53 и инициации процессов, запускающих программированную гибель злокачественных клеток. Клинические испытания аденовирусного вектора Ad-p53 показали, что восстановление дикого типа р53 путем доставки гена при помощи дефектного по репликации Ad приводило к значительному противоопухолевому эффекту на фоне низкой общей токсичности [22]. Более того, восстановление р53 сопровождалось увеличением чувствительности опухолевых клеток к химио- и радиотерапии [23].
Технология «молчащих» генов — одна из новейших технологий в генотерапии рака, направлена на сайленсинг (silence — молчание) генов, отвечающих за рост и/или деление раковых клеток, так называемых онкогенов. «Заглушить» гены можно за счет адресной доставки малых интерферирующих двухцепочечных РНК (siRNA), которые блокируют экспрессию гена в результате гомологичной рекомбинации (РНК-интерференция) [24, 25]. Также малые РНК, образующие «шпильки» во вторичной структуре (shRNA), могут быть использованы для подавления экспрессии генов путем РНК-интерференции.
Направленная доставка siRNA была апробирована в клинических испытаниях: CALAA-01 («Calando Pharmaceuticals») для пациентов с меланомой [26] и ALN-VSPOI («Alnylam Pharmaceuticals») для лечения рака печени и других солидных опухолей [27]. Предварительные результаты исследования CALAA-01 и ALN-VSPOI показали безопасность и хорошую переносимость siRNA, что является подтверждением целесообразности продолжения испытаний для продвижения данного подхода к лечению заболеваний онкологического профиля.
Одним из активно развивающихся направлений генной терапии рака является энзиматическая терапия (Gene-Directed Enzyme Prodrug Therapy, GDEPT), основанная на запуске гибели опухолевых клеток за счет придания им способности превращать вводимый в организм препарат-предшественник в токсичный метаболит. Это достигается введением «суицидных» генов, кодирующих фермент вирусного или бактериального происхождения, который в клетках, где он экспрессируется, конвертирует свой субстрат, превращая его из нетоксичного пролекарства в токсичный для клетки метаболит [28]. Наиболее изученными системами «суицидный» ген/пролекарство являются: ген тимидинкиназы вируса простого герпеса (HSVtk)/ганцикловир, ген цитозиндезаминазы (CD)/5-фторцитозин, цитохром P450 (p450)/циклофосфамид и другие [29]. Основная проблема, препятствующая применению этой стратегии в клинической практике, — довольно низкая эффективность доставки терапевтических генов. Несмотря на это, число проведенных клинических испытаний GDEPT растет с каждым годом [1]. Среди препаратов, предназначенных для GDEPT, можно выделить Sitimagene ceradenovec (Cerepro, «Ark Therapeutics Group Plc», Великобритания и Финляндия) на основе аденовирусного вектора со встроенным «суицидным» геном HSVtk. Этот препарат прошел I/II фазы клинических испытаний (глиома), в которых показана безопасность внутриопухолевой доставки вирусной тимидинкиназы в глиальные клетки, при этом отмечена стабилизации процесса у пациентов [30, 31].
Генная терапия рака, направленная на разрушение опухолевых клеток, возможна с использованием вирусов, которые с помощью специальных генетических манипуляций становятся онколитическими, т. е. селективно воздействуют только на опухолевые клетки, вызывают лизис инфицированных клеток и последующую трансдукцию окружающих опухолевых клеток, что в несколько раз увеличивает их терапевтический индекс. Существуют две основные стратегии получения онколитических вирусов: путем делеции (мутации) основных вирусных генов, функции которых могут быть восполнены только в опухолевых, но не в нормальных клетках (делеционные мутанты), и путем регуляции экспрессии основных вирусных генов за счет помещения их под ткане- или опухолеспецифичные транскрипционные регуляторные элементы (транскрипционная регуляция). Препараты на основе онколитических вирусов разрабатывают с использованием РНК- и ДНК-содержащих вирусов, таких как аденовирус, реовирус, вирус простого герпеса, поксвирус. Так, клинические испытания онколитических вирусов ONYX-015 и Н101 на основе мутантных аденовирусов с делецией в гене Е1В и с делецией в генах Е1В и Е3 соответственно, которые селективно реплицируются в опухолевых клетках с дефектным р53, показали безопасность и эффективность при интратуморальном введении в терапии ряда опухолей [32, 33]. В настоящее время проходят клинические испытания препарата REOLYSIN («Oncolitic Biotech. Inc.», Канада), полученного на основе штамма Т3D реовируса человека. В этих исследованиях показана низкая токсичность при внутриопухолевом и внутривенном его введении в режиме монотерапии, а в сочетании с противоопухолевыми препаратами, такими как гемцитабин для рака поджелудочной железы и легкого, доцетаксел для рака мочевого пузыря, предстательной железы и легкого, паклитаксел с карбоплатином для меланомы, рака легкого и яичников, показана высокая противоопухолевая эффективность [34].
Наиболее успешным онколитическим препаратом является OncoVexGMCSF на основе вируса простого герпеса, который проходит II/III фазы клинических испытаний для лечения меланомы, рака молочной железы, опухолей головы и шеи. В геноме этого вируса сохранен ген тимидинкиназы для проведения GDEPT, но удалены обе копии ICP34.5 гена, отвечающего за вирусную репликацию в нормальных клетках, а в область ICP47 встроен ген GM-CSF. Продуцируемый GM-CSF привлекает дендритные клетки (DC) и может стимулировать выброс цитотоксических Т-лимфоцитов [35].
Следует отметить, что современная стратегия развития иммунотерапии рака на фоне расширяющихся знаний о функционировании иммунной системы и формировании иммунного ответа является главной предпосылкой для усовершенствования подходов к лечению с привлечением инновационных лекарственных средств, созданных методами генной инженерии, таких как генные вакцины.
Исследования в этой области ведутся в трех направлениях: модификация опухолевых клеток для придания им большей иммуногенности, введение генов опухолеассоциированных антигенов в дендритные клетки, геномодификация лимфоцитов для повышения цитотоксического ответа.
К настоящему моменту разработана «платформа», представляющая собой два рекомбинантных вектора: на основе поксвирусов коровьей оспы (RV) для первичной вакцинации и птичьей оспы (RF) для ревакцинации с тремя костимуляторными молекулами [В7.1 (CD80), ICAM-1 (CD54) и LFA-3 (CD58), обозначаемыми TRICOM] для повышения иммунного ответа [36—38]. Каждый из этих векторов может содержать трансген для одного или нескольких опухолевых антигенов, например, таких как гены, кодирующие простатспецифический антиген (PSA), раково-эмбриональный антиген (СЕА), мембранно-связанный муцин (MUC-1) и другие. Разработаны вакцины PROSTVAC (RV-, RF-PSA-TRICOM) для иммунотерапии рака предстательной железы [39, 40] и PANVAC (RV-, RF-СЕА-MUC1-TRICOM) для иммунотерапии рака молочной железы, прямой кишки, яичников. Полученные на сегодняшний день результаты применения вакцин выглядят обнадеживающими в плане их переносимости. Однако в плане эффективности наблюдается лишь непродолжительная стабилизация процесса. Несмотря на это, синергизм иммунотерапии и химиотерапии, полученный в ряде клинических испытаний, является подтверждением целесообразности применения вакцин в сочетании с другими методами лечения [41].
Метод, известный как технология химерных антигенных рецепторов, или CAR-технология (от англ. chimeric antigen receptor), в настоящее время является одним из наиболее перспективных и быстро развивающихся направлений в области иммунотерапии злокачественных новообразований [42]. Эта технология заключается в выделении из периферической крови пациента Т-лимфоцитов и их двухкомпонентной модификации в условиях ex vivo: присоединение к их поверхности рецептора, распознающего экспрессируемый большинством лейкемических клеток белок CD19, и введение мощного внутриклеточного механизма, запускающего активный рост и деление клеток в ответ на их взаимодействие с белком-мишенью. Такие генномодифицированные Т-лимфоциты возвращают в кровоток пациента. Предварительные результаты исследований свидетельствуют о том, что этот подход позволяет получить хорошие результаты у 2/3 пациентов, не ответивших на традиционные методы лечения [43—45].
Микроокружение опухоли играет важную роль в прогрессии и метастазировании. Оно включает в себя строму с фибробластами и эндотелиальными клетками сосудов. Вмешательство в эту микросреду также может привести к регрессии опухоли. Наиболее важной «точкой приложения» является ангиогенез. В условиях опухолевого роста активируется выброс проангиогенных цитокинов, таких как сосудистый эндотелиальный фактор роста (VЕGF) и фактор роста фибробластов (FGF). Эти факторы стимулируют рост микрососудов вокруг опухоли с последующей прогрессией и метастазированием. Альтернативой терапии рекомбинантным (гуманизированным) моноклональным антителом бевацизумаб, которое селективно связывает и ингибирует активность VEGF, может стать генная терапия. Предварительные результаты клинических испытаний показали, что доставка антиангиогенных генов, кодирующих белки ангиостатин и эндостатин с помощью аденоассоциированного вектора, вызывает регрессию опухоли с минимальными побочными эффектами [15].
Таким образом, генная терапия достигла определенных успехов: разработаны подходы, сконструировано более 2 тыс. препаратов, прошедших доклинические исследования, проведены клинические испытания в ряде областей медицины. К настоящему моменту в мире уже зарегистрировано четыре препарата для генной терапии (табл. 6). Гендицин (Shenzhen SiBiono GenTech) и Oncorine (H101) (Sunway Biotech Co) — это первые генно-терапевтические препараты, допущенные к клиническому применению в Китае в 2003 и 2005 г. соответственно, для лечения плоскоклеточного рака головы и шеи [46]. Препарат Glybera (uniQurо), созданный на основе аденоассоциированного вектора, в геном которого встроен вариант гена липопротеиназы LPL s447x для лечения моногенного заболевания — дефицита липопротеиназы, вызванного мутацией в гене, кодирующем выработку этого фермента, допущенный к применению в 2012 г. Европейским агентством по оценке лекарственных препаратов (EMA) [47]. Препарат неоваскулген, представляющий собой высокоочищенную сверхскрученную плазмиду с геном VEGF165, кодирующий эндотелиальный фактор роста сосудов под контролем цитомегаловирусного промотора, предназначен для лечения пациентов с ишемией нижних конечностей атеросклеротического генеза и зарегистрирован в России в 2011 г. [48].

В настоящий момент в России, так же как и за рубежом, продолжается развитие этого метода. Так, во II фазе клинических испытаний находятся цельноклеточные генномодифицированные вакцины аллоген (из клеточной линии меланомы человека mel P/tag7) и мелавак (из клеточной линии меланомы mel Ког/GM-CSF), показавшие безопасность и эффективность при лечении меланомы [49]. На стадии клинических испытаний находится препарат канцеролизин, разработанный на основе аденовируса 5-го типа, у которого был полностью делетирован ген белка Е1 В по аналогии с известным штаммом ONYX-015 (ФГУН ГНЦ «Вектор», Россия) [50]. I фазу клинических испытаний проходит препарат АдеЛакт («НТфарма», Россия), представляющий собой рекомбинантные псевдоаденовирусные частицы, несущие ген лактоферрина человека (hLf). Этот препарат, предназначенный для терапии токсикозов различного генеза III и IV степени, проходил доклинические испытания в Московском научно-исследовательском онкологическом институте им. П.А. Герцена — филиале ФГБУ «НМИРЦ» Минздрава России [51]. На этой же базе идут доклинические испытания АнтионкоРАН-М — препарата для противоопухолевой «суицидной» терапии на основе рекомбинантной ДНК, кодирующей гены тимидинкиназы вируса простого герпеса (HSVtk) и колониестимулирующего фактора (GM-CSF) с невирусной системой доставки, разработанного в результате совместных исследований, проведенных в ФГБУН ИМГ РАН, ФГБУН ИБХ им. академиков М.М. Шемякина и Ю.А. Овчинникова РАН и МГУ им. М.В. Ломоносова [52].
Заключение
Таким образом, использование метода генной терапии может быть результатом уже не столь отдаленного будущего, но говорить о реальных перспективах этого направления в медицине, по-видимому, пока преждевременно. Несмотря на то, что большинство клинических испытаний свидетельствует об относительной безопасности геннотерапевтических препаратов, требуется время для окончательного доказательства их эффективности. Возможно, в будущем метод генной терапии станет основным в лечении наследственных заболеваний, а для заболеваний онкологического профиля генная терапия будет рассматриваться как часть комплексного противоопухолевого лечения.