антикоагулянтные препараты что это список
Антикоагулянты и их применение в медицине
Антикоагулянты – это противосвертывающие вещества, препятствующие образованию тромбов в кровотоке. Они поддерживают кровь в жидком состоянии и обеспечивают ее текучесть при целостности сосудов. Их разделяют на естественные антикоагулянты и синтетические. Первые вырабатываются в организме, вторые производятся искусственным путем и применяются в медицине в качестве лекарственных препаратов.
Естественные
Они могут быть физиологическими и патологическими. Физиологические антикоагулянты в норме присутствуют в плазме. Патологические появляются в крови при некоторых заболеваниях.
Физиологические антикоагулянты делятся на первичные и вторичные. Первичные синтезируются организмом самостоятельно и постоянно находятся в крови. Вторичные образуются при расщеплении факторов свертывания в ходе образования фибрина и его растворения.
Первичные естественные антикоагулянты
Их принято делить на группы:
При снижении в крови уровня первичных физиологических антикоагулянтов возникает риск развития тромбозов.
К этой группе веществ относятся:
Вторичные физиологические антикоагулянты
Как уже было сказано, они образуются в процессе свертывания крови и растворения фибриновых сгустков при расщеплении некоторых факторов свертывания, которые вследствие деградации утрачивают коагуляционные свойства и приобретают антикоагуляционные. К ним относятся:
Патологические антикоагулянты
При некоторых болезнях в крови могут образовываться и накапливаться специфические антитела, препятствующие свертыванию крови. Они могут вырабатываться против любых факторов свертывания, но чаще всего образуются ингибиторы VIII и IX факторов. При некоторых аутоиммунных заболеваниях в крови появляются патологические протеины, которые обладают антитромбиновым действием или подавляют факторы свертывания II, V, Xa.
Препараты антикоагулянты
Искусственные антикоагулянты, которых разработано большое количество, являются незаменимыми лекарственными средствами в современной медицине.
Показания к применению
Показаниями к приему пероральных антикоагулянтов являются:
Классификация антикоагулянтов
Медикаменты этой группы делятся на прямые и непрямые в зависимости от скорости и механизма действия, а также от продолжительности эффекта. Прямые непосредственно влияют на факторы свертывания крови и тормозят их активность. Непрямые действуют опосредованно: они замедляют синтез факторов в печени. Выпускаются в таблетках, в растворах для инъекций, в форме мази.
Прямые
Лекарства этой группы действуют на факторы свертывания напрямую, поэтому их называют препаратами быстрого действия. Они препятствуют образованию нитей фибрина, предотвращают формирование тромбов и прекращают рост уже имеющихся. Их делят на несколько групп:
Гепарин
Это самый известный и распространенный антикоагулянт прямого действия. Его вводят внутривенно, под кожу и внутримышечно, а также применяют в качестве местного средства в виде мази. К лекарствам гепаринового ряда относятся:
Гепарины местного действия отличаются незначительной проницаемостью в ткани и не слишком высокой эффективностью. Применяются для лечения варикоза ног, геморроя, синяков. Наиболее известны и часто применяются следующие средства с гепарином:
Гепарины для внутривенного и подкожного введения – большая группа медикаментов, которые подбираются индивидуально и в процессе лечения один другим не заменяются, поскольку равнозначными по действию не являются. Активность этих препаратов достигает своего максимума примерно через три часа, а действие продолжается в течение суток. Эти гепарины снижают активность тканевых и плазменных факторов, блокируют тромбин, препятствуют образованию фибриновых нитей, предотвращают слипание тромбоцитов.
Для лечения тромбоза глубоких вен, инфаркта, ТЭЛА, стенокардии обычно назначают Надропарин, Эноксапарин, Дельтапарин.
С целью профилактики тромбоэмболий и тромбозов назначают Гепарин и Ревипарин.
Гидроцитрат натрия
Этот антикоагулянт используется в лабораторной практике. Чтобы кровь не сворачивалась, его добавляют в пробирки. Его применяют при консервации крови и компонентов.
Непрямые
Они снижают выработку в печени некоторых факторов свертывания (VIII, IX, X, протромбина), замедляют образование белков S и C, блокируют выработку витамина К.
К непрямым антикоагулянтам относятся следующие препараты:
Варфарин нельзя пить при некоторых болезнях почек и печени, тромбоцитопении, при острых кровотечениях и склонности к кровотечениям, в период беременности, при лактазной недостаточности, врожденной нехватке протеинов C и S, ДВС-синдроме, если нарушена всасываемость галактозы и глюкозы.
Из побочных эффектов наблюдаются боли в животе, рвота, понос, тошнота, кровоточивость, мочекаменная болезнь, нефрит, аллопеция, аллергии. Может появиться сыпь на коже, зуд, экзема, васкулит.
Главный недостаток Варфарина – высокий риск развития кровотечений (желудочно-кишечных, носовых и других).
Пероральные антикоагулянты нового поколения (НОАК)
Современные антикоагулянты – незаменимые средства для лечения многих заболеваний, таких как инфаркты, тромбозы, аритмии, ишемия и многие другие. К сожалению, препараты, зарекомендовавшие себя как эффективные, имеют много побочных действий. Но разработки не прекращаются, и на фармацевтическом рынке периодически появляются новые оральные антикоагулянты. НОАК имеют как преимущества, так и недостатки. Ученые добиваются получения универсальных средств, которые можно принимать при разных заболеваниях. Ведутся разработки препаратов для детей, а также для пациентов, которым они на данный момент противопоказаны.
Новые антикоагулянты имеют следующие плюсы:
Есть у новых препаратов и недостатки:
Что касается непрямых антикоагулянтов, то кардинально отличающихся от Варфарина, Дикумарина, Синкумара пока не разработали.
Новые препараты Апиксабан, Ривароксабан, Дабигатран могут стать альтернативой при мерцательной аритмии. Их главное преимущество заключается в том, что во время их приема не требуется постоянно сдавать кровь, и они не взаимодействуют с другими лекарствами. В то же время эти препараты так же эффективны и могут предотвратить инсульт при аритмии. Что касается риска развития кровотечений, то он либо такой же, либо ниже.
Что нужно знать
Пациенты, которым назначены пероральные антикоагулянты, должны знать, что они имеют большое количество противопоказаний и побочных действий. При приеме этих лекарств нужно соблюдать режим питания и сдавать дополнительные анализы крови. Важно рассчитывать ежедневную дозу витамина К, поскольку антикоагулянты нарушают его метаболизм; регулярно контролировать такой лабораторный показатель, как МНО (или ПТИ). Больной должен знать первые симптомы внутреннего кровотечения, чтобы вовремя обратиться за помощью и поменять препарат.
Антиагреганты
Лекарства этой группы также способствуют разжижению крови и предотвращают образование тромбов, но механизм действия у них другой. Дезагреганты снижают свертываемость крови, благодаря способности тормозить слипание тромбоцитов. Их назначают для усиления действия антикоагулянтов. Кроме этого, они обладают спазмолитическим и сосудорасширяющим эффектом. Наиболее популярные антиагреганты:
К новому поколению лекарств относится препарат Брилинт с активным веществом тикагрелором. Он является обратимым антагонистом рецептора Р2У.
Природные средства для разжижения крови
Приверженцы лечения народными методами применяют для профилактики тромбозов травы с кроворазжижающим эффектом. Перечень таких растений достаточно длинный:
Прежде чем лечиться травами, желательно посоветоваться с врачом: не все растения могут быть полезны.
Заключение
Антикоагулянты – незаменимые препараты для лечения сердечно-сосудистых патологий. Самостоятельно принимать их нельзя. Они имеют много противопоказаний и побочных действий, а бесконтрольный прием этих лекарств может привести к кровотечениям, в том числе скрытым. Назначить их и определить дозировку должен врач, который способен учесть все особенности протекания болезни и возможные риски. Во время лечения нужен регулярный лабораторный контроль.
Важно не путать антикоагулянты и антиагреганты с тромболитическими средствами. Главное отличие в том, что первые не могут разрушить тромб, а лишь предотвращают или замедляют его развитие. Тромболитики – это препараты для внутрисосудистого введения, которые растворяют кровяные сгустки.
Современные антикоагулянтные препараты
(лекция)
Modern anticoagulants (lecture)
Благовестова А.П., Дуюнова Е.В., Эрметов В.К
Самарский государственный медицинский университет
Тольяттинский медицинский консилиум. 2017, № 5-6
Резюме
В статье представлен обзор антикоагулянтов, использующихся в современной медицине, представлены классификация, механизмы действия, показания, противопоказания к использованию и режимы дозирования.
Ключевые слова: антикоагулянты, антагонисты витамина К, низкомолекулярные гепарины, варфарин
Антикоагулянты – препараты, блокирующие реакции плазменного гемостаза – в настоящее время очень широко используются в клинической медицине. Современная классификация, предложенная в 2013 году рабочей группой по тромбозам Европейского общества кардиологов [1], в первую очередь подразделяет все антикоагулянты по пути введения в организм человека – парентеральные или для приёма per os. Далее, согласно механизму действия, внутри каждой из этих групп выделяются непрямые и прямые антикоагулянты. Препараты, которые не оказывают непосредственного действия на факторы свёртывания крови, а являются кофакторами антитромбина или блокаторами витамина К, относятся к антикоагулянтам непрямого действия. Лекарственные средства, обладающие способностью непосредственно блокировать активные центры IIа или Xа факторов свёртывания крови (F), и не требующие для реализации антитромботического действия дополнительных веществ, являются прямыми антикоагулянтами. Подробно механизмы действия представителей каждой из перечисленных групп препаратов будут рассмотрены ниже.
Таким образом, современная классификация антикоагулянтов выглядит следующим образом:
В Российской Федерации в настоящее время наиболее широко распространены парентеральные непрямые и оральные (как непрямые, так и прямые) антикоагулянты.
Парентеральные непрямые антикоагулянты
В 1916 году J.M. Lean выделил из печени собак антикоагулянтную субстанцию, которая в первое время использовалась в качестве лабораторного реактива для предотвращения свертывания крови. Впоследствии этот антикоагулянт был назван гепарином (греч. hepar – печень). C. Best (1930) разработал метод экстракции гепарина из легких крупного рогатого скота, L. Roden (1935) окончательно установил его структуру.
Первое клиническое испытание гепарина провел Masson (1924) у волонтера, получив значительное удлинение времени свертывания крови. Однако в качестве лекарственного препарата для предотвращения тромбозов гепарин стал широко использоваться лишь в годы Второй Мировой войны. В 1949 году в институте Choay (Франция) на основе гепарина был разработан антитромботический препарат «кальципарин», высокая концентрация которого позволяла вводить его подкожно (п/к). Тем не менее, в течение многих лет гепарин назначался внутривенно и только в начале 70-х годов исследования, выполненные сотрудниками института Choay доказали эффективность использования препарата в малых дозах у большого числа пациентов в послеоперационном периоде.
Нефракционированный гепарин (НФГ) – гликозаминогликан, содержащийся почти во всех тканях и органах организма и состоящий из смеси фракций полисахаридов с молекулярной массой в пределах от 3 000 до 30 000 Да. Основным свойством НФГ является «прямое» антикоагуляционное действие на систему свертывания крови, заключающееся в потенцировании ингибиторного действия антитромбина (АТ) на F II, F IXa, F Xa, F XIa и F XIIa. Активность АТ в присутствии НФГ возрастает в 1 000-100 000 раз. Основой антикоагуляционного эффекта является образование тройных комплексов: [F IIa : АТ : НФГ] и [F Xa : АТ : НФГ]. Проявление антикоагуляционной активности НФГ возможно только при достаточном уровне АТ. В случае снижения концентрации последнего в крови введение НФГ бесполезно без возмещения потерь АТ.
НФГ в больших дозах угнетает агрегацию тромбоцитов. Помимо этого, НФГ принимает участие во многих процессах метаболизма, влияя на углеводный, белковый и жировой обмен. НФГ обладает сосудорасширяющим действием, улучшает микроциркуляцию, оказывает гипогликемическое и местное противовоспалительное действие. Он опосредованно тормозит реакцию антиген-антитело, обладает антиаллергическими свойствами. НФГ способен регулировать ангиогенез и пролиферацию эндотелиальных клеток [2].
Для медицинского использования гепарин выпускается в виде натриевой и кальциевой соли. Активность препарата выражается в единицах действия. Раствор гепарина для инъекций выпускается с активностью 5 000, 10 000 и 20 000 МЕ в 1 мл. НФГ действует быстро, но кратковременно. Метаболизируется НФГ главным образом печенью, но около 20% выводится почками. При дозе 100 ЕД/кг T1/2 составляет один час, при более высоких дозах его содержание снижается нелинейно. Выраженность эффекта зависит от пути введения препарата. При инфузионном введении эффект развивается сразу же, поддерживается непрерывно на необходимом уровне. При прекращении введения или уменьшении его скорости, эффект НФГ быстро угасает. При болюсном в/в введении действие препарата длится 4-5 часов, а после п/к инъекции эффект развивается через 40-60 минут и продолжается 8-12 часов.
При использовании терапевтических доз препарата антикоагулянтный эффект НФГ мониторируется с помощью активированного парциального тромбинового времени (АПТВ), которое рекомендуется увеличивать в 1,5-2,5 раза по сравнению с нормальной плазмой. Определение АПТВ должно проводиться каждые 6 часов с коррекцией скорости введения гепарина до тех пор, пока два последующих измерения не будут соответствовать целевым значениям, а состояние больного не будет стабильным. После этого АПТВ определяется 1 раз в 12-24 часа. Для оценки эффективности проводимой терапии возможно определение уровеня D-димера [3].
В условиях массивной гепаринизации во время операций с искусственным кровообращением или вмешательств на коронарных артериях применение высоких доз НФГ основано на стандартных протоколах, учитывающих массу тела больного и вид хирургического вмешательства. В таких ситуациях мониторинг за действием НФГ осуществляется с помощью активированного времени свертывания (АВС) [3, 4].
Наиболее серьёзными осложнениями при применении НФГ являются кровотечения и гепарин-индуцированная тромбоцитопения. Основными причинами развития кровоточивости могут быть иммуноопосредованная тромбоцитопения, а также факторы риска, обусловленные сопутствующими заболеваниями (заболевания печени, почек, инвазивные вмешательства, септические состояния, травма).
В 1-5% случаев при применении НФГ развивается гепарин-индуцированная тромбоцитопения (ГИТ), которая возникает на 4-6 сутки лечения гепарином и в 30% случаев осложняется рикошетными тромбозами. Различают два типа тромбоцитопении, обусловленной гепарином:
I тип – развивается у больных, ранее получавших НФГ. ГИТ-1 встречается в 5-6% случаев лечения НФГ, характеризуется бессимптомным течением, ранним снижением количества тромбоцитов до 100·109 /л. Препараты гепарина при этом типе тромбоцитопении не противопоказаны, однако рекомендуется более тщательный дальнейший контроль за динамикой числа тромбоцитов крови.
II тип – развивается у больных, ранее не получавших НФГ. ГИТ-2 обусловлена выработкой аутоантител к комплексу [НФГ : тромбоцитарный фактор 4] и возникает обычно через 6-14 дней лечения, при этом доза НФГ может быть минимальной, как, например, при промывании гепарином венозных катетеров. ГИТ-2 характеризуется выраженным и стабильным снижением числа тромбоцитов в крови (на 30% и более от исходного) и проявляется коагулопатией с высоким риском развития как кровотечений, так и тромбоэмболических осложнений. При возникновении ГИТ-2 противопоказано продолжение лечения гепарином во всех его формах. Если продолжение антитромботической терапии необходимо, то назначают антикоагулянты, не образующие комплекс с фактором 4 тромбоцитов (пентасахариды, гликозаминогликаны, производные гирудина, пептидные антитромбины). Риск развития ГИТ-2 значительно возрастает при наличии у пациента фонового иммунного заболевания (антифосфолипидный синдром (АФС), системная красная волчанка, узелковый периартериит и др.).
Низкомолекулярные гепарины (НМГ) – фрагменты НФГ, полученные путем химической или ферментативной деполимеризации со средней молекулярной массой 4 000-8 000 дальтон. В 1976 году V. Kakkar [5] установил, что уменьшение молекулярной массы гепарина приводит к снижению его способности ингибировать тромбин. Именно блокада тромбина является основной причиной развития кровоточивости при гепаринотерапии. При этом уменьшение молекулярной массы не влияет на основной механизм антикоагулянтного действия гепарина – способность блокировать F Xa. Патент на низкомолекулярный гепарин (надропарин кальция) был получен институтом Choay в 1978 году, его успешная клиническая апробация была выполнена V. Kakkar в 1982 году и с 1985 года было разрешено производство этого препарата с торговым названием «Фраксипарин». В настоящее время известны около десяти препаратов этого класса.
Уменьшение молекулярной массы НМГ способствует улучшению их фармакокинетических характеристик: НМГ имеют большую биодоступность и быструю всасываемость из депо по сравнению с НФГ, более длительный T0,5, выводятся из организма преимущественно почками. При этом НМГ меньше влияют на тромбоциты, что сопровождается снижением частоты геморрагических осложнений. У препаратов этой группы более удобный режим введения (дважды в сутки, фраксипарин форте – один раз в сутки), при их использовании отсутствует необходимость лабораторного мониторинга. Недостатком НМГ является их высокая стоимость. Однако необходимо помнить, что различные представители НМГ различаются по физико-химическим, биологическим и фармакокинетическим характеристикам, то есть не являются взаимозаменяемыми. Каждый представитель НМГ имеет свой спектр антитромботического действия, показания к клиническому использованию. Поэтому необходимым является соблюдение конкретного способа применения, рекомендованного для каждого препарата.
Вводятся НМГ п/к в участок живота снаружи от края прямой мышцы ниже пупка. Введение в/в допустимо, однако такую методику используют редко – в случае необходимости получения срочного антитромботического эффекта. Внутримышечное введение НМГ запрещено.
Контроль за терапией НМГ осуществляется по их способности к блокированию F Xa – анти-Xa активность плазмы по Международному стандарту низкомолекулярных гепаринов. При этом важно соблюдать время получения пробы – через 3-4 часа после инъекции для профилактических доз при однократном введении и в середине между двумя инъекциями при двукратном терапевтическом применении. Исследование анти-Xa активности должно быть проведено в течение 1-2 часов с момента забора крови. Однако проведение исследования анти-Xa активности для большинства лабораторий недоступно в связи с высокой стоимостью исследования, поэтому обычно используются терапевтические дозы НМГ в соответствии с весом больного на основании рекомендаций фирмы-производителя.
Контроль за уровнем тромбоцитов крови обязателен при использовании любых гепаринов и проводится до начала введения препарата, а затем – один раз в 3-5 дней. Эффект от применения НМГ оценивается по купированию признаков тромбинемии (D-димер) [4, 6].
Фондапаринукс (торговое название – «Арикстра», производитель – GlaxoSmithKline) по химической структуре относится к группе синтетических пентасахаридов, механизм действия которого заключается в угнетении активности F Xа. Связываясь с АТ, пентасахариды приблизительно в 300 раз усиливают нейтрализацию F Xa, что прерывает цепь реакций свертывания крови и, следовательно, предотвращает тромбообразование. В отличие от гепаринов пентасахариды не конъюгируют с другими белками, в том числе с 4 фактором тромбоцитов, в связи с чем они не способны провоцировать ГИТ. Пентасахариды также не инактивирует тромбин.
Фондапаринукс рекомендован к использованию для:
Препарат выпускается в шприцах по 0,5 мл, содержащих 2,5 мг фондапаринукса. В этой дозе препарат не влияет на показатели коагулограммы и не требует лабораторного контроля. После п/к введения фондапаринукс быстро и полностью всасывается, максимальная концентрация в плазме достигается через 2 часа после введения, T1/2 составляет около 17-20 часов. Выведение препарата осуществляется почками.
Курс лечения продолжается, как правило, 5-9 суток.
С осторожностью препарат следует использовать у пациентов с повышенным риском развития кровотечений. Не рекомендуется одновременное применение с другими средствами, вызывающими гипокоагуляцию (фибринолитиками, блокаторами рецепторов IIb-IIIa, НФГ, НМГ). При сочетании с АСК, тиенопиридинами, НПВС необходимо соблюдать осторожность и проводить соответствующий контроль.
Парентеральные прямые антикоагулянты
Механизм действия прямых антикоагулянтов, как уже было указано ранее, заключается в целенаправленной блокаде активных центров факторов свёртывания крови (IIа или Xа), что приводит к нейтрализации их коагуляционных свойств и развитию состояния гипокоагуляции.
Прямые ингибиторы тромбина (F IIа). Прототипом для этих препаратов послужил нативный гирудин. С лечебной целью пиявки (Hirudo medicinalis) использовались ещё в Древней Греции, однако антикоагулянтное действие их слюны впервые было описано J.Haycraft в 1884 году. В 1955 году F.Markwardt удалось выделить в чистом виде вещество, названное “гирудин”, а в 80-е годы XX века, после определения его химической структуры, стало возможным промышленное производство этого препарата в культуре дрожжей ДНК-рекомбинантным методом. Дальнейшие исследования, базировавшиеся на изучении структуры гирудина, привели к появлению семейства гирудино-подобных пептидов (гиругенов и гирулинов). Синтетическим путём были получены аргатробан и производные бороаргинина.
Однако, вопреки ожиданиям, представители данного лекарственного класса не оказывают существенного влияния на результаты терапии и прогноз у пациентов с острыми коронарными синдромами в сравнении с гепарином. Значимое снижение частоты неблагоприятных исходов при терапии прямыми ингибиторами тромбина наблюдается только в раннюю фазу и практически не распространяется на период после прекращения введения препаратов. При этом высокая стоимость прямых ингибиторов тромбина существенно ограничивает их применение в клинике.
Прямые ингибиторы F X. Отамиксабан – экспериментальный прямой селективный ингибитор фактора свёртываемости крови Ха с быстрым началом/окончанием действия в форме инъекций. В исследовании III фазы ТАО проводилась сравнительная оценка эффективности отамиксабана с НФГ +/- ингибитор GP IIb/IIIa в отношении снижения риска смерти или нового инфаркта у пациентов с ОКС бп ST. Однако, согласно последним данным, клинические испытания отамиксабана прерваны из-за его неэффективности – в ходе клинических испытаний выяснилось, что он не имеет существенного преимущества перед традиционной терапией [7].
Таким образом, прямые антикоагулянты для парентерального введения к настоящему моменту не нашли широкого применения в клинической практике.
Оральные непрямые антикоагулянты
Антагонисты витамина К – препараты этой группы угнетают синтез факторов свертывания крови, не вмешиваясь непосредственно в коагуляционный процесс. Именно поэтому их ещё называют антикоагулянтами непрямого действия. По механизму действия они являются антагонистами витамина К (АВК), активная форма которого участвует в заключительных стадиях синтеза факторов свертывания крови II, VII, IX и X, а также естественных антикоагулянтов протеина C и S (ПрС, ПрS). АВК блокируют фермент витамин К-редуктазу, восстанавливающую окисленную форму витамина К в его активную форму (рис. 1). Нарушение активации витамина К сопровождается синтезом неактивных форм витамин К-зависимых факторов свертывания крови, способность которых к коагуляционным реакциям значительно снижена (PIVKA-протеины – Proteins, Induced in Vitamin K Absence). Развивается состояние гипокоагуляции, препятствующее образованию тромбина, формированию фибринового сгустка и, следовательно, развитию и прогрессированию тромбообразования.
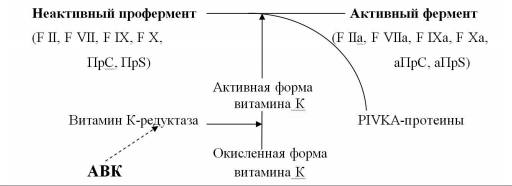 |
| Рис. 1 Механизм действия антикоагулянтов непрямого действия трансформация, активация, ингибиция (Вавилова Т.В., 2005, в модификации |
Скорость снижения активности факторов свертывания крови под влиянием АВК неодинакова. Первым уменьшается активность F VII, T1/2 которого в плазме составляет 4-6 часов; затем – F IX и F X, T1/2 которых равен 48 часам; последней снижается активность F II – примерно через 3-4 суток от начала приема препарата. В том же порядке происходит и восстановление уровня факторов после отмены АВК: быстро нормализуется F VII, позже – F IX и F X, и только через несколько дней – F II. В настоящее время установлено, что для получения выраженного антитромботического эффекта первостепенное значение имеет снижение содержания в плазме именно F II. Поэтому при переводе больного с НФГ или НМГ на терапию АВК, последние важно назначать за 4-5 дней до отмены гепарина. В противном случае возникает промежуток времени, в течение которого больной остается без воздействия антикоагулянтов, что сопровождается усилением процессов тромбообразования.
При назначении АВК необходимо помнить, что уже на начальном этапе лечения развивается выраженное снижение активности естественных антикоагулянтов – ПрС и его кофактора ПрS. Затем наступает стабилизация их активности и даже частичное восстановление ее уровня, в то время как депрессия факторов свертывания крови продолжается. Исходя из этого, следует воздерживаться от назначения АВК при тромбофилиях, обусловленных дефицитом указанных антикоагулянтов, а также при ДВС-синдроме, когда активность ПрС снижена иногда до очень низкого уровня [8].
Основным преимуществом препаратов этой группы перед прямыми антикоагулянтами является наличие таблетированных форм, что делает удобным длительное использование АВК. Их достоинством является и отсутствие необходимости взаимодействия с АТ для проявления гипокоагуляционного действия, поэтому применение АВК возможно на фоне дефицита АТ.
В настоящее время в мировой практике и в России наиболее широко применяется препарат группы монокумаринов – варфарин (кумадин). В 2001 г. препарат зарегистрирован в России фирмой Nikomed. Форма выпуска – пластиковые флаконы, каждый из которых содержит 50 или 100 таблеток Варфарин Никомед по 2,5 мг.
АВК применяются при необходимости длительной (иногда пожизненной) и непрерывной антикоагулянтной профилактики и терапии при наличии высокого риска развития тромбозов и системных тромбоэмболий, в том числе кардиогенных. Однако использование этих препаратов требует регулярного контроля за показателями протромбинового времени (ПВ), соблюдения определенных правил питания, осторожности при наличии сопутствующих заболеваний и их лечении.
Успех применения АВК зависит от адекватности дозы препарата и грамотной организации лабораторного контроля за уровнем гипокоагуляции. Перед назначением АВК необходимо оценить противопоказания к его приему; выявить факторы, влияющие на колебания антикоагулянтного эффекта и предполагаемую продолжительность терапии; исследовать общий анализ крови (включая подсчет тромбоцитов), общий анализ мочи, ПВ, АПТВ, функциональное состояние печени (билирубин, активность трансаминаз) и почек (мочевина, креатинин).
Если во время терапии варфарином возникло кровотечение, необходимо оценить степень его тяжести, показания МНО, уточнить режим приема препарата и других лекарств. Развившееся кровотечение может быть купировано введением свежезамороженной плазмы или использованием препаратов витамина К1 (не викасола!). Сложность купирования кровотечения в такой ситуации заключается в том, что в России не производится и не зарегистрирован препарат витамина К1. В настоящее время доступен препарат «Протромплекс 600», содержащий факторы протромбинового комплекса (II, VII, IX, X) и антикоагулянты (ПрC и АТ) в точных дозировках.
Величина поддерживающей дозы варфарина и стабильность гипокоагуляционного эффекта зависят от ряда врожденных и приобретенных факторов:
Снижение чувствительности к варфарину отмечается при микседеме, хроническом алкоголизме, АФС.
Таким образом, применение препаратов из группы АВК требует обучения пациента и постоянного контакта с ним, тщательного выявления факторов риска развития кровотечений и регулярного лабораторного контроля за уровнем гипокоагуляции. В целях оптимизации применения АВК в масштабах страны целесообразным представляется организация выпуска препарата витамина К1 или закупка последнего у фирм-производителей.
Оральные прямые антикоагулянты
Несколько лет назад, благодаря инновационным разработкам ведущих мировых фармацевтических компаний, в арсенале врачей появились прямые антикоагулянты для приёма per os. Эти препараты избирательно ингибируют только один фактор свертывания крови – или F IIа (тромбин), или F Xа. Возможность их использования в широкой клинической практике – прорыв в современной медицине, так как впервые за многие десятилетия появилась реальная альтернатива варфарину [9]. При этом прямые пероральные антикоагулянты (ПОАК) имеют целый ряд преимуществ перед антагонистами витамина К: не требуют рутинного лабораторного контроля и соблюдения диеты, демонстрирует ограниченное число взаимодействий с другими лекарственными средствами [10]. Вследствие этого ПОАК всё более широко используются во врачебной практике [11, 12, 13]. Кроме того, этим лекарственным средствам, в отличие от гепаринов и фондапаринукса, для осуществления антикоагулянтного действия не нужно образовывать комплекс с антитромбином. Кроме того, данные препараты, в отличие от гепаринов, не связываются с 4-м тромбоцитарным фактором, не являются антигенами и не вызывают иммунную тромбоцитопению [10].
В Российской Федерации в настоящий момент для применения зарегистрированы следующие ПОАК – апиксабан, дабигатрана этексилат и ривароксабан. Данные препараты применяются в следующих клинических ситуациях [14, 15, 16, 17]:
Однако практическим врачам необходимо чётко понимать, что названные выше лекарственные средства принципиально различаются между собой:
| Таблица 1 Режим дозирования ПОАК в зависимости от клинической ситуации |
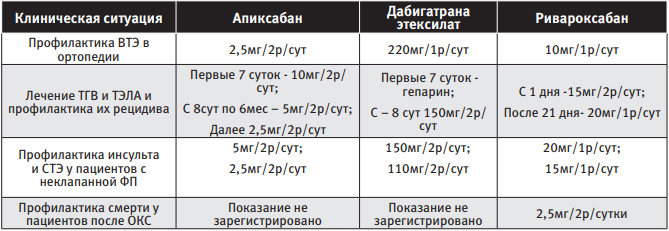 |
Блокатор F IIа – дабигатрана этексилат (торговое название – «Прадакса ® », производитель – Boehringer Ingelheim International) – пролекарство, которое после приёма внутрь быстро трансформируется сывороточной эстеразой в дабигатран – прямой ингибитор F II (тромбина). Фармакокинетический профиль дабигатрана в плазме крови здоровых добровольцев характеризуется быстрым увеличением концентрации в плазме с достижением максимальной концентрации (Сmax) в пределах 0,5-2 часов. После достижения Cmax плазменные концентрации дабигатрана снижаются биэкспоненциально, конечный T1/2 в среднем составляет около 14-17 часов у молодых людей и 12-14 часов у пожилых. При этом T1/2 не зависит от дозы. Пища не влияет на биодоступность дабигатрана этексилата. Биодоступность дабигатрана составляет 6,5%. При назначении данного препарата очень важно учитывать состояние почек пациента, так как дабигатран экскретируется преимущественно почками (80% от принятой дозы), и его накопление в организме повышает риск кровоточивости.
Блокаторы F Xа
Апиксабан (торговое название – «Эликвис ® », производитель – Bristol-Myers Squibb Company). Препарат обратимо и селективно блокирует активный центр F X. Апиксабан не оказывает непосредственного прямого влияния на агрегацию тромбоцитов, но опосредованно ингибирует агрегацию, индуцированную тромбином. Абсолютная биодоступность апиксабана достигает 50% при его применении в дозах до 10 мг. После приёма внутрь апиксабан быстро всасывается из ЖКТ, Cmax в крови достигается в течение 3–4 часов. Приём пищи не оказывает влияния на показатели Cmax апиксабана. Приблизительно 25% принятой дозы выводится в виде метаболитов. Основной путь выведения – через кишечник. Почечная экскреция апиксабана составляет приблизительно 27% от его общего клиренса, T1/2 – около 12 часов. Нарушение функции почек, возраст (≥80 лет) и вес пациента (≤60 кг) – это те факторы, наличие которых требует снижения дозы у пациентов с ФП.
Заключение
Таким образом, на современном этапе развития медицины практическому врачу доступен целый ряд антикоагулянтов, блокирующих процессы тромбообразования. При их использовании, в первую очередь, необходимо соблюдать существующие показания и противопоказания к их применению, а также ориентироваться в особенностях фармакодинамики и фармакокинетики каждого из этих препаратов. Кроме того, чрезвычайно важным является выявление индивидуальных особенностей пациента (возраст, вес, наследственность, личный анамнез, сопутствующая патология), что позволяет применять данные лекарственные препараты не только эффективно, но и безопасно.
