аттенуированного штамма что это
Аттенуированные штаммы
Смотреть что такое «Аттенуированные штаммы» в других словарях:
Штаммы ОПВ (оральной полиовирусной вакцины) — аттенуированные штаммы полиовируса, аттестованные национальным контрольным учреждением для использования в оральных вакцинах. Источник: Постановление Главного государственного санитарного врача РФ от 22.05.2003 N 99 О введении в действие… … Официальная терминология
Вакци́ны — (лат. vaccinus коровий) препараты, получаемые из микроорганизмов или продуктов их жизнедеятельности; применяются для активной иммунизации людей и животных с профилактической и лечебной целями. Вакцины состоят из действующего начала специфического … Медицинская энциклопедия
Вакцины инактивированные — Инактивированные вакцины корпускулярные (цельновирионные) вакцины, представляют собой бактерии или вирусы, инактивированные химическими или физическими факторами или обоими факторами вместе. Для их приготовления могут быть использованы… … Официальная терминология
Иммунизация — I Иммунизация (лат. immunis свободный, избавленный от чего либо; синоним: иммунопрофилактика, прививки предохранительные, прививки профилактические) специфическая профилактика заразных болезней людей и животных. Иммунопрофилактика ряда… … Медицинская энциклопедия
ВАКЦИНАЦИЯ — мед. Вакцинация (активная иммунопрофилактика) комплекс мероприятий, направленных на формирование противоинфекци онного иммунитета с помощью введения в организм человека Аг возбудителей инфекционных болезней. Вакцинация признана ВОЗ идеальной… … Справочник по болезням
Прививка (медицина) — Вакцинация введение антигенного материала с целью вызвать иммунитет к болезни, который предотвратит заражение, или ослабит его последствия. Антигенным материалом могут служить: живые, но ослабленные штаммы микробов; убитые (инактивированные)… … Википедия
Аттенуированного штамма что это
Вакцины — иммунобиологические препараты, предназначенные для активной иммунопрофилактики, то есть для создания активной специфической невосприимчивости организма к конкретному возбудителю. Вакцинация признана ВОЗ идеальным методом профилактики инфекционных заболеваний человека. Высокая эффективность, простота, возможность широкого охвата вакцинируемых лиц с целью массового предупреждения заболевания вывели активную иммунопрофилактику в большинстве стран мира в разряд государственных приоритетов. Комплекс мероприятий по вакцинации включает отбор лиц, подлежащих вакцинации, выбор вакцинного препарата и определение схемы его использования, а также (при необходимости) контроль эффективности, купирование возможных патологических реакций и осложнений. В качестве Аг в вакцинных препаратах выступают:
• цельные микробные тела (живые или убитые);
• отдельные Аг микроорганизмов (наиболее часто протективные Аг);
• токсины микроорганизмов;
• искусственно созданные Аг микроорганизмов;
• Аг, полученные методами генной инженерии.
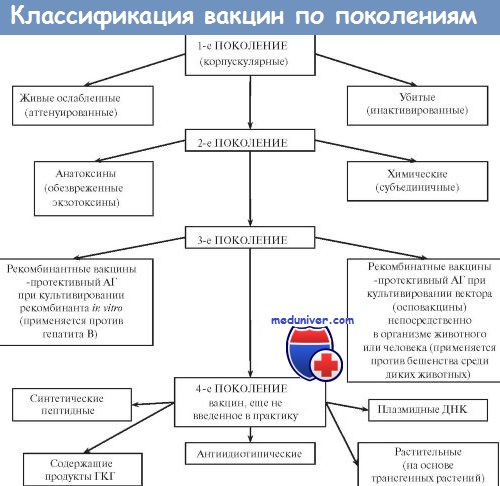
Большинство вакцин разделяют на живые, инактивированные (убитые, неживые), молекулярные (анатоксины) генно инженерные и химические; по наличию полного или неполного набора Аг — на корпускулярные и компонентные, а по способности вырабатывать невосприимчивость к одному или нескольким возбудителям — на моно- и ассоциированные.
Живые вакцины
Живые вакцины — препараты из аттенуированных (ослабленных) либо генетически изменённых патогенных микроорганизмов, а также близкородственных микробов, способных индуцировать невосприимчивость к патогенному виду (в последнем случае речь идёт о так называемых дивергентных вакцинах). Поскольку все живые вакцины содержат микробные тела, то их относят к группе корпускулярных вакцинных препаратов.
Иммунизация живой вакциной приводит к развитию вакцинального процесса, протекающего у большинства привитых без видимых клинических проявлений. Основное достоинство живых вакцин— полностью сохранённый набор Аг возбудителя, что обеспечивает развитие длительной невосприимчивости даже после однократной иммунизации. Живые вакцины обладают и рядом недостатков. Наиболее характерный — риск развития манифестной инфекции в результате снижения аттенуации вакцинного штамма. Подобные явления более типичны для противовирусных вакцин (например, живая полиомиелитная вакцина в редких случаях может вызвать полиомиелит вплоть до развития поражения спинного мозга и паралича).
Ослабленные ( аттенуированные ) вакцины
Ослабленные (аттенуированные) вакцины изготавливают из микроорганизмов с пониженной патогенностью, но выраженной иммуногенностью. Введение вакцинного штамма в организм имитирует инфекционный процесс: микроорганизм размножается, вызывая развитие иммунных реакций. Наиболее известны вакцины для профилактики сибирской язвы, бруцеллёза, Ку-лихорадки, брюшного тифа. Однако большая часть живых вакцин — противовирусные. Наиболее известны вакцина против возбудителя жёлтой лихорадки, противополи-омиелитная вакцина Сэйбина, вакцины против гриппа, кори, краснухи, паротита и аденовирусных инфекций.
Дивергентные вакцины
В качестве вакцинных штаммов используют микроорганизмы, находящиеся в близком родстве с возбудителями инфекционных болезней. Аг таких микроорганизмов индуцируют иммунный ответ, перекрёстно направленный на Аг возбудителя. Наиболее известны и длительно применяются вакцина против натуральной оспы (из вируса коровьей оспы) и БЦЖ для профилактики туберкулёза (из микобактерий бычьего туберкулёза).
АТТЕНУАЦИЯ
АТТЕНУАЦИЯ (латинский attenuatio уменьшение, ослабление) — стойкое необратимое ослабление вирулентности патогенных микроорганизмов. Впервые аттенуированные штаммы микроорганизмов были получены Л. Пастером (1880), применившим их в качестве вакцинных для борьбы с куриной холерой, сибирской язвой и бешенством. Аттенуированные штаммы микроорганизмов нашли широкое применение при изготовлении живых вакцин против чумы, туляремии, бруцеллеза, сибирской язвы, туберкулеза, бешенства, гриппа, желтой лихорадки, кори, полиомиелита, Ку-лихорадки и пр. (см. Вакцины).
При получении аттенуированных штатов обычно используют длительные пассажи на животных, в частности, резистентных к возбудителю, в культуре ткани и в питательных средах при измененной температуре или при добавлении в среду сапонина, желчи, антибиотиков и других веществ. Значительно быстрее можно получать аттенуированные штаммы путем обработки микроорганизмов мутагенами с последующей селекцией клонов, обладающих сниженной вирулентностью. Аттенуированные штаммы встречаются также среди микроорганизмов, циркулирующих в природе.
Механизм аттенуации связан с селекцией в процессе пассажей мутантов, обладающих сниженной вирулентностью, однако образующаяся популяция обычно генетически гетерогенна и содержит как аттенуированные микроорганизмы, так и сохранившие вирулентность. Поэтому важным заключительным этапом получения аттенуированных штаммов является клонирование, то есть выделение из образующейся популяции микроорганизмов клонов, обладающих наиболее сниженной вирулентностью, с последующим приготовлением из таких клонов генетически однородной популяции. Примерами получения аттенуированных штаммов может служить получение штаммов: вируса бешенства (путем пассажей через организм кролика), туберкулезных бактерий БЦЖ (путем их пассирования в течение 13 лет на среде из глицеринового картофеля с добавлением желчи) и вируса желтой лихорадки (при пассажах вируса в куриных эмбрионах и культуре ткани).
Применение живых вакцин из аттенуированных штаммов микроорганизмов требует постоянного контроля стабильности наследственных свойств и генетической однородности популяции.
Аттенуированного штамма что это
Первая живая аттенуированная вакцина против кори получена из исходного вирулентного штамма Эдмонстон, выделенного в 1954 г. и прошедшего 7 пассажей в культуре клеток почки человека и 6 пассажей в культуре клеток Vero. После 24 пассажей в культуре клеток почки и 28 пассажей в культуре клеток амниона человека получен штамм Эдмонстон-Эндерс. В дальнейшем его аттенуировали следующим образом:
6 пассажей на куриных эмбрионах (в амниотическую полость); 13 пассажей в культуре клеток куриных эмбрионов; 6 пассажей на куриных эмбрионах (в амниотическую полость); 3 пассажа в культуре клеток куриных эмбрионов; 8 пассажей в культуре клеток куриных эмбрионов (при 36°С); 40 пассажей в культуре клеток куриных эмбрионов (при 32°С).
В результате этих пассажей получен современный аттенуированный вакцинный штамм Moraten. Такой вирус слабо размножался в привитом организме и вызывал слабо выраженные признаки болезни у приматов. Вакцинный штамм имел множественные мутации, часть из которых была связана с изменением прикрепительного белка. Успех вакцинации этим штаммом был обусловлен его слабой репликацией, потомство вирионов часто оставалось на месте репликации, и вакцинация вызывала слабую или инапарантную инфекцию у отдельных пациентов.
В дальнейшем аттенуация этого штамма была продолжена разными авторами, в результате чего получены новые вакцины (Загреб, ALK-C, САМ, Ленинград 16, Шанхай-191). Уровень антител у вакцинированных зависел от возраста пациента и наличия материнских антител. Полиморфизм генов, ответственных за иммунный ответ, также оказывал влияние на сероконверсию. Обычно одна доза (3,0-4,0 lg БОЕ) вакцины вызывала сероконверсию у 80-95% привитых. Когда дозу вакцины для детей 4-6 месячного возраста увеличивали в 10—100 раз, сероконверсия усиливалась. Однако применение высокотитражной вакцины в странах с высокой детской смертностью сопровождалось увеличением смертности девочек в последующие 2—3 года.
Иммунный ответ на живую вакцину подобен иммунному ответу на естественную инфекцию, хотя вакцинальный иммунитет более вариабельный и менее продолжительный. Для предупреждения вспышки кори с учетом ее высокой контагиозности необходимо, чтобы по крайней мере 98% населения было серопозитивными. Роль латентного инфицирования на фоне недостаточного иммунитета в поддержании вируса неизвестна. Корь остается наиболее распространенным заболеванием людей в разных частях света. В центре современной стратегии борьбы с корью остается одновременная массовая вакцинация. Теоретически, корь является идеальным объектом для ликвидации путем иммунизации живой вакциной. Вирус имеет один серотип, большинство случаев болезни легко распознается клинически, не существует животных носителей вируса и существуют эффективные вакцины.
Живые вакцины Jery Lynn, Urabe, Am9 и Ленинград-3 против эпидермического паротита получены путем аттенуации вируса серийным пассированием в куриных эмбрионах (КЭ) и в культуре клеток КЭ. Каждая из этих вакцин представляет собой смесь нескольких аттенуированных штаммов. Например, штамм Jery Lin В аттенуирован пассажами в куриных эмбрионах (17 пассажей) и в культуре клеток куриных эмбрионов. Вакцина из этого штамма представляет собой смесь, по крайней мере, двух аттенуированных штаммов JL5 и JL2 в соотношении 5:1. После однократного парентерального применения живых вакцин ВНА появляются в течение 2 недель у 95% привитых и могут сохраняться более 19 лет. Для профилактики паротита в России применяют живую вакцину Ленинград-3 из аттенуированного штамма (Л-3), размноженного в первичной культуре клеток японских перепелов. Иммунитет развивается примерно у 60% привитых (> 10 000 ТЦД50) и сохраняется не менее 8 лет.
Попытки аттенуировать вирус ветряной оспы увенчались успехом. С этой целью его пассировали в культурах клеток эмбриона человека и морской свинки, а затем в диплоидных клетках человека WI-38. Вакцина из аттенуированного штамма «Ока» оказалась слабореактогенным безопасным препаратом, создающим иммунитет более чем у 90% детей сроком на один год. Установлено, что во время пассирования в культуре штамм «Ока» претерпел множество мутаций, о чем свидетельствует потеря, по крайней мере, шести сайтов рестрикции, однако основа его аттенуации не выяснена. При использовании миллионов доз этой вакцины в США очень редко отмечали незначительные осложнения. Вакцина из штамма «Ока» — первая живая вакцина против вирусов герпеса человека.
Вирус краснухи аттенуировали серийными пассажами в различных культурах клеток, в результате которых получено несколько вакцинных штаммов. Среди них вакцина HPV77/DE5 из вируса размноженного в культуре клеток эмбриона уток, широко используемая в Северной Америке. Вакцину из штамма Cendehill использовали в Европе. Несколько аттенуированных штаммов получены в Японии.
Иммунитет у вакцинированных связан с циркулирующими антителами, которые появляются через 2—3 недели после вакцинации и сохраняются 20 лет. Эффективная иммунизация предусматривает двукратную вакцинацию на втором году жизни и после 6 лет при вакцинации 95% детей. В России зарегистрированы живые вакцины против краснухи Рудивакс (Франция), SII (Индия) и вакцина MMR (США) против кори, паротита и краснухи. Вакцину MMR прививают лицам старше 15 лет. После однократного введения сероконверсия к трем вирусам развивается не менее, чем у 95% привитых. Антитела сохраняются более 11 лет.
С целью получения живой безопасной иммуногенной вакцины штамм Н2 вируса гепатита А серийно размножали в культуре клеток почки новорожденных обезьян, а затем в культуре фибробластов человека (КМВ17). Этой вакциной в Китае привито более 20 млн человек, и не было отмечено случаев вакцинального гепатита или выделения вакцинного вируса с фекалиями.
Аттенуированный вакцинный штамм ТС-83 вируса венесуэльского энцефаломиелита лошадей получен в результате 45 пассажей вирулентного штамма в культуре клеток сердца морской свинки. Аналогичный штамм-15 этого вируса получен серийным пассированием вируса в культуре клеток куриного эмбриона.
Испытания, проведенные на добровольцах, показали, что живая вакцина против цитомегаловирусной инфекции человека из штамма Таун была безопасной и защищала от заболевания, но не от инфицирования полевым штаммом вируса. Вакцинный вирус не выделялся из организма привитых пациентов.
Единичные точечные мутации в геноме многих вирусов сопровождаются аминокислотными заменами в поверхностных белках и аттенуацией. Так было с вирусами лихорадки долина Рифт, Синдбис, клещевого и японского энцефалитов и другими вирусами. У аттенуированного штамма ТС-83 вируса венесуэльского энцефаломиелита лошадей выявлены замены одной аминокислоты в Е-1, пяти аминокислот в Е2 и делеция в З’-концевой некодирующей области генома.
Вакцинный штамм 17-D вируса желтой лихорадки содержит мутации в гене, кодирующем протективный гликопротеин VP3. Нуклеотидная дивергенция вакцинного штамма составляла 1%.
Тканевой тропизм и нейровирулентность реовирусов млекопитающих и птиц определяются генными сегментами S-1, кодирующими поверхностный белок Q-1. Вирионный белок Q-1 реовирусов так же, как VP1 пикорнавирусов, ответственен за тропизм к клеткам хозяина и представляет главную мишень для нейтрализующих антител.
Природно аттенуироваиные мутанты реовируса с измененным тропизмом к клеткам центральной нервной системы могут быть изолированы экспериментально селекцией вируса с изменениями в капсидном протеине Q-1. Реовирусные мутанты проявляют пониженный тропизм к специфическим участкам мозга, хотя размножаются нормально во внутренних органах экспериментально инфицированных мышей.
Выявлена интересная зависимость между вирулентностью коронавирусов кошек и клеточным тропизмом. Вирулентные штаммы в основном поражают моноциты авирулентные — реплицируются в эпителии кишечника.
В аттенуации вируса простого герпеса важная роль принадлежит гликопротеинам. Мутанты вируса с делециями в генах гликопротеинов G и Е оказались аттенуированными для мышей. Гликопротеины D и Н также играют существенную роль в тканевом тропизме и инфекционности вируса. Делеция аминокислотных остатков в положении 324-244 гликопротеина D полностью исключает эти функции]. Определенный вклад в инфекционность вируса вносит гликопротеин С. Вирус, лишенный gC, в 10—20 раз имел меньшую инфекционность по сравнению с исходным.
С целью выяснения роли отдельных генов в вирулентности вируса болезни Ауески были получены мутанты с делециями 1-3 генов, кодирующих гликопротеины оболочки вириона. Делеционные мутанты по одному гену gI или gIII обладали пониженной вирулентностью для свиней и однодневных цыплят, тогда как мутанты, дефектные по двум генам, кодирующим гликопротеины gIII и gI или gIII и gp63, оказались полностью авирулентными для указанных животных. Из этого следует, что вирулентность вируса болезни Ауески является синергидной функцией отдельных экспрессируемых генов, а репродукция вируса в культуре не коррелирует с вирулентностью. Полигенный контроль вирулентности обнаружен также у вируса долины Рифт.
Аттенуация для обезьян реассортантов вирусов гриппа птиц и человека детерминирована геном нуклеопротеина.
Характеристика маркеров холодовой адаптации кандидатных вакцинных штаммов для живых аттенуированных вакцин против ветряной оспы и опоясывающего герпеса
Полный текст:
Аннотация
Введение. Значимость ветряной оспы обусловлена ее широкой распространенностью, значительной вероятностью тяжелого клинического течения, осложнений, которые могут приводить к летальным исходам. Вакцинация является единственным специфическим способом профилактики заболевания. Цель работы заключалась в оценке аттенуации холодоадаптированных (ХА) кандидатных вирусных штаммов Varicella zoster и Herpes zoster традиционными и новыми методами.
Материалы и метод. В работе использовали штаммы диплоидных клеток легких и кожно-мышечной ткани эмбриона человека, первичные и диплоидные клетки фибробластов эмбриона морской свинки. Были получены два клинических изолята вируса — от ребенка, больного ветряной оспой, и взрослого в период реактивации опоясывающего герпеса. В качестве контроля использовали вакцинный штамм vOка и лабораторный штамм Ellen. Инфекционную активность вирусов определяли методом предельных разведений вируса в чувствительных культурах. Вирулентность устанавливали при анализе инфицированных вирусом Varicella zoster хорион-аллантоисных оболочек развивающихся куриных эмбрионов.
Результаты. Клинические изоляты пассированы при пониженной температуре и исследованы в сравнительных экспериментах на наличие биологических маркеров аттенуации. Установлено, что штаммы вируса Varicella zoster vFiraVax и вируса Herpes zoster vZelVax обладали температурочувствительностью и холодоадаптируемостью, но не вирулентностью. Аттенуированные ХА вирусные штаммы индуцировали более низкий уровень экспрессии α- и γ-интерфероновых рeцепторов на мононуклеарных клетках человека в отличие от их родительских вариантов.
Заключение. Нами созданы и охарактеризованы два кандидатных вакцинных штамма на основе аттенуации клинических изолятов.
Ключевые слова
Введение
Вирус Varicella zoster (VZV) является человеческим а-герпесвирусом и тесно связан с вирусом герпеса простого 1-го и 2-го типов. VZV имеет типичную морфологию вируса герпеса, однако его геном является самым небольшим среди а-герпесвирусов и он кодирует более 70 генных продуктов [1].
Ветряная оспа (ВО) имеет общую этиологию и тесную патогенетическую связь с хронической формой инфекции — опоясывающим герпесом (ОГ), обусловленным вирусом Herpes zoster (HZV). ВО и ОГ являются разными клиническими формами одного инфекционного процесса. Риск развития ОГ у переболевших ВО составляет 10-30%. Среди лиц в возрасте 60-80 лет частота заболевания ОГ варьирует от 5 до 10 случаев на 1000 человек. У 15-40% больных ОГ развивается постгерпетическая невралгия, плохо поддающаяся лечению и приводящая к значительному снижению качества жизни. Другие осложнения реактивации включают энцефалиты, моторную слабость, миелопатию и др. Наиболее тяжелые осложнения возникают у иммунокомпрометированных индивидуумов [2][3][4].
За рубежом на протяжении многих лет применяется живая культуральная вакцина на основе аттенуированного вирусного штамма уОка (Япония). Эта вакцина создает длительный напряженный поствакцинальный иммунитет после двукратного цикла иммунизации (на 10-20 лет — период наблюдения) и предотвращает смертельные исходы у новорожденных и детей с ослабленным иммунитетом, а также частично предотвращает развитие ОГ у пожилых людей и людей с ослабленным иммунитетом [5].
На основе вакцинного штамма уОка производится вакцина для иммунизации детей и взрослых. Доза вируса VZV в вакцине для взрослых увеличивается на 2 порядка.
Отечественные аналоги вакцины против ВО в России отсутствуют. В нашей лаборатории созданы два отечественных аттенуированных вакцинных штамма VZV для конструирования живых культуральных отечественных вакцин, предназначенных для детей и взрослых.
Основной целью настоящей работы является оценка аттенуированных вакцинных штаммов по традиционным биологическим маркерам аттенуации и поиск новых маркеров аттенуации для более полного контроля свойств кандидатов в вакцинные вирусные штаммы для живой культуральной вакцины против ВО и ОГ.
Материалы и методы
Культуры клеток
В работе использовали штаммы диплоидных клеток легких эмбриона человека (ЛЭЧ-3 и MRC-5), штамм диплоидных клеток кожно-мышечной ткани эмбриона человека (КМ 27), первичные и диплоидные клетки фибробластов эмбрионов морской свинки (ФЭМС).
Диплоидные клеточные культуры выращивали на питательной среде ДМЕМ/F12 («PanEco») с 10 мМ HEPES, 5% эмбриональной телячьей сыворотки («HyClone») с добавлением 2 мМ глутамина и 40 мкг/мл гентамицина.
Вирусы
Получили клинический изолят VZV и клинический изолят HZV от инфицированных пациентов в виде корочек от везикул, сформировавшихся с начала появления сыпи. Один изолят получили от здоровой девочки 6 лет, заболевшей ВО в Москве, другой — от мужчины 63 лет в период реактивации рецидивирующего ОГ.
Аттенуация клинических изолятов
Вирусный изолят ВО и ОГ аттенуировали на клетках ЛЭЧ-3 при низкой температуре (30°С). Изоляты прошли 12 пассажей на диплоидных клетках ЛЭЧ-3, 6 пассажей на первичных клетках ФЭМС и дополнительно 2 пассажа на клетках ЛЭЧ-3. После завершения полного цикла холодовой адаптации изоляту VZV присвоили название vFiraVax VZV, а изоляту HZV — vZelVax HZV.
В качестве референс-вирусов VZV использовали аттенуированный вакцинный вирусный штамм vОКА/Merсk VZV (США) и лабораторный вирусный штамм Ellen vZv (США).
Определение инфекционной активности вирусов VZV
Заражение хорион-аллантоисной оболочки (ХАО) развивающихся куриных эмбрионов
У 11-12-дневных куриных эмбрионов создавали искусственную воздушную полость, на нее наносили по 0,1 мл ВСЖ VZV. Ежедневно просматривали эмбрионы на жизнеспособность. В случае гибели эмбрионов на следующие сутки их уничтожали. Наблюдали за эмбрионами в течение не более 6 сут. После охлаждения инфицированных эмбрионов из них извлекали ХАО на чашку Петри, оболочку отмывали ФБР и просматривали на наличие геморрагии или белых оспин.
Получение мышиных сывороток, специфичных к VZV
Мышей линии BALB/c, свободных от патогенной флоры (SPF-мыши), иммунизировали ВСЖ по 0,5 мл с 6 lg ГАДЕ50/0,1 мл (ГАДЕ — гемадсорбирую- щая единица) внутрибрюшинно трехкратно 3 дня подряд. Указанный цикл иммунизации повторяли трижды с 2-недельным интервалом.
Определение вирусспецифических антител в непрямом иммуноферментном анализе
После вортексирования инфицированный клеточный лизат сорбировали на лунки 96-луночных планшетов по 50 мкл с концентрацией белка 5 мкг на лунку и высушивали в термостате при 36,5°С в течение 18-20 ч.
Постановку непрямого иммуноферментного анализа осуществляли по общепринятой методике: блокировка открытых связей 1% бычьим сывороточным альбумином на 0,01 М ФБР в термостате в течение 1,5 ч, удаление блокирующего раствора, титрование исследуемой сыворотки морской свинки с двукратным шагом в длинном ряду 96-луночного планшета, начиная с разведения 1 : 100 до 1 : 204 800. Связывание твердофазного антигена с иммунными сыворотками проходило в термостате в течение 1,5 ч. После завершения контакта планшеты промывали трижды по 200 мкл на лунку 0,01 М ФБР с 0,05% Твин-20. Иммунные комплексы выявляли с помощью конъюгата Protein A-Peroxidase («Sigma») в рабочем разведении 1 : 500 по 100 мкл на лунку в течение 1 ч в термостате. Далее планшеты отмывали пятикратно 0,01 М ФБР с 0,05% Твин-20 и детектировали иммунные комплексы субстратным раствором тетраметилбензидина с перекисью водорода в течение 15 мин в темноте. Реакцию останавливали 4N H2SO4. Оптическую плотность измеряли на фотометре «Bio-Rad 680» при длине волны 450 нм.
Определение экспрессии рецепторов для а- и у-интерферонов (ИФН) человека
Выделение лимфоцитов из венозной крови человека 0 группы Rh+ и пробоподготовка для прямой реакции иммунофлюоресценции подробно описаны в работах [6][7]. Мононуклеарные клетки человека (МКЧ) выделяли из гепаринизированной крови в градиенте фиколла при плотности 1,077 г/см 3 («PanEco»). Полученные МКЧ ресуспендировали в среде RPMI-1640 с 1% бычьего сывороточного альбумина, индуцировали антигенами VZV, культивировали в инкубаторе при 36,5°С и 5% СО2 и в разные временные интервалы готовили образцы, индуцированные VZV МКЧ, для прямой реакции иммунофлюоресценции. Приготовленные образцы окрашивали ФИТЦ-конъюгатами на основе моноклональных антиидиотипических антител, структурно имитирующих α/β- и у-ИФН человека. Эти антиидиотипические антитела являются антирецепторными для ИФН-α/β и ИФН-у. После мечения маркерными препаратами их оценивали в люминесцентном микроскопе «Optika» при длине волны 510-550 нм.
Получение гемагглютинина VZV по E. Norrby [8]
Для постановки реакции торможения гемаг- глютинирующей активности (РТГА) специфических анти-VZV-иммунных сывороток [8] получили гемагглютинин из ВСЖ Ellen VZV.
ВСЖ получали путем инфицирования культуры клеток Vero-CCL 81 лабораторным штаммом Ellen VZV. ВСЖ осветляли центрифугированием при 1500 об/мин в течение 30 мин и обрабатывали Твин-80 и эфиром. Обработанный материал вновь центрифугировали при тех же условиях, в результате происходило расслаивание смеси. Гемагглютинирующий антиген находился в нижнем слое, который аккуратно отсасывали во флакон, закрывали стерильной марлевой салфеткой и оставляли на ночь для освобождения от паров эфира. Для определения титра вирусного гемагглютинина ставили реакцию гемагглютинации (РГА) со взвесью эритроцитов морской свинки.
РГА применяли для выбора рабочего разведения гемагглютинирующего антигена для постановки РТГА. В основе последней лежала задержка гемагглютинирующего действия вирусного антигена специфическими иммунными сыворотками.
РТГА. В реакции использовали рабочее разведение антигена, содержащее в 0,25 мл 2 единицы антигена. До постановки реакции исследуемые сыворотки освобождали от термолабильных (прогревание при 56°С в течение 30 мин) и термостабильных (обработка фильтратом холерного вибриона) ингибиторов. Реакцию проводили по стандартной методике. За титр антител принимали предельное разведение сыворотки, полностью подавляющее гемагглютинирующую активность антигена.
Определение иммуногенности холодоадаптированных (ХА) вакцинных штаммов vFiraVax VZV и vZelVax HZV проводили на животной модели. Морским свинкам массой 300-400 г вводили подкожно одну прививочную дозу вакцины против ВО и ОГ. Через 2, 3 и 5 мес с момента иммунизации из сердца извлекали кровь для постановки реакции нейтрализации и РТГА.
Из иммунных сывороток были удалены термолабильные и термостабильные ингибиторы для реакции нейтрализации и РТГА. В качестве нейтрализующего вируса в реакции нейтрализации использовали вакцину VariVax (США), содержащую 1000 БОЕ50/0,5 мл или 6 lg ГАДЕ50/0,5 мл.
Реакция нейтрализации была поставлена на клетках КМ 27. Реакцию нейтрализации учитывали на 7-е сутки с момента постановки, титр устанавливали на основе 100% защиты клеточных культур.
Статистическую обработку проводили с помощью t-критерия Стьюдента.
РЕЗУЛЬТАТЫ
В процессе холодовой адаптации вирусы, как правило, приобретают мутации по температурочувствительности (ts-фенотип) и холодоадаптированности (ca-фенотип). Эти два фенотипа являются основными лабораторными контролями кандидатов в вакцинные штаммы для живой вирусной вакцины, т.е. основными биологическими маркерами аттенуированных вирусных штаммов [9].
В табл. 1 и 2 представлены результаты титрования аттенуированных штаммов и диких родительских штаммов VZV и HZV на диплоидных клетках ФЭМС и MRC-5.
Таблица 1. Определение ts- и са-маркеров биологической аттенуации кандидатов в вакцинные штаммы VZV на клетках ФЭМС
Table 1. Identification of ts- and ca-markers of biological attenuation of candidate VZV vaccine strains on GPFF cells
Инфекционный титр VZV и НZV при различных температурных режимах, lg гАдЕ50/0,1 мл
The VZV and HZV infectious titer at different temperatures, lg HAU50/0,1 ml
vFiraVax VZV, 19-й пассаж, ВСЖ, 11 сут
vFiraVax VZV, 19 th passage, vaccinated liquid, 11 days
vFiraVax VZV, 19-й пассаж, инфицированные клетки, 11 сут
vFiraVax VZV, 19 th passage, infected cells, 11 days
pFira VZV, 2-й пассаж, ВСЖ, 11 сут
pFira VZV, 2 nd passage, vaccinated liquid, 11 days
vZelVax HZV, 19-й пассаж, ВСЖ, 11 сут
vZelVax HZV, 19 th passage, vaccinated liquid, 11 days
vZelVax HZV, 19-й пассаж, инфицированные клетки, 11 сут
vZelVax HZV, 19 th passage, infected cells, 11 days
pZel HZV, 2-й пассаж, ВСЖ, 11 сут
pZel HZV, 2 nd passage, vaccinated liquid, 11 days
Примечание. Здесь и в табл. 2-6: v — вакцинный штамм, p — родительский штамм.
Note. Here and in Tables 2-6: v — a vaccine strain, p — a parental strain.
Таблица 2. Определение ts- и са-маркеров биологической аттенуации кандидатов в вакцинные штаммы VZV на клетках MRC-5
Table 2. Identification of ts- and ca-markers of biological attenuation of candidate VZV vaccine strains on MRC-5 cells
Инфекционный титр VZV и НZV при различных температурных режимах, lg гАдЕ50/0,1 мл
The VZV and HZV infectious titer at different temperatures, lg HAU50/0,1 ml
vFiraVax VZV, 19-й пассаж, ВСЖ, 11 сут
vFiraVax VZV, 19th passage, vaccinated liquid, 11 days
vFiraVax VZV, 19-й пассаж, инфицированные клетки, 11 сут
vFiraVax VZV, 19th passage, infected cells, 11 days
pFira VZV, 2-й пассаж, ВСЖ, 11 сут
pFira VZV, 2nd passage, vaccinated liquid, 11 days
vZelVax HZV, 19-й пассаж, ВСЖ, 11 сут
vZelVax HZV, 19th passage, vaccinated liquid, 11 days
vZelVax HZV, 19-й пассаж, инфицированные клетки, 11 сут
vZelVax HZV, 19th passage, infected cells, 11 days
pZel HZV, 2-й пассаж, ВСЖ, 11 сут
pZel HZV, 2nd passage, vaccinated liquid, 11 days
Представленные в табл. 1 и 2 результаты демонстрировали, что кандидаты в вакцинные вирусные штаммы vFiraVax VZV и vZelVax HZV не репродуцировались при непермиссивной температуре 39°С, т.е. обладали температурочувствительностью — ts-фенотипом, и репродуцировались более эффективно при субоптимальной температуре, т.е. обладали холодоадаптированностью — са-фенотипом.
Кандидаты в вакцинные штаммы должны также различаться по способности репродуцироваться в клеточной культуре ФЭМС. При этом аттенуированные штаммы VZV должны обладать более высокой репродуктивной активностью в этих клетках по сравнению с дикими вирусными изолятами.
В табл. 3 представлены результаты определения титров аттенуированных и родительских вирусов VZV и HZV, репродуцирующихся в клетках ФЭМС и оцененных по реакции гемадсорбирующей активности на диплоидных клетках ФЭМС.
Таблица 3. Сравнительная репродуктивная активность аттенуированных и родительских вирусных штаммов VZV в клетках ФЭМС
Table 3. Comparative reproductive activity of attenuated and parental VZV virus strains in GPFF cells
Инфекционный
титр VZV и НZV, lg ГАДЕ50/0,1 мл
Infectious titer VZV and НZV, lg HAU50/0,1 ml
vFiraVax VZV, 19-й пассаж, ВСЖ, 14 сут
vFiraVax VZV, 19 th passage, vaccinated liquid, 14 days
pFira VZV, 2-й пассаж, ВСЖ, 14 сут
pFira VZV, 2 nd passage, vaccinated liquid, 14 days
vZelVax HZV, 19-й пассаж, ВСЖ, 14 сут
vZelVax HZV, 19 th passage, vaccinated liquid, 14 days
pZel HZV, 2-й пассаж, ВСЖ, 14 сут
pZel HZV, 2 nd passage, vaccinated liquid, 14 days
Результаты, представленные в табл. 3, показывали, что инфекционная активность родительских вариантов VZV, установленная на клетках ФЭМС, на 1,5-2,0 lg ГАДЕ50/0,1 мл ниже по сравнению с аттенуированными штаммами VZV. Это указывало на другой биологический маркер аттенуации кандидатных вакцинных штаммов для живых культуральных вакцин.
Нами разработаны новые маркеры биологической аттенуации кандидатных вакцинных штаммов VZV.
Антиидиотипические моноклональные антитела, направленные к рецепторам ИФН-α/β и ИФН-у на иммунокомпетентных клетках человека, индуцированных in vitro VZV, использовали для оценки количественных показателей уровня экспрессии ИФН-рецепторов [6][7]. Ранее на модели различных штаммов вируса кори нами показано, что уровень и продолжительность экспрессии ИФН-рецепторов находились в обратной зависимости от степени аттенуации вируса кори [10].
Проведена сравнительная оценка показателей экспрессии рецепторов ИФН-α/β и ИФН-у на МКЧ периферической крови, индуцированных кандидатными ХА-штаммами vFiraVax VZV и vZelVax HZV на ранних и поздних пассажных уровнях. В табл. 4 и 5 представлены результаты этого исследования. Полученные данные показали, что оба вирусных ХА-штамма VZV индуцировали более низкий уровень экспрессии рецепторов для ИФН-α/β и ИФН-у в сравнении с их родительскими вариантами. Данный биологический маркер аттенуации кандидатных штаммов VZV назвали экспресс-ИФН-фенотипом. Этот фенотип может быть использован и для других аттенуированных вирусных вакцинных штаммов.
Таблица 4. Сравнительная экспрессия рецепторов для ИФН-a/p (в %) на МКЧ, индуцированных in vitro аттенуированными и родительскими штаммами VZV на разных пассажных уровнях
Table 4. Comparative expression of IFN-a/p receptors (%) on HMC induced in vitro by attenuated and parental VZV strains at different passage levels
Экспрессия рецепторов для ИФН-α/β на МКЧ в различные временные интервалы (в часах)
Expression of IFN-α/β receptors on HMC at different time intervals (hours)
pFira VZV, 3-й пассаж pFira VZV, 3 rd passage
vFiraVax VZV, 17-й пассаж vFiraVax VZV, 17 th passage
pZel HZV, 3-й пассаж pZel HZV, 3 rd passage
vZelVax HZV 17-й пассаж vZelVax HZV, 17 th passage
Примечание. Здесь и в табл. 5: уровень экспрессии ИФН-рецепторов определяли путем вычисления процентного соотношения светящихся клеток из общего числа 2000 клеток, подсчитанных на 4 образцах МКЧ для каждого временного интервала. # Вирус сконцентрирован ультрацентрифугированием и очищен в сахарозном градиенте.
vFiraVax VZV, 17-й пассаж
vFiraVax VZV, 17 th passage
pZel HZV, 3-й пассаж
pZel HZV, 3 rd passage
vZelVax HZV, 17-й пассаж
vZelVax HZV, 17 th passage
Еще одним биологическим маркером аттенуации для вакцинных штаммов VZV является вирулентность аттенуированных штаммов (att-фенотип). Нами обнаружено, что при заражении ХАО развивающихся куриных эмбрионов ВСЖ от дикого вируса эмбрионы гибли, а если оставались живыми, то на ХАО появлялась обширная геморрагия кровеносных сосудов. При заражении ХАО ВСЖ от аттенуированных штаммов VZV на ХАО обнаруживали белые оспины.
Важным свойством аттенуированных вакцинных вирусных штаммов является их иммуногенность. В табл. 6 приведены результаты титрования иммунных сывороток в реакции нейтрализации и РТГА.
Таблица 6. Иммуногенность аттенуированных вакцинных штаммов vFiraVax VZV и vZelVax HZV, установленная иммунизацией морских свинок с оценкой в реакции нейтрализации на культуре клеток и в РТГА в различные временные интервалы
Table 6. Immunogenicity of attenuated vFiraVax VZV and vZelVax HZV vaccine strains through immunization of guinea pigs and a neutralization test on cell culture and in HAI assay at different time intervals
Иммунные сыворотки к вакцинным штаммам
VZV Immune sera for VZV vaccine strains
Реакция нейтрализации (со 100% защитой)
Neutralization test (at 100% protection)
РТГА (гемагглютинин, штамм Ellen VZV)
HAI assay (hemagglutinin, Ellen VZV strain)
срок с момента иммунизации, мес
time since immunization, months
vFiraVax VZV, 20-й пассаж
vFiraVax VZV, 20 th passage
vZelVax HZV, 20-й пассаж
vZelVax HZV, 20 th passage
Нейтрализующий VZV-штамм vOka, 1000 доз
Neutralizing VZV strain vOka, 1000 doses
Результаты, представленные в табл. 6, показали, что нейтрализующая активность иммунных вирусспецифических сывороток по отношению к кандидатным вакцинным штаммам vFiraVax VZV и vZelVax HZV как в реакции нейтрализации, так и в РТГА была высокой. При этом надо отметить, что титры иммунных сывороток в реакции нейтрализации оставались высокими на протяжении всех 5 мес исследования, в то время как титры иммунных сывороток в РТГА к этому сроку снизились почти в 4 раза. Известно, что вирусные гемагглютинины менее стабильны по сравнению с вирусными нейтрализинами.
Обсуждение
В данном исследовании мы изучали биологические маркеры аттенуации созданных нами ХА кандидатных штаммов VZV и HZV для создания живых культуральных вакцин против ВО у детей и ОГ у взрослых после 50 лет.
Экспериментально было установлено, что оба ХА-штамма обладали основными биологическими маркерами аттенуации: ts- и ca-фенотипом (табл. 1, 2). Для вирусных штаммов VZV характерен еще один дополнительный фенотип, названный нами cell-фенотипом, т.е. изменение тканевого тропизма. Дикие варианты клинических изолятов VZV, как правило, обладают более низкой репродуктивной активностью в первичных клетках эмбрионов морской свинки в сравнении с аттенуированными вирусными штаммами. Экспериментально установлено, что ХА-штаммы vFiraVax VZV и vZelVax HZV обладали cell-фенотипом (табл. 3).
В настоящее время не существует модельного объекта для оценки вирулентности VZV — att-фенотипа. Нами обнаружено, что подходящей моделью является ХАО развивающихся куриных эмбрионов. Установлено, что родительские варианты вирусов VZV вызывают гибель эмбрионов или обширную геморрагию ХАО, а ХА вирусные штаммы VZV вызывали образование белых оспин. Кандидатные ХА-штаммы vFiraVax VZV и vZelVax HZV оказались авирулентными и обладали att-фенотипом. Этот же метод можно использовать для оценки генетической стабильности вакцинных вирусных штаммов VZV.
Нами предложен новый маркер биологической аттенуации кандидатных вакцинных штаммов. Так, ранее нами был разработан новый методический подход к оценке функционального состояния системы ИФН [6][7]. С этой целью использовали высокочувствительные и специфичные флюоресцирующие зонды на основе моноклональных антиидиотипических антител, имитирующих биологические эффекты ИФН-α/β и ИФН-у человека. Обследование образцов крови доноров с различными группами крови не выявило на МКЧ экспрессии рецепторов для ИФН-а и ИФН-у, что указывало на сбалансированное функционирование системы ИФН в организме [7]. При индукции in vitro МКЧ периферической крови доноров различными штаммами вирусов кори установлено, что уровень и продолжительность экспрессии рецепторов для различных типов ИФН находились в обратной зависимости от степени аттенуации вируса кори [10].
В наших экспериментах ХА-штаммы VZV и HZV экспрессировали на мембранах МКЧ более низкий уровень рецепторов для ИФН-α/β и ИФН-у (табл. 4 и 5), и эти показатели были стабильными, что позволило нам считать этот экспресс-ИФН-фенотип характерным для всех аттенуированных вакцинных штаммов.
Самым важным свойством живых ХА-вакцин является их более высокая эффективность по сравнению с инактивированными вакцинами, поскольку они обладают способностью вызывать более эффективные врожденный и адаптивный гуморальный и клеточный иммунные ответы [11][12].
Иммуногенность аттенуированных вакцинных штаммов vFiraVax и vZelVax изучали путем подкожной иммунизации морских свинок. Оценивали гуморальный иммунный ответ в реакциях нейтрализации против 1000 доз вируса, содержащихся в вакцине OkaVax/Merck (США), и в РТГА против 2-гемагглютинирующих единиц гемагглютинина, полученного из лабораторного вирусного штамма Ellen VZV. ХА-вакцинные штаммы vFiraVax VZV и vZelVax HZV обладали высокой иммуногенностью на протяжении 5 мес наблюдения (табл. 6).
Таким образом, нами созданы и охарактеризованы два ХА-вакцинных штамма: vFiraVax VZV и vZelVax HZV — кандидаты для создания живых культуральных вакцин для профилактики ВО у детей и ОГ у взрослых.
Список литературы
1. Greenberg H.B., Arvin A.M. Live attenuated vaccines: influenza, rotavirus and varicella zoster virus. In: Dormitzer P., Mandl C., Rappuoli R., eds. Replicating Vaccines. Birkhäuser Advances in Infectious Diseases. Basel: Springer Basel; 2011. DOI: http://doi.org/10.1007/978-3-0346-0277-8_2
2. Gould D. Varicella zoster virus: chickenpox and shingles. Nurs. Stand. 2014; 28(33): 52-8. DOI: http://doi.org/10.7748/ns2014.04.28.33.52.e8249
3. Kennedy P.G.E., Gershon A.A. Clinical features of varicella – zoster virus infection. Viruses. 2018; 10(11): 609-20. DOI: http://doi.org/10.3390/v10110609
4. Sadaoka T., Mori Y. Vaccine development for varicella – zoster virus. Adv. Exp. Med. Biol. 2018; 1045: 123-42. DOI: http://doi.org/10.1007/978-981-10-7230-7_7
5. Seward J.F., Marin M., Vázquez M. Varicella vaccine effectiveness in the US vaccination program: a review. J. Infect. Dis. 2008; 197(Suppl. 2): S82-9. DOI: http://doi.org/10.1086/522145
6. Баркова Е.П., Нагиева Ф.Г., Кузнецов В.П., Беляев Д.Л., Никулина В.Г., Бабаянц А.А. и др. Экспрессия рецепторов для человеческих α- и γ-интерферонов на поверхности мононуклеарных клеток периферической крови при вирусных инфекциях. Вопросы вирусологии. 1999; 44(1): 16-8.
7. Баркова Е.П., Вдовина Е.Т., Нагиева Ф.Г., Ющук Н.В., Знойко О.О., Никулина В.Г. и др. Функциональная активность интерфероновых рецепторов мононуклеаров периферической крови пациентов с вирусными гепатитами. Биопрепараты. 2001; (4): 18-21.
8. Norrby E. Hemagglutination by measles virus. 4. A simple procedure for production of high potency antigen for hemagglutination-inhibition (HI) tests. Proc. Soc. Exp. Biol. Med. 1962; 3(3): 814-8. DOI: http://doi.org/10.3181/00379727-111-27930
9. Исакова И.Н., Киселева И.В., Ларионова Н.В., Олейник Е.С., Руденко Л.Г. Лабораторные маркеры аттенуации штаммов живой гриппозной вакцины. Вопросы вирусологии. 2007; 52(4): 22-6.
10. Баркова Е.П., Нагиева Ф.Г., Лавров В.Ф., Никулина В.Г., Ляшенко В.А. Экспрессия интерфероновых рецепторов и мембраносвязанных интерферонов на поверхности иммунокомпетентных клеток, инфицированных различными штаммами вируса кори. Актуальные вопросы эпидемиологии инфекционных болезней. 2006; (8): 123-5.