белок mtor что это
Таргетная терапия
Что такое таргетная терапия?
Таргетная терапия – это специальные лекарства, которые уничтожают определенные типы раковых клеток. Они воздействуют исключительно на вещества, благодаря которым некоторые виды онкологии растут и распространяются по организму.
Название метода происходит от английского слова «target» – цель или мишень. Именно так он и работает – точно против измененных тканей.
Чем таргетная терапия отличается от химиотерапии?
Подобные вещества, так же как и другие используемые для лечения рака лекарства, технически считаются химиотерапией, но принцип их действия отличается:
Как работает таргетная терапия?
Таргетные препараты предназначены для воздействия на определенные вещества в раковых клетках: избыток некоторых белков, а также соединения или изменения генов, которые отсутствуют в нормальных тканях.
Такие лекарства умеют:
Виды таргетной терапии
Существует несколько типов препаратов, каждый из которых выполняет определенную задачу.
Ингибиторы ангиогенеза: блокируют образование новых кровеносных сосудов, которые необходимы новообразованию для питания и быстрого роста – например, бевацизумаб, применяющийся при нескольких видах рака.
Моноклональные антитела: доставляют в опухолевую клетку молекулы, которые ее убивают. Одни их виды называют таргетной терапией, поскольку у них есть конкретная цель в онкологической клетке, которую они стремятся найти и атаковать. Другие действуют как иммунотерапия, стимулирующая иммунную систему и помогающая ей обнаруживать онкологию и бороться с ней. К таким лекарствам относят трастузумаб, работающий при некоторых типах новообразований молочной железы, и цетуксимаб, назначающийся пациентам с опухолями прямой кишки, легких, головы и шеи.
Ингибиторы протеасом: нарушают нормальную работу клеток, что приводит к их гибели. Их примером является бортезомиб, применяющийся при множественной миеломе – заболевании кроветворной системы.
Ингибиторы сигнальной трансдукции: блокируют активность молекул, передающих сигналы между клетками. Так работает препарат иматиниб, применяющийся при некоторых типах хронической лейкемии – поражении костного мозга, приводящем к образованию измененных клеток крови.
Высококвалифицированные специалисты Онкоцентра «Лапино-2» проводят любое противораковое лечение, включая таргетное – без очередей, задержек и потерь времени.
Как принимают таргетную терапию?
На сегодняшний день существует несколько форм, в которых выпускаются подобные препараты. Их можно принимать внутрь, как обычные таблетки, капсулы или сиропы, либо внутривенно.
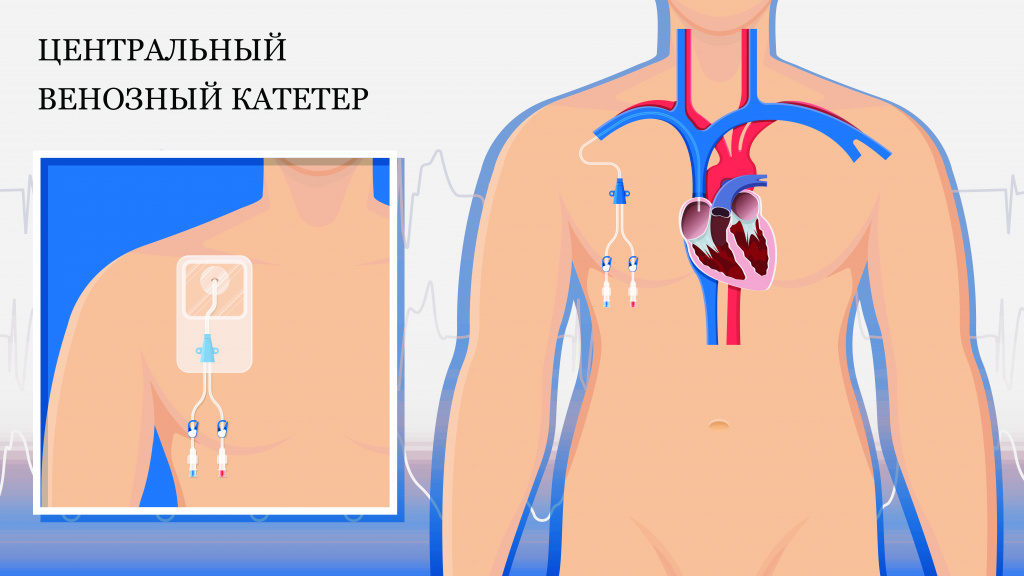
Лекарства доставляют в организм через обычный катетер – тонкую мягкую пластиковую трубку в кровеносном сосуде, или центральный венозный, так называемый порт – устанавливаемое под кожу устройство. Они вводятся специалистом за несколько минут или часов.
Оральная таргетная терапия обычно принимается по четкому графику дома. Каждый пациент получает четкие инструкции о том, сколько, когда и как это нужно делать. Дозы средства рассчитываются таким образом, чтобы в организме постоянно присутствовало необходимое количество данных веществ, уничтожающих раковые клетки.
Любой малейший сбой или отклонение от схемы может повлиять на эффективность лечения.
О каждом пропуске или задержке в приеме препарата нужно сообщить врачу, который решит, как действовать в данной ситуации.
Порты для таргетной и химиотерапии
Центральный венозный катетер, или порт – удобное решение для онкобольных, которым нужно регулярно получать внутривенное лечение и сдавать кровь. С течением времени состояние их сосудов ухудшается из-за постоянных проколов, а попытки введения препаратов превращаются в пытку как для пациентов, так и для медицинского персонала.
Практически незаметное устройство, обычно устанавливаемое под кожу чуть ниже ключицы, эту проблему решает – его обладатели не испытывают проблем со сдачей анализов и доставкой в организм препаратов.
Преимуществ у портов много: они позволяют сократить количество уколов, избежать дискомфорта при проведении химио- или таргетной терапии, и уменьшить риски попадания препаратов на кожу, а значит и ее раздражения.
К их минусам можно отнести вероятность засорения катетера, появление в нем сгустков крови, его перекручивание либо смещение. Избежать неприятных последствий не сложно – достаточно строго следовать инструкциям по очистке, тщательно мыть руки, стараться избегать по нему ударов и не заниматься контактными видами спорта.
Побочные эффекты таргетной терапии
Несмотря на то, что таргетные препараты работают против раковых клеток и практически не повреждают здоровые, после их приема могут возникнуть побочные эффекты. Они встречаются не у всех пациентов и отличаются от «побочек» обычной химиотерапии, которая воздействует на все ткани тела.
Большая часть неприятных последствий проходит после окончания лечения, но поскольку многие вещества изобретены совсем недавно, долгосрочные последствия их приема еще изучены не полностью.
Проблемы с кожей
Самая распространенная из них – сыпь, обычно возникающая голове, лице, шее, груди и верхней части спины.
Чаще всего она начинается с покраснения и припухлостей на первых же неделях лечения, а примерно через месяц кожа покрывается корками, становится пересушенной и красной. У некоторых людей появляются круглые, плоские или выпуклые пятна или гнойные прыщи.
Сыпь вызывает зуд и жжение и нередко приводит к заметному изменению внешности, но обычно полностью проходит примерно через месяц после отмены таргетных препаратов.
Сухость, приводящая к ломкости, зуду, шелушению и даже трещинам – еще одна распространенная проблема, которая возникает практически у всех пациентов, получающих лечение на протяжении полугода.
Некоторые вещества могут вызвать покраснение и болезненность кутикулы, а также появление вокруг ногтей на руках и ногах отечных красных язв, которые нередко инфицируются.
Ладонно-подошвенный синдром – поражение кожи на ладонях и подошвах стоп, связан со многими препаратами для лечения рака, включая химио- и некоторые виды таргетной терапии. Его причина до сих пор точно не известна – возможно, все дело в повреждении крошечных кровеносных сосудов в конечностях или окружающих их тканей. Обычно он развивается в течение первых 2-6 недель лечения, а его первыми симптомами становятся повышенная чувствительность, покалывание или онемение. Затем пострадавшие области опухают, краснеют, как при солнечном ожоге, шелушатся, трескаются и покрываются волдырями.
Применение некоторых средств может привести к ухудшению качества волос – их сухости, ломкости, истончению и появлению залысин.
У части пациентов кожа или волосы темнеют или приобретают желтоватый оттенок.
Кроме того, возможно пересыхание, покраснение и ощущение жжения в области век и глаз.
При появлении сыпи или любых других проблем с кожей необходимо сразу же сообщить об этом врачу-онкологу, поскольку при отсутствии правильного лечения у пациента могут развиться инфекции, требующие отсрочки или даже прекращения терапии.
Другие побочные эффекты целевого лечения похожи на последствия стандартной «химии». К ним относят тошноту и рвоту, диарею или запоры, образование язв во рту, одышку – ощущение нехватки воздуха, кашель, усталость, головную боль, выпадение волос, повреждение печени, почек и щитовидной железы, а также аллергические реакции.
Таргетная терапия различных видов рака
Данные препараты подходят не для всех пациентов – они помогают только в том случае, если в раковых клетках человека присутствуют определенные изменения. Перед назначением лечения врачи проводят биопсию – изымают небольшую частичку новообразования и передают ее в лабораторию, где она тщательно исследуется. Если специалистам удается найти особенности опухоли, для которых уже созданы лекарства, их применяют – часто одновременно с химиотерапией или другими видами вмешательства.
Таргетная терапия рака гортани
Для лечения некоторых запущенных форм онкологии горла и гортани используется Цетуксимаб (Эрбитукс), блокирующий EGFR – белок, который помогает опухолевым клеткам быстро расти. Его можно комбинировать с лучевой или химиотерапией.
Таргетная терапия рака желчных протоков
На сегодняшний день при данном типе онкологии используется 2 типа препаратов:
Таргетная терапия немелкоклеточного рака легкого
Для пациентов с немелкоклеточной онкологией легких создано множество таргетных препаратов:
Таргетная терапия рака молочной железы
Примерно у 1 из 5 женщин с раком груди опухолевые клетки содержат на своей поверхности слишком много стимулирующего их рост белка – HER2. Эти HER2-положительные новообразования быстро развиваются и распространяются по организму. Для их лечения применяются:
Примерно 2 из 3 случаев рака молочной железы чувствительны к гормонам – веществам, которые создаются нашими железами, через кровоток попадают в органы и сообщают им, как действовать – работать или отдыхать, выделять что-то или поглощать. В таких ситуациях применяется гормональная терапия:
Олапариб (Линпарза) и Талазопариб (Талценна): блокируют белки PARP, необходимые для восстановления поврежденной ДНК, что часто приводит к гибели раковых клеток.
Сацитузумаб говитекан: моноклональное антитело, присоединенное к химиотерапевтическому препарату. Лекарство работает в случае избытка в опухоли белка Trop-2, помогающего ей быстро расти и распространяться по организму.
Таргетная терапия рака печени
Для пациентов с раком печени есть несколько типов таргетных препаратов:
Таргетная терапия рака пищевода
При лечении рака пищевода используется несколько типов таргетных препаратов.
Некоторые типы опухолей содержат слишком много белка HER2, который способствует быстрому росту онкологических клеток. Такие заболевания называются HER2-положительными. Против них можно применять:
Таргетная терапия рака поджелудочной железы
Для лечения онкологии поджелудочной железы используются:
Таргетная терапия рака почки
Врачи применяют 2 типа таргетных препаратов для лечения рака почки. Их назначают пациентам с запущенным заболеванием для снижения скорости разрастания опухоли или уменьшения ее размеров.
Таргетная терапия рака предстательной железы
При лечении онкологии простаты используются Рукабариб (Рубрака) и Олапариб (Линпарза) – так называемые ингибиторы PARP. Данные лекарства не позволяют восстанавливаться поврежденной ДНК в клетках новообразований, что приводит к их гибели.
Таргетная терапия саркомы матки
Пазопаниб (Вотриент): назначается при лейомиосаркоме – опасной для жизни опухоли гладкой мускулатуры матки, которая распространилась по организму или вернулась после проведенного лечения.
Таргетная терапия рака щитовидной железы
В случае папиллярного или фолликулярного рака щитовидной железы применяют 3 типа препаратов:
При медуллярном раке используются:
При анапластических новообразованиях применяются:
Таргетная терапия рака яичников
Пациенткам с онкологией яичников могут назначаться:
В Онкоцентре «Лапино-2» проводится не только инновационная таргетная терапия, но и любое другое противоопухолевое лечение всех типов онкологии самыми современными препаратами.
Трансляция: как и зачем ингибировать биосинтез белка в собственных клетках?
Трансляция: как и зачем ингибировать биосинтез белка в собственных клетках?
3D-структура эукариотической рибосомы
визуализация автора статьи с использованием скрипта проф. Ненада Бана на основе структуры рибосомы 4V88 [17]
Автор
Редакторы
Статья на конкурс «Био/Мол/Текст»: Биосинтез белка (трансляция) — ключевой процесс клеточного метаболизма, в ходе которого специальные молекулярные машины — рибосомы, — раскодируя последовательность нуклеотидов в матричной РНК, производят полипептидную цепь. Как и к любым другим биомолекулам, к компонентам трансляционного аппарата можно подобрать ингибиторы. Подавление трансляции в эукариотических клетках с помощью малых молекул в последние годы всё чаще применяется при терапии различных заболеваний (в том числе генетических). Казалось бы, для чего ингибировать процесс, который обеспечивает клетку строительным материалом, ферментами, регуляторами и прочими необходимыми для жизни компонентами? Дело в том, что часто при раковой трансформации или вирусной инфекции рибосомы начинают «подыгрывать» врагу, смещая трансляцию в сторону «нежелательных» мРНК. Например, вирусы, чтобы качнуть чашу весов в свою сторону, могут использовать множество интересных механизмов для модификации клеточной трансляции. Таким образом, лекарства, которые подавляют биосинтез белка, могут намного сильнее затормозить рост клеток, вышедших из-под контроля, нежели «законопослушных». Это их свойство и используется при терапии.
Конкурс «Био/Мол/Текст»-2021/2022
Эта работа опубликована в номинации «Своя работа» конкурса «Био/Мол/Текст»-2021/2022.
Партнер номинации — компания Cytiva.
Генеральный партнер конкурса — международная инновационная биотехнологическая компания BIOCAD.
Генеральный партнер конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.
Я работаю в лаборатории системной биологии старения в отделе взаимодействия вирусов с клеткой НИИ физико-химической биологии имени А.Н. Белозерского МГУ. На втором курсе моя курсовая работа была связана с поиском ингибиторов трансляции у эукариот и созданием базы таких ингибиторов. Данная статья подготовлена по материалам обзора, опубликованного в спецвыпуске журнала «Биохимия» [1].
Молекулярный аппарат трансляции и его консервативность
Трансляционный цикл на множестве этапов может быть нарушен или замедлен многочисленными и разнородными по химическому строению ингибиторами. Ключевые компоненты трансляционного аппарата клетки — это рибосомы и факторы трансляции (белки, помогающие рибосоме реализовывать разные этапы трансляционного цикла), а также большое количество вспомогательных белков, необходимых для обеспечения синтеза нужными материалами: например, аминоацил-тРНК-синтетазы (АРСазы) — ферменты, соединяющие тРНК с соответствующей ей аминокислотой; или регуляторы биосинтеза белка — компоненты сигнальных путей, связанных с трансляцией. При подборе ингибиторов нельзя не учитывать, что многие из этих молекул есть у всех живых организмов, и некоторые из них довольно консервативны. А значит, одни и те же вещества могут действовать как на про-, так и на эукариот, что не всегда приемлемо.
Каждый живой организм на Земле может быть отнесен к одному из трех доменов жизни: это максимально удаленные друг от друга в эволюционном смысле группы — эукариоты (здесь ищите самые известные царства: животных, растений и грибов), бактерии и археи [2]. Эта удаленность означает, что они давно разошлись (то есть их последний общий предок жил давно [3]), и у представителей групп накопилось множество отличий. Но есть и признаки, по которым представители различных доменов похожи друг на друга. Речь идет об основополагающих признаках: например, способности удваивать ДНК, синтезировать на ее основе РНК и в конце концов получать закодированный в ней белок. Трансляция относится к самым консервативным биологическим процессам.
При ближайшем рассмотрении оказывается, что устройство белоксинтезирующего аппарата довольно схоже у представителей разных доменов. К примеру, основные факторы инициации и элонгации у бактерий имеют гомологов у архей, а рибосомы архей по многим аспектам строения очень напоминают рибосомы эукариот (что даже позволило создать из рибосом дрожжей гибридные рибосомы, в которых одна из субъединица очень напоминала рибосомную субъединицу архей [4]). В пределах этих трех доменов есть отличия, но мы видим, что трансляционная машинерия в целом очень консервативна, и таких отличий не так много. Это является несомненным свидетельством общности (монофилетичности) происхождения жизни.
Хотя это зависит от того, какие критерии для отнесения к живому используются. В зависимости от них под определение «живое» может попасть даже клетка из компьютерной игры Конвея «Жизнь», но под критерии классического определения жизни подпадают всё же только представители этих трех доменов.
Ингибиторы трансляции как антибиотики
Подробнее про различные классы антибиотиков и про то, как они действуют, можно прочитать в статье «Биомолекулы» «Антибиотики vs Бактерии. “Война Бесконечности” или всему есть предел?» [6].
Однако в этой статье речь пойдет об ингибиторах эукариотической трансляции — ведь многие из них служат мощными противоопухолевыми и антивирусными препаратами, используются для иммуносупрессии при пересадке органов или для обезболивания. Некоторые из этих веществ рассматривают даже как возможное «лекарство от старости». Но перед тем как переходить к их рассмотрению, нам придется вспомнить основные этапы трансляционного цикла.
Трансляционный цикл
Чтобы оценить все разнообразие ингибиторов биосинтеза белка, давайте для начала ознакомимся с теми этапами трансляционного цикла, на которые может быть направлено их действие. Эти этапы изображены на рисунке 1 (кликнув на элемент, вы можете прочитать про него подробнее в «Википедии»). Кстати, некоторые этапы этого сложного процесса до сих пор плохо изучены.
Рисунок 1. Трансляционный цикл эукариот (с подсказками!) и избранные сигнальные каскады, влияющие на него. Также показаны самые известные и изученные ингибиторы цикла (черная рамка означает принципиально другой механизм действия). Вещества сгруппированы в соответствии со стадиями синтеза белка, в которых участвуют их мишени. Стадии обозначены кодами. Инициация трансляции: i.1 — связывание eIF2 с Met-тРНК и образование тройного комплекса eIF2/Met-тРНКi/GTP (TC); i.2 — взаимодействие eIF4A и eIF4G; i.3 — взаимодействие eIF4E и eIF4G; i.4 — связывание eIF4E с m 7 G-кэпом на 5′-конце мРНК; i.5 — ингибирование хеликазной (расплетающей мРНК) активности eIF4A при посадке eIF4F на мРНК и последующем рибосомном сканировании; i.6 — узнавание AUG-кодона при сканировании; i.7 — взаимодействие eIF5B с 60S-субъединицей; i.8 — взаимодействие eIF6 с 60S-субъединицей; i.9 — присоединение 60S-субъединицы к 48S преинициаторному комплексу (48S PIC) с образованием 80S инициаторного комплекса (80S IC). Элонгация и сопутствующие реакции: e.1 — аминоацилирование тРНК; e.2 — диссоциация eEF1A/GDP после доставки аминоацил-тРНК (Аа-тРНК); e.3 — продвижение полипептида в рибосомном тоннеле; e.4 — декодирование; e.5 — пептидилтрансферазная реакция; e.6 — транслокация; e.7 — диссоциация eEF2/GDP после транслокации. Терминация: t.1 — узнавание стоп-кодона; t.2 — гидролиз пептидил-тРНК. Рециклинг: r.1 — диссоциация 60S-субъединицы. Коды модуляторов сигнальных каскадов: s.1–s.3 — активаторы киназ фактора eIF2; s.4 — ингибиторы фосфатаз фактора eIF2; s.5 — ингибиторы киназы PI3K; s.6 — ингибиторы активного центра киназы mTOR; s.7 — аллостерические ингибиторы mTOR в составе комплекса mTORC1. Рисунок позаимствован из нашей статьи в журнале «Биохимия» [1]. Более полная его версия с поясняющими таблицами доступна на сайте базы ингибиторов EuPSIC
Схема может показаться сложной, но в действительности это не так. Попробуйте выхватить взглядом желтую 40S-субъединицу (в свободном от других компонентов трансляции виде ее можно найти рядом со стадией i.1) и пройтись по циклу, как в настольной игре, посмотрев на все, что успевает с ней за это время произойти. Особенно любознательным предлагаем покликать по элементам схемы и прочитать о каждом из этапов дополнительно.
Этапы трансляции
Трансляционный цикл принято подразделять на несколько этапов:
Отдельно происходит активация аминокислот с помощью аминоацил-тРНК-синтетаз (см. e.1 на рисунке 1).
Некоторые трансляционные факторы известны уже очень давно, для них понятна функция, известны ортологи у архей и бактерий (подробнее про гомологичные взаимоотношения генов можно прочитать здесь [7]) и выяснено, являются ли они строго необходимыми для синтеза белка — ведь некоторые вирусные мРНК, например, могут обходиться без целого ряда факторов инициации трансляции [8], [9]. Роль других участников была открыта относительно недавно. Примером таких белков служат факторы DENR и MCTS1 (см. область рециклинга (r) на рисунке 1), изучением которых, кстати, занимается наша лаборатория.
На рисунке 1 (см. s.1, s.2) также изображена часть путей внутриклеточного сигналинга, которые непосредственно регулируют трансляцию. Кроме того, существует еще и сложнейший процесс сборки рибосомы из рибосомной РНК и белков, который протекает по большей части в ядре. Его также можно подавить низкомолекулярными веществами, но о них известно гораздо меньше, а их специфичность часто оставляет желать лучшего.
Типы ингибиторов
С ингибиторами трансляции удобно знакомиться, если классифицировать их согласно мишеням, на которые они воздействуют.
Ингибиторы эукариотической рибосомы
Многие из ингибиторов действуют на рибосомы. При этом они могут быть универсальными (подавлять трансляцию у всех доменов живого), а могут — специфичными (например, к рибосоме эукариот или даже каких-то узких таксономических групп). Специфичность действия, как правило, определяется тонкими различиями в строении места связывания: структурные исследования показывают, что часто достаточно замены одного нуклеотида в рРНК или разницы в единственной аминокислотной позиции рибосомного белка, чтобы конфигурация участка не позволяла ингибитору связаться. Подавляющее большинство ингибиторов рибосомы действует на стадии элонгации, однако существуют и другие типы, перечисленные в таблице 1 (заметьте, что пункты могут перекрываться).
| Типы ингибиторов | Классы химических веществ и известные представители | Краткие комментарии |
|---|---|---|
| Рибосом-направленные ингибиторы инициации трансляции | Эдеин, MDMP, eIFsixty-4 | Небольшая группа ингибиторов, механизмы действия которых сильно различаются. Основной механизм — нарушение взаимодействия с лигандами: блокирование связывания факторов инициации или нарушение аккомодации инициаторной тРНК (рис. 1: i.6–i.9). |
| Рибосом-направленные ингибиторы элонгации (кроме веществ, вызывающих ошибки декодирования) | Анизомицин, гомохаррингтонин, трихотецины, квассиноиды, амикумацин A, циклогексимид, эметин, лиссоклимид, гигромицин B, тетраценомицин X и другие | Большая и разнообразная по химическому строению и механизмам действия группа. Могут действовать на транспептидацию, транслокацию, вызывать преждевременную терминацию или блокировать пептидный тоннель. Как правило, связываются с функциональными сайтами рибосомы. Эти сайты вместе с избранными ингибиторами, присоединенными к рибосоме, можно изучить на рис. 5. Интересно, что некоторые ингибиторы элонгации, действующие на ее самые начальные стадии, часто путают с ингибиторами инициации. Самым известным таким ингибитором является гомохаррингтонин (рис. 2). Все ингибиторы, представленные на рисунке 5, кроме TC007 и паромомицина, относятся именно к данному типу (рис. 1: e.3, e.5, e.6). |
| Вещества, вызывающие ошибки декодирования | Аминогликозиды (преимущественно с 2-DOS кольцом) и ряд других ингибиторов [6] | Основное место связывания таких веществ на эукариотической рибосоме — декодирующий центр малой субъединицы (спираль h44, см. рис. 5). Это связывание вызывает стабилизацию той конформации, которую рибосома должна принимать при наличии «правильной» аминоацил-тРНК в А-сайте. В результате реакция по переносу остатка аминокислоты может произойти, даже если там находится не соответствующая кодону тРНК, что вызывает ошибки декодирования, а также «проскок» стоп-кодона (подробнее это описано ниже на примере аталурена) — рис. 1: e.4. |
| Рибосомные ингибиторы, влияющие на терминацию | Аминогликозиды, гиролин | Совсем небольшая группа ингибиторов. У эукариот вещества, специфично блокирующие собственно терминацию (высвобождение полипептида), изучены плохо. Поэтому список ингибиторов t.1 в основном представлен веществами из предыдущего списка (e.4), т.к. их влияние на точность декодирования сказывается в том числе и на узнавании стоп-кодона, что вызывает его «проскок». Подтвержденным ингибитором высвобождения пептида у эукариот является, пожалуй, пока только гиролин (рис. 1: t.1, t.2). |
| Ингибиторы рибосомного рециклинга | Некоторые аминогликозиды, бацифелацин и неоквассин | Пока что веществ, которые бы специфично действовали на эту стадию, не обнаружено, но, возможно, это просто вопрос времени. Механизмы рециклинга и вовлеченные в него факторы сильно различаются у эукариот и бактерий, а у архей эта стадия изучена особенно плохо (рис. 1: r.1). |
Если классифицировать по сайтам связывания, то выделяют: ингибиторы пептидилтрансферазного центра; ингибиторы транслокации, узнающие E-сайт; ингибиторы, связывающиеся в пептидном тоннеле; ингибиторы, взаимодействующие с декодирующим центром; ингибитор, связывающийся с ГТФаза-активирующим центром (пока достоверно описан только один такой пример).
Пока не так много веществ этого типа допущены до практического применения (самое известное из них — гомохаррингтонин (рис. 2)), но их число постепенно растет. Клинические и доклинические испытания проходили, например, такие ингибиторы пептидилтрансферазного центра, как ликорин, нарциклазин и бруцеантин, а ингибитор транслокации эметин используется как антигельминтное и противомалярийное средство.
Интересные случаи применения
Гомохаррингтонин. Рибосом-направленные ингибиторы элонгации
Гомохаррингтонин — ингибитор пептидилтрансферазного центра в виде полусинтетического аналога омацетаксина мепесукцината (продаваемого под торговой маркой Synribo; рис. 2) активно применяется для лечения хронического миелоидного лейкоза, а также проходит испытания в терапии ряда других онкологических заболеваний. Кроме того, его широко используют в научной работе: его способность прекращать трансляцию новоинициировавших рибосом (при этом не трогая рибосомы, которые уже успели синтезировать несколько пептидных связей) применяется для картирования старт-кодонов в мРНК.
Рисунок 2. «Синрибо». Применяется для лечения хронического миелоидного лейкоза у людей, лечение которых ингибиторами тирозинкиназ не дало желаемого эффекта. Одобрен одновременно как американским (FDA), так и европейским (EMA) медико-биологическим агентствами.
Аталурен и гентамицин. Вещества, вызывающие ошибки декодирования
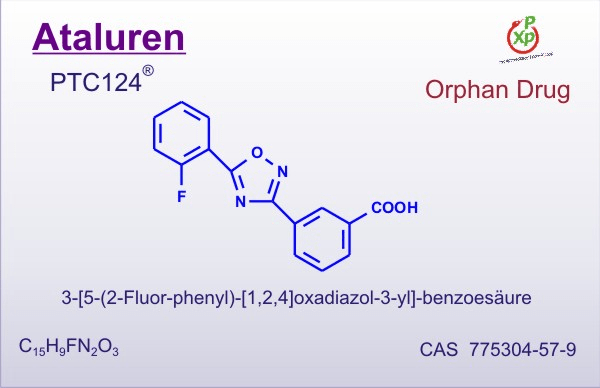
Рисунок 3. Аталурен. Индуцирует «проскакивание» стоп-кодонов. Лекарство применяется для лечения людей с генетическими заболеваниями, вызванными появлением преждевременного стоп-кодона в важных генах (нонсенс-мутациями). В том числе зарегистрирован и в России. К сожалению, из-за очень высокой цены — от пяти до семи тысяч евро за упаковку, которой хватит на месяц, — не все могут получить доступ к этому лечению.
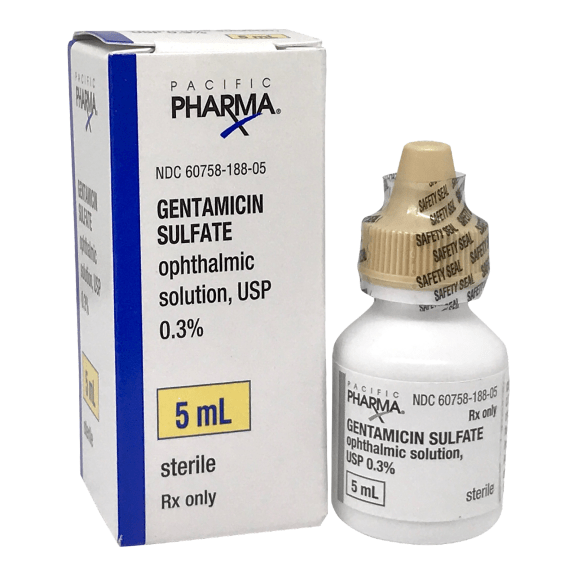
Рисунок 4. Гентамицин. Пока что препарат прошел клинические испытания только как антибиотик, однако у его производных есть потенциал и в терапии генетических заболеваний. Препарат, продаваемый в аптеках, представляет собой смесь более четырех похожих веществ. Его стоимость куда ниже, чем у аталурена: купить тюбик мази для наружного применения можно за 40 рублей. Однако в нынешнем виде гентамицин нельзя принимать в дозах, достаточных для устранения эффектов нонсенс-мутаций: из-за воздействия на рибосомы митохондрий он имеет побочные эффекты в виде нефро- и ототоксичности.
Более 10% генетических заболеваний вызвано однонуклеотидными мутациями, которые привели к появлению преждевременного стоп-кодона в кодирующей части какого-либо важного гена (такие мутации называют нонсенс-мутациями). К примеру, нонсенс-мутации в гене белка дистрофина могут вызывать миодистрофию Дюшенна. Интересно, что механизм терминации на таком случайно возникшем, не прошедшем эволюционный отбор стоп-кодоне несколько отличается от нормального. Это связано с тем, что получившийся «преждевременный» сигнал терминации чаще всего находится далеко от 3′-конца мРНК и расположен не в последнем экзоне (как «настоящие» стоп-кодоны), а также лишен нужного нуклеотидного контекста. В клетке действует специальная защитная система, которая обнаруживает «неправильную» терминацию на таком стоп-кодоне и отправляет транскрипты с нонсенс-заменой на деградацию. Однако примерно в одном из 100–10000 случаев (в зависимости от условий) рибосома проскакивает стоп-кодон, вместо терминации вставляя в пептид какую-либо аминокислоту и продолжая синтез [10], [11]. Долю таких сквозных прочтений можно увеличить с помощью специальных ингибиторов, самыми известными из которых являются аталурен и аминогликозиды, к коим относится гентамицин (рис. 4). Несмотря на то, что сквозные прочтения могут вызывать несколько классов веществ, обычно эта активность ассоциируется с самым большим классом — аминогликозидами. Эти вещества сильнее действуют на преждевременные стоп-кодоны, чем на «правильные», благодаря чему они могут иметь потенциал в терапии заболеваний, вызываемых нонсенс-мутациями. Однако аминогликозиды известны своей токсичностью — ведь они, помимо индукции сквозного прочтения, еще и снижают точность работы рибосомы. Из веществ неаминогликозидной природы, действующих аналогичным образом, лучше всего изучен аталурен (рис. 3), однако он также не очень хорошо показал себя в клинических испытаниях; более того, в некоторых работах приведены аргументы в пользу того, что это вещество может и вовсе не работать так, как заявлено, а его эффекты в экспериментах были связаны с влиянием на стабильность белка-репортера. Поэтому поиски индукторов ошибок декодирования, приемлемых для терапии наследственных заболеваний, продолжаются.
Чтобы понять, как именно ингибиторы могут подавлять активность рибосомы, полезно вспомнить ее общее строение. Это удобно сделать с помощью интерактивного аплета (см. рис. 5).
Рисунок 5. Пристальный взгляд на эукариотическую рибосому. В верхней кнопочной панели можно изучить структурные элементы рибосомы. Для того чтобы узнать о структурном элементе или сайте связывания, наведите курсор на кнопку. В нижней панели можно найти распространенные ингибиторы, которые действуют на разные части эукариотической рибосомы, визуализированные в предыдущем разделе. В виде на лиганд взаимодействующие основания выделены оранжевым. Встроенный в статью этот апплет очень маленький, поэтому рекомендуем открыть полноэкранную версию.
Для показа структурных элементов использована структура дрожжевой рибосомы, полученная методом криоэлектронной микроскопии группой Р. Бекманна (6SNT). Для визуализации используется веб-плагин MolStar.
Ингибиторы трансляционных факторов
Трансляционные факторы — белки, помогающие рибосоме реализовывать разные этапы трансляционного цикла. Чаще всего эти факторы жизненно необходимы для нормального синтеза белка в клетках или митохондриях/пластидах, которые, как правило, тоже имеют свой трансляционный аппарат.
Эта группа веществ взаимодействует с факторами в растворе, блокируя их активность или препятствуя присоединению к рибосоме (во втором случае они могут контактировать не только с фактором, но и с рибосомой, что приводит к неоднозначности в классификации: иногда их относят к ингибиторам рибосомы).
Ингибиторы факторов инициации трансляции
Инициация трансляции в эукариотических клетках устроена сложнее, чем у бактерий: факторов инициации здесь больше, и многие из них являются эукариот-специфичными. Поэтому и набор мишеней для ингибиторов довольно разнообразен. Со всем многообразием факторов инициации и их набором у трех доменов живого удобно ознакомится в таблице 2.
Наиболее перспективными с точки зрения применения в клинике блокаторами этой стадии являются, пожалуй, ингибиторы РНК-хеликазы eIF4A, которые демонстрируют яркую антивирусную активность. В частности, два вещества, относящиеся к семейству рокаглатов, — сильвестрол и зотатифин — в данный момент проходят клинические испытания на больных COVID-19 [12], [13]. Вообще, биосинтез белка является «ахиллесовой пятой» многих вирусов, поскольку большинству клеток обычно не нужно синтезировать белки в таких количествах, как при вирусной инфекции, и незараженная клетка может безболезненно пережить невысокие концентрации трансляционных ингибиторов, которые убьют инфицированную или просто заблокируют размножение вируса.