биотерапия опухолей что это
Таргетная терапия
Таргетная терапия (биологическая терапия, биотерапия) — это вид лекарственного лечения онкологических заболеваний, основанный на избирательном вмешательстве в определенные внутриклеточные механизмы, необходимые для опухолевого роста.
В отличие от традиционной (цитостатической) химиотерапии, которая непосредственно повреждает быстроделящиеся клетки (как «хорошие», так и «плохие»), таргетная терапия блокирует так называемые сигнальные пути, по которым клетка «понимает», что ей нужно делиться.
Как происходит передача клеточных сигналов, по которым клетки «понимают», когда им нужно делиться, а когда остановиться?
Происходит это через активацию определенными веществами — лигандами (например, эпителиальным фактором роста, EGF) специальных рецепторов на поверхностях клеточных мембран.
Эти вещества выполняют важную функцию в регуляции внутренних процессов, например, при заживлении ран и вообще регенерации. Рецепторы также могут находиться внутри клетки и взаимодействовать с веществами, которые проходят сквозь мембрану клеток. Взаимодействие рецептора с лигандами активирует сигнальные пути, в результате чего происходит пролиферация клеток.
Злокачественная опухоль возникает в результате множества мутаций в различных генах, ряд которых экспрессируется в виде рецепторов (антигенов) на поверхности клеточных мембран.
Опухолевые клетки также имеют сигнальные пути, и некоторые из них могут быть активированы рецепторами — как обычными, так и измененными в результате мутаций определенных генов.
Таргетная терапия использует 2 основные группы препаратов: моноклональные антитела, которые связываются с внешними рецепторами, и малые молекулы, ингибиторы, которые блокируют сигнальные пути внутри клеток (например, ингибиторы тирозинкиназ).
Определенное антитело находит свой антиген и связывается с ним, обеспечивая его невосприимчивость к другим веществам. Антигены и антитела строго подходят только друг к другу (афинны), как ключ к замку, и дефектный (мутировавший) антиген является в этом смысле идеальной мишенью — он присущ только опухолевым клеткам.
Таким образом, таргетная терапия блокирует именно пути передачи (сигнальные пути), которые активируются при взаимодействии рецептора с его лигандом, за счет связывания с этими рецепторами.
Для этого используются специальные вещества, полученные искусственным путем — моноклональные антитела.
Блокирование внутриклеточных механизмов осуществляется с помощью искусственно созданных малых молекул, которые могут проходить внутрь клеток сквозь мембрану.
Одна из перспективных задач современной науки в онкологии — поиск таких мишеней, которые присущи только опухолевым клеткам. Одной из первых обнаруженных мишеней, для воздействия на которую был введен в широкую клиническую практику первый препарат для таргетной терапии, был рецептор человеческого эпидермального фактора 2 типа. Повышенная экспрессия этого антигена (гиперэкспрессия) на поверхности клеток была обнаружена при раке молочной железы. Дальнейшие исследования показали, что эта мутация среди всех случаев рака молочной железы определяется примерно в 15-30%. Гиперэкспрессия данного онкогена (маркера) усиливает пролиферацию (деление) раковых клеток и тормозит их естественную гибель. Это является фактором, обуславливающим повышенную агрессивность опухоли и менее благоприятный прогноз. Анти-HER2 терапия сегодня является «золотым стандартом» лечения HER2-позитивных пациенток с раком молочной железы.
Как узнать, будет ли конкретная опухоль чувствительна к таргетным препаратам?
Предрасположенность к таргетной терапии определяется с помощью иммуногистохимического или молекулярно-генетического исследования. С их помощью выявляются мутации (или их отсутствие) в определенных генах, или экспрессия антигенов на клеточных мембранах.
Наиболее успешные таргетные методы лечения используют химические субстанции, нацеленные или преимущественно нацеленные на какой-либо белок или фермент, который несет мутацию или другие генетические изменения, являющиеся специфичными для раковых клеток. Однако могут быть ситуации, когда, наоборот, наличие мутации предопределяет отсутствие чувствительности опухоли к таргетной терапии. Например, наличие мутации в гене KRAS, NRAS определяет отсутствие чувствительности опухоли к ингибиторам тирозинкиназ — анти-EGFR препаратам.
Таргетную терапию часто используют вместе с химиотерапией и другими видами лечения рака, однако она может назначаться в виде самостоятельного лечения.
В некоторых случаях назначается комбинированная таргетная терапия (двойная анти-HER2 терапия при раке молочной железы или комбинация ингибиторов BRAF и MEK при лечении BRAF-позитивной метастатической меланомы).
В каких случаях назначают таргетную терапию?
Биология опухоли может быть различной даже при одном и том же типе рака. Поэтому таргетная терапия подбирается индивидуально, в зависимости от молекулярно-генетических характеристик выявленного рака.
Пациентам с раком толстой кишки разумно пройти обследование на наличие мутации KRAS. В настоящий момент помимо этой мутации определяется ряд других. По мере появления новых мишеней и результатов клинических исследований, профилирование опухолей часто пересматривается в сторону расширения. Это помогает назначить самое эффективное лечение.
Одним из примеров частого и широкого применения таргетной терапии является немелкоклеточный рак легкого. При распространенной болезни ткань исследуется на довольно широкий список мутаций — EGFR, ALK, ROS1, PD-L1, а с недавних пор — на NTRK и MET. Каждая из них определяет высокую чувствительность опухоли к определенной терапии.
В связи с этим, в последнее время традиционная система стадирования если не утрачивает своего решающего значения, то, во всяком случае, значительно дополняется, а лечение рака все чаще определяется не органной принадлежностью, а биологическим подтипом.
Примеры применения таргетной терапии
Как проводится таргетная терапия?
Длительность курса лечения и режим вводимых лекарств зависит от типа рака и его стадии, типа таргетной терапии и индивидуальной переносимости пациента.
Довольно часто таргетная терапия проводится до прогрессирования рака или появления непереносимости.
Таргетная терапия может быть как внутривенной (при этом она обычно носит цикличный характер), так и пероральной (прием препаратов может проводиться каждый день).
Эффект таргетной терапии определяется результатами контрольных обследований, который проводятся с определенными временными интервалами (от 4 недель до нескольких месяцев).
Побочные эффекты таргетной терапии
В отличие от химиотерапии, таргетная терапия не наносит существенного вреда здоровым клеткам — ее препараты нацелены на определенные клеточные мишени.
Однако, блокирование некоторых сигнальных путей распространяется на нормальные клетки и приводит к нарушениям их работы. Несмотря на это, таргетная терапия, как правило, переносится лучше, чем традиционная химиотерапия.
Побочные эффекты таргетной терапии зависят от вида вводимого препарата и его дозировки.
Наиболее часто встречаются следующие побочные эффекты:
Важно понимать, что речь не идет об обязательном проявлении всех перечисленных побочных эффектов, и в каждой конкретной ситуации спектр и тяжесть побочных действий различная. В случае их возникновения онкологи клиники Рассвет помогут вам снизить неприятные ощущения и предложат все возможные варианты необходимой сопроводительной терапии. Большинство побочных эффектов таргетной терапии проходят после окончания лечения.
Что такое биотерапия BRM и какие болезни она лечит?
1. Что такое BRM-терапия?
2. Показания к биотерапии
3. Как работает BRM-терапия?
4. Диагностика перед биотерапией
5. Побочные эффекты
6. Виды биотерапии в лечении рака
7. BRM-терапия при артрите
8. Где проводят биотерапию?
BRM-терапия – это новый метод лечения рака и аутоиммунных заболеваний. За счет использования препаратов с живыми организмами врачам удается воздействовать на цитокины и активировать или подавлять иммунитет. Эта стратегия лечения может помочь людям в отчаянном положении, которым не помогли традиционные методы лечения. Биотерапию назначают для лечения рака, артрита, увеита, болезни Крона. Из нашей статьи вы узнаете как работает BRM-терапия, какая ее эффективность для разных патологий и где ее можно пройти.
Слушать статью:
ЧТО ТАКОЕ BRM-ТЕРАПИЯ?
BRM-терапия – это метод лечения, при котором используются элементы, полученные из живых организмов. Эти вещества встречаются в теле человека или могут быть созданы в лаборатории. Другие названия метода – терапия с модификатором биологического ответа, биологическая терапия и биотерапия.
Биотерапию назначают для активизации иммунитета на борьбу с болезнью. В этом случае ее используют для лечения первичного и рецидивирующего рака. Другое применение BRM-веществ – подавление иммунитета. Эта тактика эффективна в лечении аутоиммунных заболеваний, в том числе – при болезнях суставов.
Модификаторы биологического ответа BRM используются в некоторых видах иммунотерапии и таргетной терапии.
ДЛЯ ЛЕЧЕНИЯ КАКИХ БОЛЕЗНЕЙ ПРИМЕНЯЮТ БИОТЕРАПИЮ?
Управление по санитарному надзору за качеством пищевых продуктов и медикаментов одобрило BRM-терапию для лечения увеита.
Лечение модификаторами биологического ответа возможно при диагнозах:
Сочетание BRM-терапии и традиционного лечения повышает выживаемость пациентов с некоторыми видами рака.
КАК РАБОТАЕТ БИОЛОГИЧЕСКАЯ ТЕРАПИЯ?
Модификаторы биологического ответа улучшают или подавляют работу иммунитета. Этот эффект достигается за счет воздействия на цитокины. Цитокин – это белок, который продуцируют лейкоциты, чтобы уничтожать чужеродные клетки.
Действующие вещества в BRM-терапии могут усиливать их чувствительность – и тогда они будут активнее распознавать вредоносные клетки. Это их свойство активно применяется при создании лекарств иммунотерапии для борьбы с раком.
Точно также вещества в BRM-препаратах могут подавлять действие цитокинов. В этом случае белок станет менее чувствительным и перестанет атаковать здоровые клетки, которые ошибочно принимает за чужеродные.
ДИАГНОСТИКА ПЕРЕД НАЧАЛОМ БИОТЕРАПИИ
Доктора проводят тщательную диагностику перед назначением биологической терапии. Она нужна для того, чтобы спрогнозировать побочные эффекты и гарантировать безопасность процедуры. В обязательном порядке пациенту назначают:
BRM-терапию нельзя проводить пациентам с рассеянным склерозом, невритом зрительного нерва и синдромом иммунодефицита.
ПОБОЧНЫЕ ЭФФЕКТЫ ПОСЛЕ BRM-ТЕРАПИИ
Прием модификаторов биологического ответа сопровождается побочными эффектами. Чтобы терапия была эффективна, их важно контролировать. Во время биотерапии пациенты чаще всего отмечают:
Врач прописывает специальные лекарства для снятия этих эффектов. Пациент должен немедленно сообщить врачу, если чувствует недомогание после BRM-терапии.
ВИДЫ BRM-ТЕРАПИИ В ЛЕЧЕНИИ РАКА
В терапии модификаторами биологического ответа используются:
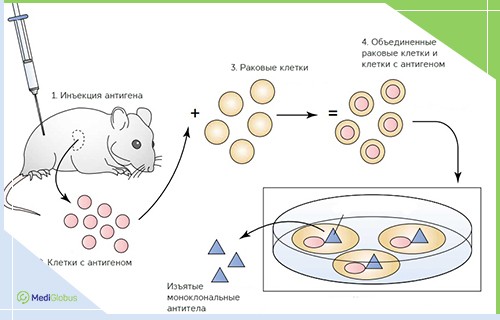
Моноклональные антитела – это белки, которые нацелены на уничтожение конкретной мишени на поверхности клетки. В биотерапии они используются для лечения HER-позитивного рака груди и неходжкинских лимфом. Лечение моноклональными антителами также возможно при колоректальном раке, опухолях поджелудочной железы, раке легких, лейкемии и нейробластоме.
Противораковые вакцины – это препараты, которые активируют клетки иммунитета на борьбу с онкологией. При этом пациенту вводят специальные белки или вирусы. Вакцины против рака используют для лечения злокачественного рака кожи и опухолей головного мозга.
Интерфероны – это белки, которые защищают организм от вирусов и подавляют рост раковых клеток. Этот вид биотерапии используют при хроническом лимфоцитарном лейкозе, волосатоклеточном лейкозе, хроническом миелолейкозе, саркоме Капоши, Т-клеточной лимфоме и множественной миеломе.
Интерлейкины – белки, которые отвечают за взаимодействие между лейкоцитами. Их применяют для лечения метастатического рака почек, неходжскинской лимфомы и злокачественной меланомы. BRM-терапия интерлейкинами также увеличивает длительность ремиссии после пересадки костного мозга.
Факторы некроза опухоли являются веществами, которые связываются с раковыми клетками и повреждают кровеносные сосуды новообразования. Это приводит к гибели опухоли. Они также подавляют иммунитет, поэтому врачи могут их назначать одновременно с цитотоксической химиотерапией.
Колониестимулирующие факторы (CSF) – это факторы роста, которые влияют на деление и созревание клеток крови. В онкологии их применяют для восстановления костного мозга после химиотерапии и лучевой терапии, повышения иммунитета и ослабления побочных эффектов после химиотерапии.
Лечение рака груди BRM-терапией
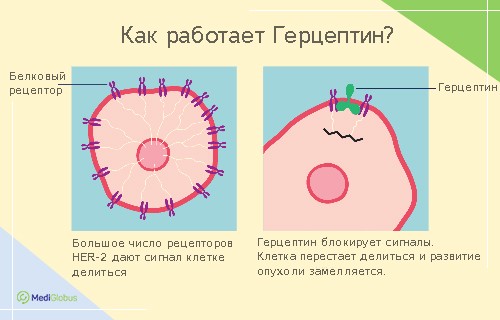
У каждой пятой женщины с раком груди встречается его агрессивная форма – HER-2. Этот диагноз означает, что у женщины повышенное количество белка HER-2, который начал неконтролируемо делиться. Один из самых эффективных способов его лечения – применение иммунотерапии Герцептином.
Герцептин – это моноклональное антитело, которе стимулирует работу иммунитета. В его состав входит трастузумаб, который связывается с белками рецептора HER2 в раковых клетках. Герцептин является “биологическим” препаратом, так как он содержит живые организмы, взятые из белка клеток мыши.
Лечение HER-позитивного рака груди получило одобрение FDA. Общая выживаемость пациенток с раком груди 2-3 стадии после приема Герцептина составляет 98%. При этом риск рецидива снижается на 30%, а побочные эффекты ощутимо слабее, чем после химиотерапии.
Связаться с координатором
Если у вас HER-позитивный рак груди – вы можете записаться на BRM-терапию. Мы подберем для вас клинику и возьмем на себя все организационные вопросы. Оставляйте номер телефона, и наш координатор позвонит вам через 30 минут.
Лечение лимфомы биотерапией
Ритуксимаб – это метод лечения моноклональными телами. Препарат содержит живые клетки, поэтому относится к BRM-терапии. Его назначают пациентам с В-клеточной лимфомой и хроническим лимфоцитарным лейкозом. В 2020 году FDA одобрила Ритуксимаб в качестве поддерживающей терапии при фолликулярной лимфоме. Трехлетняя выживаемость пациентов с лимфомой увеличилась с 58% до 75% после приема Ритуксимаба.
Отправиться на лечение
Рак крови возможно вылечить. Если вам не помогла химиотерапия – вы можете обратиться за таргетной терапией. Наши координаторы организуют для вас лечение в зарубежной клинике.
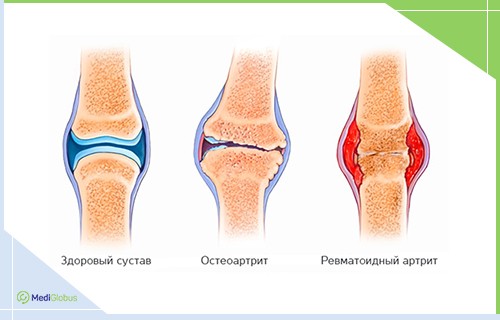
ЛЕЧЕНИЕ РЕВМАТОИДНОГО АРТРИТА БИОЛОГИЧЕСКОЙ ТЕРАПИЕЙ
Ревматоидный артрит является аутоиммунным заболеванием при котором наблюдается воспаление суставов и разрушение суставного хряща. Вылечить эту болезнь нельзя. Доступное лечение может ослабить воспаление и боль, сохранить суставы от дальнейшего разрушения. Правильная стратегия лечения может предотвратить инвалидность и сохранить работоспособность.
Лечение модификаторами биологического ответа является эффективным средством. В процессе лечения биотерапией, пациенту вводят антитела, которые подавляют отдельные компоненты иммунитета. Это помогает снять воспаление. Преимущества BRM-терапии в лечении ревматоидного артрита заключаются в том, что препарат начинает быстро действовать и останавливает прогресс заболевания.
Биотерапия показала особую эффективность против анкилозирующего спондилита. Это тип артрита, при котором наблюдается длительное воспаление суставов позвоночника. Препарат предотвращает сращение мелких костей позвонков и снимает боль. Пациенты чувствуют первые улучшения через 6 недель после начала терапии.
Поехать на лечение артрита
Вы можете избавиться от боли в суставах после курса биотерапии. Оставьте свои контакты нашим координаторам и мы запишем вас на лечение. Мы работаем оперативно, чтобы вы как можно скорее приблизились к выздоровлению.
В КАКИХ КЛИНИКАХ ДОСТУПНА БИОТЕРАПИЯ BRM?
Лечение модификаторами биологического ответа находится на стадии испытаний. Пациентам трудно самостоятельно найти клинику, где можно пройти лечение своей болезни биотерапией. MediGlobus составил список клиник, куда можно поехать на BRM-терапию.
Клиника Лив
Университетская больница в Брно
Клиника Наварры в Мадриде
Университетская клиника Кельна
Медицинский центр Хаима Шибы
Клиника Медикал Парк Бахчелиэвлер
Резюме
Биотерапия – это препараты для лечения рака и аутоиммунных заболеваний в состав которых входят живые организмы. Они активируют иммунитет, чтобы помогать организму бороться с раком и подавляют его, когда нужно снять воспаление. К биотерапии относятся некоторые виды иммунотерапии и таргетной терапии.
Существует 6 видов BRM-терапии: моноклональные тела, противораковая вакцинация, интерфероны, интерлейкины, факторы некроза опухоли и колониестимулирующие факторы. Они эффективны против лимфом, лейкозов, опухолей ЖКТ и рака груди.
Обратиться за консультацией
Если у вас остались вопросы о BRM-терапии – задайте их нашим специалистам. Мы проконсультируем вас о показаниях к процедуре и ее стоимости. Координаторы также могут записать вас в госпиталь, где доступна биотерапия и помочь с организацией поездки.
Биотерапия при лечении рака в Израиле
Биотерапия в онкологии уже в течение нескольких лет активно и эффективно используется для лечения пациентов в клиниках Израиля. Этот современный способ дает значительные результаты. Благодаря инновации, теперь имеют шанс на выздоровление и улучшение качества жизни пациенты с терминальными стадиями рака. В данный момент в исследовательской компании AEBi (Израиль) идут разработки нового препарата для борьбы с онкологическими заболеваниями на основе пептидов. Это перспективное средство пока находится на этапе исследования, но уже в ближайшие годы ожидается подтверждение его эффективности на основании крупномасштабных испытаний.
Методы биотерапии в Израиле
Биотерапия опухолей – один из новейших эффективных путей лечения рака в Израиле и других развитых странах, основанный на способности иммунной системы находить и уничтожать чужеродные клетки в своем организме. На данный момент в биологической терапии используются следующие методы.
Препараты, действие которых направлено на регулирование работы иммунной системы. Они активируют или наоборот снижают активность различных иммунных клеток, так или иначе действующих на опухолевые клетки. Лечение рака в Израиле предусматривает применение широкого спектра препаратов-иммуномодуляторов.
Использование средств на основе моноклональных антител – препараты с целенаправленным действием на конкретные опухолевые клетки или на сосуды, питающие опухоль. Эти лекарственные средства обладают высокой эффективностью и минимальными побочными эффектами. Биотерапия опухолей данным способом разнообразна и индивидуально подбирается лечащим врачом.
Природные или синтетические вещества, направленные на выработку собственным организмом цитокинов (веществ, активирующих противоопухолевые иммунные клетки), и, как следствие, уменьшение или полное исчезновение опухоли.
Метод находится в разработке. Цепочки белковых молекул, «заряженные» токсинами против опухолевых клеток, действуют целенаправленно, разрушая рак. В данный момент этот новейший метод биотерапии в онкологии (разработан израильскими учеными) проходит этап клинических испытаний. Препарат будет иметь минимум побочных эффектов. Биотерапия рака в Израиле уже показала свою эффективность при лечении многих онкологических пациентов с различными видами и стадиями злокачественных новообразований. Поэтому в клинике «Ассута» биологическая терапия уже давно используется наравне с другими методами воздействия на рак.
Безопасность и эффективность лечения биотерапией в Израиле
Основной целью данного вида лечения является направленное действие иммунитета на опухолевые клетки в организме больного человека. При правильном диагностическом подходе и верном выборе метода биологической терапии эффект направленный на выздоровление будет 100%. Биотерапия опухолей в израильских клиниках является одним из наиболее действенных методов лечения рака.
Биологическая терапия, в отличие от классических методов лечения злокачественных образований, обладает гораздо меньшими побочными эффектами. Биопрепараты воспринимаются организмом положительно, не вызывая реакции отторжения или невосприимчивости. Именно поэтому биотерапия рака в клиниках Израиля активно и успешно используется, все больше завоевывая доверие пациентов клиники «Ассута».
В клинике «Ассута» врачи имеют большой опыт в работе с пациентами, страдающими онкологическими заболеваниями, различными методиками биотерапии, в том числе и вакцинами на основе дендритных клеток – новейшей методикой, которая совершенствуется с каждым годом и имеет доказанную эффективность.
В рамках комплексного подхода к лечению онкологических заболеваний в Израиле биологические препараты обычно сочетаются с химио- или лучевой терапией для достижения наилучшего эффекта.
Современное высокотехнологичное медицинское и лабораторное оборудование в клинике, гарантирует качественную лечебно-диагностическую работу, точность результатов исследования и безопасность. Биотерапия в Израиле, по частоте, применяется наравне с классическими методами противораковой терапии.
Схема подбирается индивидуально, на основании тщательной диагностики, генетического картирования опухоли. Кроме того, лабораторные исследования позволяют прогнозировать вероятность рецидива для конкретного случая и оценивать эффективность терапевтического воздействия, чтобы при необходимости своевременно внести изменения в план терапии.
Биопрепараты не вызывают реакции отторжения, поскольку не воспринимаются организмом как чужеродные.
Инновационные методики внедряются в Израиле в среднем на несколько лет раньше, чем в других странах.
Цены на лечение биотерапией в клинике «Ассута» в Израиле
В международном отделе клиники «Ассута» работают русскоязычные врачи, в том числе специалисты по биотерапии рака, которые проконсультируют Вас по телефону о том, какие необходимо будет прислать документы (справки, результаты диагностических исследований). На их основании предварительно определяется наиболее подходящую схему лечения и план возможного дообследования по приезде в клинику.
Генная терапия против рака
иллюстрация автора статьи
Автор
Редакторы
Статья на конкурс «био/мол/текст»: Благодаря стремительному развитию медицины создаются инновационные техники, лекарства, оборудование, направленные на лечение сложных заболеваний, таких как рак. В последнее время большое внимание уделяется генной терапии как перспективному методу лечения онкозаболеваний, который в будущем станет особо важным инструментом для предотвращения и снижения смертности от рака. В данной статье кратко рассматриваются пути развития болезни, а также применение инновационных техник генной терапии в онкологии.
Конкурс «био/мол/текст»-2014
Эта статья представлена на конкурс научно-популярных работ «био/мол/текст»-2014 в номинации «Лучший обзор».
Главный спонсор конкурса — дальновидная компания «Генотек».
Конкурс поддержан ОАО «РВК».
Спонсором номинации «Биоинформатика» является Институт биоинформатики.
Спонсором приза зрительских симпатий выступила фирма Helicon.
Свой приз также вручает Фонд поддержки передовых биотехнологий.
Смертельные клешни
Человечество столкнулось с этой загадочной болезнью еще до нашей эры. Ее пытались понять и лечить ученые мужи в самых различных уголках мира: в Древнем Египте — Еберс, в Индии — Сушрута, Греции — Гиппократ. Все они и многие другие медики вели борьбу с опасным и серьезным противником — раком. И хоть эта битва продолжается до сих пор, сложно определить, есть ли шансы на полную и окончательную победу. Ведь чем больше мы изучаем болезнь, тем чаще возникают вопросы — можно ли полностью излечить рак? Как избежать болезни? Можно ли сделать лечение быстрым, доступным и недорогим?
Благодаря Гиппократу и его наблюдательности (именно он увидел сходство опухоли и щупалец рака) в древних врачебных трактатах появился термин «карцинома» (грец. carcinos), или «рак» (лат. cancer). В медицинской практике по-разному классифицируют злокачественные новообразования: карциномы (из эпителиальных тканей), саркомы (из соединительной, мышечной тканей), лейкемия (в крови и костном мозге), лимфомы (в лимфатической системе) и другие (развиваются в других типах клеток, например, глиома — рак головного мозга). Но в быту более популярен термин «рак», который подразумевает любую злокачественную опухоль.
Мутации: погибнуть или жить вечно?
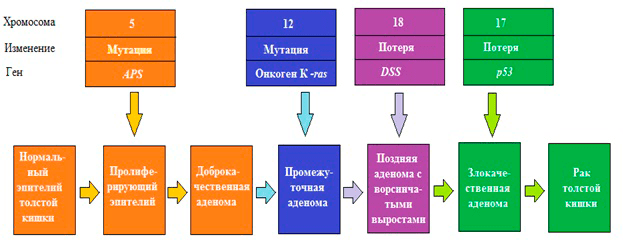
Многочисленные генетические исследования выявили, что возникновение раковых клеток — это результат генетических изменений. Ошибки в репликации (копировании) и репарации (исправлении ошибок) ДНК приводят к изменению генов, в том числе и контролирующих деление клетки. Основными факторами, которые способствуют повреждению генома, а в дальнейшем — приобретению мутаций, — являются эндогенные (атака свободных радикалов, образующихся в процессе обмена веществ, химическая нестабильность некоторых оснований ДНК) и экзогенные (ионизирующее и УФ-излучение, химические канцерогены). Когда мутации закрепляются в геноме, они способствуют трансформации нормальных клеток в раковые. Такие мутации в основном случаются в протоонкогенах, которые в норме стимулируют деление клетки. В результате может получиться постоянно «включенный» ген, и митоз (деление) не прекращается, что, фактически, означает злокачественное перерождение. Если же инактивирующие мутации происходят в генах, которые в норме ингибируют пролиферацию (гены-супрессоры опухолей), контроль над делением утрачивается, и клетка становится «бессмертной» (рис. 1).
Рисунок 1. Генетическая модель рака: рак толстой кишки. Первый шаг — потеря или инактивация двух аллелей гена АРS на пятой хромосоме. В случае семейного рака (familiar adenomatous polyposis, FAP) одна мутация гена АРС наследуется. Потеря обоих аллелей ведет к образованию доброкачественных аденом. Последующие мутации генов на 12, 17, 18 хромосомах доброкачественной аденомы могут привести к трансформации в злокачественную опухоль.
Очевидно, что развитие определенных видов рака включают в себя изменение большинства или даже всех этих генов и может проходить различными путями. Из этого следует, что каждую опухоль следует рассматривать как биологически уникальный объект. На сегодняшний день существуют специальные генетические информационные базы по раку, содержащих данные о 1,2 млн. мутаций из 8207 образцов тканей, относящихся к 20 видам опухолей: атлас Ракового Генома (Cancer Genome Atlas) и каталог соматических мутаций при раке (Catalogue of Somatic Mutations in Cancer, COSMIC) [2].
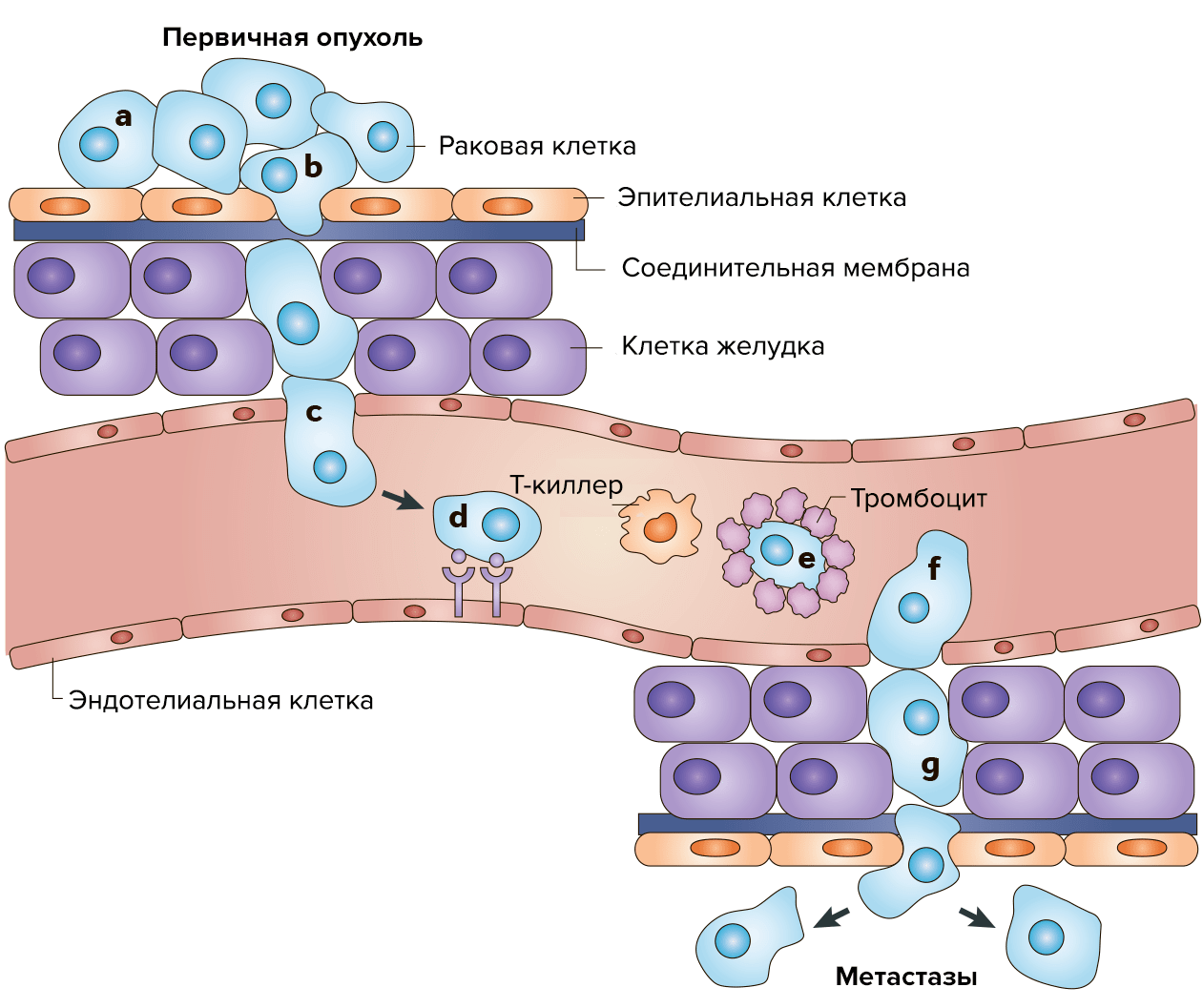
Результатом сбоя работы генов становится неконтролируемое деление клеток, а на последующих стадиях — метастазирование в различные органы и части тела по кровеносным и лимфатическим сосудам. Это достаточно сложный и активный процесс, который состоит из нескольких этапов. Отдельные раковые клетки отделяются от первичного очага и разносятся с кровью по организму. Затем с помощью специальных рецепторов они прикрепляются к эндотелиальным клеткам и экспрессируют протеиназы, которые расщепляют белки матрикса и образуют поры в базальной мембране. Разрушив внеклеточный матрикс, раковые клетки мигрируют вглубь здоровой ткани. За счет аутокринной стимуляции они делятся, образуя узел (1–2 мм в диаметре). При недостатке питания часть клеток в узле погибает, и такие «дремлющие» микрометастазы могут достаточно долго оставаться в тканях органа в латентном состоянии. В благоприятных условиях узел разрастается, в клетках активируются ген фактора роста эндотелия сосудов (VEGF) и фактора роста фибробластов (FGFb), а также инициируются ангиогенез (формирование кровеносных сосудов) (рис. 2).
Рисунок 2. Распространение метастазов
Однако клетки вооружены специальными механизмами, защищающими от развития опухолей:
Традиционные методы и их недостатки
Если системы защиты организма не справились, и опухоль все-таки начала развиваться, спасти может только вмешательство медиков. На протяжении длительного периода врачами используются три основные «классические» терапии:
Вышеописанные подходы не всегда могут избавить больного от рака. Часто при хирургическом лечении остаются единичные раковые клетки, и опухоль может дать рецидив, а при химиотерапии и лучевой терапии возникают побочные эффекты (снижение иммунитета, анемия, выпадение волос и др.), которые приводят к серьезным последствиям, а часто и к смерти пациента. Тем не менее, с каждым годом улучшаются традиционные и появляются новые методы лечения, которые могут победить рак, такие как биологическая терапия, гормональная терапия, использование стволовых клеток, трансплантация костного мозга, а также различные поддерживающие терапии. Наиболее перспективной считается генная терапия, так как она направлена на первопричину рака — компенсацию неправильной работы определенных генов.
Генная терапия как перспектива
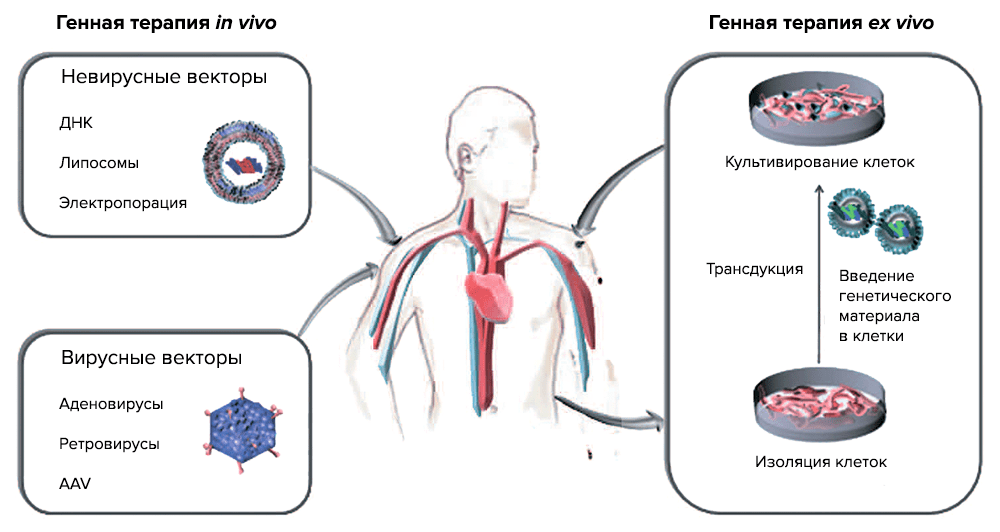
По данным PubMed, интерес к генной терапии (ГТ) раковых заболеваний стремительно растет, и на сегодняшний день ГТ объединяет ряд методик, которые оперируют с раковыми клетками и в организме (in vivo) и вне его (ex vivo) (рис. 3).
Рисунок 3. Две основные стратегии генной терапии. ex vivo — генетический материал с помощью векторов переносится в клетки, выращиваемые в культуре (трансдукция), а затем трансгенные клетки вводят реципиенту; in vivo — введение вектора с нужным геном в определенную ткань или орган.
Генная терапии іn vivo подразумевает перенос генов — введение генетических конструкций в раковые клетки или в ткани, которые окружают опухоль [9]. Генная терапия ex vivo состоит из выделения раковых клеток из пациента, встраивания терапевтического «здорового» гена в раковый геном и введения трансдуцированных клеток обратно в организм пациента. Для таких целей используются специальные векторы, созданные методами генной инженерии. Как правило, это вирусы, которые выявляют и уничтожают раковые клетки, при этом оставаясь безвредными для здоровых тканей организма, или невирусные векторы.
Вирусные векторы
В качестве вирусных векторов используют ретровирусы, аденовирусы, аденоассоциированные вирусы, лентивирусы, вирусы герпеса и другие. Эти вирусы отличаются по эффективности трансдукции, по взаимодействию с клетками (распознавание и заражение) и ДНК. Главным критерием является безопасность и отсутствие риска неконтролируемого распространения вирусной ДНК: если гены вставляются в неправильном месте генома человека, они могут создать вредные мутации и инициировать развитие опухоли. Также важно учитывать уровень экспрессии перенесенных генов, чтобы предотвратить воспалительные или иммунные реакции организма при гиперсинтезе целевых белков (табл. 1).
| Вектор | Краткое описание |
|---|---|
| Вирус кори (measles virus) | содержит отрицательную последовательность РНК, которая не вызывает защитного ответа в раковых клетках |
| Вирус простого герпеса (HSV-1) | может переносить длинные последовательности трансгенов |
| Лентивирус | производный от ВИЧ, может интегрировать гены в неделящиеся клетки |
| Ретровирус (RCR) | не способный к самостоятельной репликации, обеспечивает эффективное встраивание чужеродной ДНК в геном и постоянство генетических изменений |
| Обезьяний пенистый вирус (SFV) | новый РНК-вектор, который передает трансген в опухоль и стимулирует его экспрессию |
| Рекомбинантный аденовирус (rAdv) | обеспечивает эффективную трансфекцию, но возможна сильная иммунная реакция |
| Рекомбинантный аденоассоциированный вирус (rAAV) | способен к трансфекции многих типов клеток |
Невирусные векторы
Для переноса трансгенных ДНК также применяют невирусные векторы. Полимерные переносчики лекарственных средств — конструкции из наночастиц — используются для доставки препаратов с низкой молекулярной массой, например, олигонуклеотидов, пептидов, миРНК. Благодаря небольшим размерам, наночастицы поглощаются клетками и могут проникать в капилляры, что очень удобно для доставки «лечебных» молекул в самые труднодоступные места в организме. Данная техника часто используется для ингибирования ангиогенеза опухоли. Но существует риск накопления частиц в других органах, например, костном мозге, что может привести к непредсказуемым последствиям [11]. Самыми популярными невирусными методами доставки ДНК являются липосомы и электропорация.
Синтетические катионные липосомы в настоящее время признаны перспективным способом доставки функциональных генов. Положительный заряд на поверхности частиц обеспечивает слияние с отрицательно заряженными клеточными мембранами. Катионные липосомы нейтрализуют отрицательный заряд цепи ДНК, делают более компактной ее пространственную структуру и способствуют эффективной конденсации. Плазмидно-липосомный комплекс имеет ряд важных достоинств: могут вмещать генетические конструкции практически неограниченных размеров, отсутствует риск репликации или рекомбинации, практически не вызывает иммунного ответа в организме хозяина. Недостаток этой системы состоит в низкой продолжительности терапевтического эффекта, а при повторном введении могут появляться побочные эффекты [12].
Электропорация является популярным методом невирусной доставки ДНК, довольно простым и не вызывающим иммунного ответа. С помощью индуцированных электрических импульсов на поверхности клеток образуются поры, и плазмидные ДНК легко проникают во внутриклеточное пространство [13]. Генная терапия іn vivo с использованием электропорации доказала свою эффективность в ряде экспериментов на мышиных опухолях. При этом можно переносить любые гены, например, гены цитокинов (IL-12) и цитотоксические гены (TRAIL), что способствует развитию широкого спектра терапевтических стратегий. Кроме того, этот подход может быть эффективным для лечения и метастатических, и первичных опухолей [14].
Выбор техники
В зависимости от типа опухоли и ее прогрессии, для пациента подбирается наиболее эффективная методика лечения. На сегодняшний день разработаны новые перспективные техники генной терапии против рака, среди которых онколитическая вирусная ГТ, пролекарственная ГТ (prodrug therapy), иммунотерапия, ГТ с использованием стволовых клеток.
Онколитическая вирусная генная терапия
Для этой методики используются вирусы, которые с помощью специальных генетических манипуляций становятся онколитическими — перестают размножаться в здоровых клетках и воздействуют только на опухолевые. Хорошим примером такой терапии является ONYX-015 — модифицированный аденовирус, который не экспрессирует белок Е1В. При отсутствии этого белка вирус не может реплицироваться в клетках с нормальным геном p53 [15]. Два вектора, сконструированных на базе вируса простого герпеса (HSV-1) — G207 и NV1020 — также несут в себе мутации нескольких генов, чтобы реплицироваться только в раковых клетках [16]. Большим преимуществом техники является то, что при проведении внутривенных инъекций онколитические вирусы разносятся с кровью по всему организму и могут бороться с метастазами. Основные проблемы, которые возникают при работе с вирусами — это возможный риск возникновения иммунного ответа в организме реципиента, а также неконтролируемое встраивание генетических конструкций в геном здоровых клеток, и, как следствие, возникновение раковой опухоли.
Геноопосредованная ферментативная пролекарственная терапия
Базируется на введении в опухолевую ткань «суицидных» генов, в результате работы которых раковые клетки погибают. Данные трансгены кодируют ферменты, активирующие внутриклеточные цитостатики, ФНО-рецепторы и другие важные компоненты для активации апоптоза. Суицидная комбинация генов пролекарства в идеале должна соответствовать следующим требованиям [17]: контролируемая экспрессия гена; правильное превращение выбранного пролекарства в активное противораковое средство; полная активация пролекарства без дополнительных эндогенных ферментов.
Минус терапии состоит в том, что в опухолях присутствуют все защитные механизмы, свойственные здоровым клеткам, и они постепенно адаптируются к повреждающим факторам и пролекарству. Процессу адаптации способствует экспрессия цитокинов (аутокринная регуляция), факторов регуляции клеточного цикла (отбор самых стойких раковых клонов), MDR-гена (отвечает за восприимчивость к некоторым медикаментам).
Иммунотерапия
Благодаря генной терапии, в последнее время начала активно развиваться иммунотерапия — новый подход для лечения рака с помощью противоопухолевых вакцин. Основная стратегия метода — активная иммунизация организма против раковых антигенов (ТАА) с помощью технологии переноса генов [18].
Главным отличием рекомбинантных вакцин от других препаратов является то, что они помогают иммунной системе пациента распознавать раковые клетки и уничтожать их. На первом этапе раковые клетки получают из организма реципиента (аутологичные клетки) или из специальных клеточных линий (аллогенные клетки), а затем выращивают их в пробирке. Для того чтобы эти клетки могли узнаваться иммунной системой, вводят один или несколько генов, которые производят иммуностимулирующие молекулы (цитокины) или белки с повышенным количеством антигенов. После этих модификаций клетки продолжают культивировать, затем проводят лизис и получают готовую вакцину.
Широкое разнообразие вирусных и невирусных векторов для трансгенов позволяет экспериментировать над различными типами иммунных клеток (например, цитотоксическими Т-клетками и дендритными клетками) для ингибирования иммунного ответа и регрессии раковых клеток. В 1990-х годах было высказано предположение, что опухолевые инфильтрирующие лимфоциты (TIL) являются источником цитотоксических Т-лимфоцитов (CTL) и естественных киллеров (NK) для раковых клеток [19]. Так как TIL можно легко манипулировать ex vivo, они стали первыми генетически модифицированными иммунными клетками, которые были применены для противораковой иммунотерапии [20]. В Т-клетках, изъятых из крови онкобольного, изменяют гены, которые отвечают за экспрессию рецепторов для раковых антигенов. Также можно добавлять гены для большей выживаемости и эффективного проникновения модифицированных Т-клеток в опухоль. С помощью таких манипуляций создаются высокоактивные «убийцы» раковых клеток [21].
Когда было доказано, что большинство видов рака имеют специфические антигены и способны индуцировать свои защитные механизмы [22], была выдвинута гипотеза, что блокировка иммунной системы раковых клеток облегчит отторжение опухоли. Поэтому для производства большинства противоопухолевых вакцин в качестве источника антигенов используют опухолевые клетки пациента или специальные аллогенные клетки. Основные проблемы иммунотерапии опухолей — вероятность возникновения аутоиммунных реакций в организме больного, отсутствие противоопухолевого ответа, иммуностимуляция роста опухоли и другие.
Стволовые клетки
Мощным инструментом генной терапии является использование стволовых клеток в качестве векторов для передачи терапевтических агентов — иммуностимулирующих цитокинов, «суицидных» генов, наночастиц и антиангиогенных белков [23]. Стволовые клетки (СК), кроме способности к самообновлению и дифференцировке, имеют огромное преимущество по сравнению с другими транспортными системами (нанополимерами, вирусами): активация пролекарства происходит непосредственно в опухолевых тканях, что позволяет избежать системной токсичности (экспрессия трансгенов способствует разрушению только раковых клеток). Дополнительным позитивным качеством является «привилегированное» состояние аутологичных СК — использованные собственных клеток гарантирует 100%-совместимость и повышает уровень безопасности процедуры [24]. Но все же эффективность терапии зависит от правильной ex vivo передачи модифицированного гена в СК и последующего переноса трансдуцированных клеток в организм пациента. Кроме того, прежде чем применять терапию в широких масштабах, нужно детально изучить все возможные пути трансформации СК в раковые клетки и разработать меры безопасности для предупреждения канцерогенного преобразования СК.
Заключение
Если подвести итоги, можно с уверенностью говорить, что наступает эпоха персонализированной медицины, когда для лечения каждого онкобольного будет подбираться определенная эффективная терапия. Уже разрабатываются индивидуальные программы лечения, которые обеспечивают своевременный и правильный уход и приводят к значительному улучшению состояния пациентов. Эволюционные подходы для персонализированной онкологии, такие как геномный анализ, производство таргетных препаратов, генная терапия рака и молекулярная диагностика с использованием биомаркеров уже приносят свои плоды [17].
Особенно перспективным методом лечения онкозаболеваний является генная терапия. На данный момент активно проводятся клинические испытания, которые часто подтверждают эффективность ГТ в тех случаях, когда стандартное противораковое лечение — хирургия, лучевая терапия и химиотерапия — не помогает. Развитие инновационных методик ГТ (иммунотерапии, онколитической виротерапии, «суицидной» терапии и др.) сможет решить проблему высокой смертности от рака, и, возможно, в будущем диагноз «рак» не будет звучать приговором.
Видео. Рак: узнать, предупредить и устранить болезнь