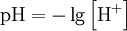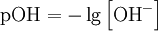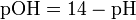Что такое кислотность раствора
§ 11. Кислотность среды. Понятие о pH раствора
Вспомните:
Кислотность среды
Водородный показатель
Значение рН водных растворов большинства веществ и природных растворов находится в интервале от 1 до 13 (рис. 11.2).
Рис. 11.2. Значение рН различных природных и искусственных растворов
Сёрен Педер Лауриц Сёренсен (1868-1939)
Датский физико-химик и биохимик, президент Датского королевского общества. Окончил Копенгагенский университет. В 31 год стал профессором Датского политехнического института. Возглавлял престижную физико-химическую лабораторию при пивоваренном заводе Карлсберга в Копенгагене, где сделал свои главные научные открытия. Основная научная деятельность посвящена теории растворов: он ввел понятие о водородном показателе (рН), изучал зависимость активности ферментов от кислотности растворов. За научные достижения Сёренсен внесен в перечень «100 выдающихся химиков XX века», но в истории науки он остался прежде всего как ученый, который ввел понятия «рН» и «рН-метрия».
Определение кислотности среды
Для определения кислотности раствора в лабораториях чаще всего используют универсальный индикатор (рис. 11.3). По его окраске можно определить не только наличие кислоты или щелочи, но и значение рН раствора с точностью до 0,5. Для более точного измерения рН существуют специальные приборы — рН-метры (рис. 11.4). Они позволяют определить рН раствора с точностью до 0,001-0,01.
Рис. 11.3. Универсальным индикатором определяют приблизительное значение рН
Рис. 11.4. Для измерения рН растворов используют специальные приборы — рН-метры: а — лабораторный (стационарный); б — портативный
Используя индикаторы или рН-метры, можно следить за тем, как протекают химические реакции. Например, если к раствору натрий гидроксида приливать хлоридную кислоту, то произойдет реакция нейтрализации:
NaOH + HCl = NaCl + H2O
В этом случае растворы реагентов и продуктов реакции бесцветны. Если же в исходный раствор щелочи поместить электрод рН-метра, то о полной нейтрализации щелочи кислотой можно судить по значению рН образованного раствора.
Применение водородного показателя
Определение кислотности растворов имеет большое практическое значение во многих областях науки, промышленности и других сферах жизни человека.
Экологи регулярно измеряют рН дождевой воды, воды рек и озер. Резкое повышение кислотности природных вод может быть следствием загрязнения атмосферы или попадания в водоемы отходов промышленных предприятий (рис. 11.5). Такие изменения влекут за собой гибель растений, рыбы и других обитателей водоемов.
Рис. 11.5. Влияние уровня pH воды в водоемах на жизнедеятельность растений в них
Водородный показатель очень важен для изучения и наблюдения процессов, происходящих в живых организмах, т. к. в клетках протекают многочисленные химические реакции. В клинической диагностике определяют pH плазмы крови, мочи, желудочного сока и др. (рис. 11.6). Нормальное значение pH крови — от 7,35 до 7,45. Даже небольшое изменение pH крови человека вызывает серьезные заболевания, а при рН = 7,1 и ниже начинаются необратимые изменения, которые могут привести к смерти.
Рис. 11.6. Значение pH биологических жидкостей организма человека
Для большинства растений важна кислотность почвы, поэтому агрономы заранее проводят анализ почв, определяя их рН (рис. 11.7). Если кислотность слишком велика для определенной культуры, почву известкуют — добавляют мел или известь.
Рис. 11.7. Измерение pH почвы
В пищевой промышленности при помощью кислотно-основных индикаторов проводят контроль качества продуктов питания (рис. 11.8). Например, в норме для молока pH = 6,8. Отклонение от этого значения свидетельствует либо о наличии посторонних примесей, либо о его скисании.
Рис. 11.8. Контроль качества молока в лаборатории на молокозаводе
Важным является значение pH для косметических средств, которые мы используем в быту. В среднем для кожи человека pH = 5,5. Если кожа контактирует со средствами, кислотность которых существенно отличается от этого значения, то это влечет преждевременное старение кожи, ее повреждение или воспаление. Было замечено, что у прачек, которые длительное время использовали для стирки обычное хозяйственное мыло (pH = 8-10) или стиральную соду (Na2CO3, pH = 12-13), кожа рук становилась очень сухой и покрывалась трещинами. Поэтому очень важно использовать различные косметические средства (гели, кремы, шампуни и т. д.) с pH, близким к естественному pH кожи.
Кислотность (рН)
Кислотность (лат. aciditas) — характеристика активности ионов водорода в растворах и жидкостях.
В медицине кислотность биологических жидкостей (крови, мочи, желудочного сока и других) является диагностически важным параметром состояния здоровья пациента. В гастроэнтерологии, для правильного диагностирования целого ряда заболеваний, например, пищевода и желудка, одномоментная или даже средняя величина кислотности не является значимой. Чаще всего важно понимание динамики изменения кислотности в течение суток (ночная кислотность нередко отличается от дневной) в нескольких зонах органа. Иногда важно знать изменение кислотности, как реакцию на определенные раздражители и стимуляторы.
Содержание
Водородный показатель pH
Некоторые заблуждения
Если кто-то из пациентов говорит, что у него «нулевая кислотность», то это не более, чем оборот речи, означающий, скорее всего, что у него нейтральное значение кислотности (рН=7). В организме человека величина показателя кислотности не может быть меньше 0,86 рН. Также распространено заблуждение, что величины кислотности могут быть только в диапазоне от 0 до 14 pH. В технике возможен показатель кислотность и отрицательный, и больше 20.
Когда говорят о кислотности кого-либо органа, важно при этом понимать, что часто в различных частях органа кислотность может значительно отличаться. Кислотность содержимого в просвете органа и кислотность на поверхности слизистой оболочки органа также часто бывает не одинаковой. Для слизистой оболочки тела желудка характерно, что кислотность на поверхности слизи, обращенной в просвет желудка кислотность 1,2–1,5 рН, а на стороне слизи, обращённой к эпителию — нейтральная (7,0 рН).
Величина рН для некоторых продуктов и воды
В таблице ниже указаны величины кислотности некоторых распространенных продуктов и чистой воды при разной температуре:
| Продукт | Кислотность, ед. рН |
| Лимонный сок | 2,1 |
| Вино | 3,5 |
| Томатный сок | 4,1 |
| Апельсиновый сок | 4,2 |
| Черный кофе | 5,0 |
| Чистая вода при 100 °С | 6,13 |
| Чистая вода при 50 °С | 6,63 |
| Свежее молоко | 6,68 |
| Чистая вода при 22 °С | 7,0 |
| Чистая вода при 0° С | 7,48 |
Кислотность и пищеварительные ферменты
Очень многие процессы в организме невозможны без участия специальных белков – ферментов, которые катализируют химические реакции в организме, не подвергаясь при этом химическим превращениям. Пищеварительный процесс не возможен без участия разнообразных пищеварительных ферментов, расщепляющих разные органические молекулы пищи и действующих только в узком диапазоне кислотности (своем для каждого фермента). Важнейшие протеолитические ферменты (расщепляющие белки пищи) желудочного сока: пепсин, гастриксин и химозин (реннин) продуцируются в неактивной форме – в виде проферментов и позже активируется соляной кислотой желудочного сока. Пепсин наиболее активен в сильнокислой среде, с pH от 1 до 2, гастриксин имеет максимум активности при рН 3,0–3,5, химозин, расщепляющий белки молока до нерастворимого белка казеина, имеет максимум активности при рН 3,0–3,5.
Протеолитический ферменты, выделяемые поджелудочной железой и «действующие» в двенадцатиперстной кишке: трипсин имеющий оптимум действия в слабощелочной среде, при pH 7,8–8,0, близкий к нему по функциональности химотрипсин наиболее активен в среде с кислотностью до 8,2. Максимум активности карбоксипептидаз А и В 7,5 рН. Близкие значения максимальной и у других ферментов, выполняющих пищеварительные функции в слабощелочной среде кишечника.
Пониженная или повышенная кислотность по отношению к норме в желудке или двенадцатиперстной кишке, таким образом, приводит к существенному снижению активности тех или ферментов или даже их исключению из пищеварительного процесса, и, как следствие к проблемам с пищеварением.
Кислотность слюны и полости рта
Кислотность слюны зависит от скорости слюноотделения. Обычно кислотность смешанной слюны человека равна 6,8–7,4 pH, но при большой скорости слюноотделения достигает 7,8 pH. Кислотность слюны околоушных желёз равна 5,81 pH, подчелюстных — 6,39 pH.
У детей в среднем кислотность смешанной слюны равна 7,32 pH, у взрослых — 6,40 pH (Римарчук Г.В. и др.).
Кислые гастроэзофагеальные и фаринголарингеальные рефлюксы, достигающие полости рта, играют ведущую роль в возникновении патологии полости рта. В результате попадания соляной кислоты происходит снижение кислотности смешанной слюны ниже 7,0 рН. Слюна, в норме обогащенная кальцием, фосфатами, содержащая карбонаты, натрий, калий, магний и обладающая щелочными свойствами, при низком рН, особенно при значениях 6,2–6,0, приводит к очаговой деминерализации эмали зубов с появлением эрозий твердых тканей зубов и образованием в них полостей — кариеса (Новикова В.П., Шабанов A.M.).
Кислотность зубного налета зависит от состояния твердых тканей зубов. Будучи нейтральной у здоровых зубов, она смещается в кислую сторону, в зависимости от степени развития кариеса и возраста подростков. У 12-летних подростков с начальной стадией кариеса (предкариесом) кислотность зубного налета равна 6,96 ± 0,1 pH, у 12–13-летних подростков со среднем кариесом кислотность зубного налета от 6,63 до 6,74 pH, у 16-летних подростков при поверхностном и среднем кариесе кислотность зубного налета равна, соответственно, 6,43 ± 0,1 pH и 6,32 ± 0,1 pH (Кривоногова Л.Б.).
Кислотность секрета глотки и гортани
Кислотность секрета глотки и гортани у здоровых и больных хроническим ларингитом и фаринголарингеальным рефлюксом различна (А.В. Лунев):
Место измерения рН
Среднее значение рН секрета глотки и гортани внутри групп не имеет значимых различий. У больных при сравнении с группой здоровых лиц кислотность секрета глотки и гортани выше (т.е. рН меньше).
Кислотность в пищеводе
Нормальная кислотность в пищеводе 6,0–7,0 рН. В пищевод, кроме пищи и потребляемой жидкости, периодически поступает слюна, имеющая нейтральную и слабощелочную величину кислотности, а также рефлюксат, забрасываемый из желудка гастроэзофагеальными рефлюксами. Чаще рефлюксат имеет кислотность, соответствующую кислотности желудка. Поэтому на время находжения желудочного рефлюксата в пищеводе кислотность последнего увеличивается, величина рН уменьшается до 1,5–2. Если гастроэзофагеальных рефлюксов относительно немного, они считаются физиологичными и не сказываются на состоянии пищевода. В противном случае возможно раздражение рефлюксатом эпителия пищевода и развитие гастроэзофагеальной рефлюксной болезни.
На рисунке выше дан график кислотности в пищеводе здорового человека, полученный с помощью внутрижелудочной рН-метрии (Рапопорт С.И.). На графике хорошо наблюдаемы гастроэзофагеальные рефлюксы – резкие уменьшения кислотности до 2–3 рН, в данном случае являющиеся физиологичными.
Кислотность в желудке. Повышенная и пониженная кислотность
Причиной многих болезней органов пищеварительного тракта является дисбаланс процессов кислотопродукции и кислотонейтрализации. Длительная гиперсекреции соляной кислоты или недостаточность кислотонейтрализации, и, как следствие, повышенная кислотность в желудке и/или двенадцатиперстной кишке, вызывает так называемые кислотозависимые заболевания. В настоящее время к ним относят: пептическую язву желудка и двенадцатиперстной кишки, гастроэзофагеальную рефлюксную болезнь (ГЭРБ), эрозивно-язвенные поражения желудка и двенадцатиперстной кишки на фоне приема аспирина или нестероидных противовоспалительных препаратов (НПВП), синдром Золлингера-Эллисона, гастриты и гастродуодениты с повышенной кислотностью и другие.
Пониженная кислотность наблюдается при анацидных или гипоацидных гастрите или гастродуодените, а также при раке желудка. Гастрит (гастродуоденит) называется анацидным или гастритом (гастродуоденитом) с пониженной кислотностью, если кислотность в теле желудка составляет примерно 5 или больше ед. pH. Причиной пониженной кислотности часто бывает атрофия париетальных клеток в слизистой оболочке или нарушения в их функциях.
Кислотность в кишечнике
Нормальная кислотность в луковице двенадцатиперстной кишки 5,6–7,9 рН. Кислотность в тощей и подвздошной кишках нейтральная или слабощелочная и находится в пределах от 7 до 8 рН. Кислотность сока тонкой кишки 7,2–7,5 рН. При усилении секреции достигает 8,6 рН. Кислотность секрета дуоденальных желез — от рН от 7 до 8 рН.
Кислотность сока толстой кишки 8,5–9,0 рН.
В нижних отделах толстой кишки значения pH кислотности постепенно возрастают, достигая максимального значения рН в области ректосигмоидального перехода. В нижеследующей таблице дана кислотность в сигмовидной и прямой кишках здорового человека, полученная методом прицельной эндоскопической рН-метрии (Чуркин И.А.):
ед. рН
Кислотность кала
Кислотность крови
Кислотность плазмы артериальной крови человека колеблется в пределах от 7,37 до 7,43 рН, составляя в среднем 7,4 рН. Кислотно-щелочное равновесие в крови человека является одним из самых стабильных параметров, поддерживающее кислые и щелочные компоненты в определенном равновесии в очень узких границах. Даже небольшой сдвиг от указанных пределов может привести к тяжелой патологии. При сдвиге в кислотную сторону возникает состояние, называемое ацидозом, в щелочную — алколозом. Изменение кислотности крови выше 7,8 рН или ниже 6,8 рН несовместимо с жизнью.
Кислотность венозной крови — 7,32–7,42 рН. Кислотность эритроцитов составляет 7,28–7,29 рН.
Кислотность мочи
У здорового человека при нормальном питьевом режиме и сбалансированном питании кислотность мочи находится в пределах от 5,0 до 6,0 рН, но может колебаться от 4,5 до 8,0 рН. Кислотность мочи новорожденного в возрасте до месяца в норме — от 5,0 до 7,0 рН.
Кислотность мочи повышается, если в рационе человека преобладает мясная пища, богатая белками. Увеличивает кислотность мочи тяжелая физическая работа. Молочно-растительная диета приводит к тому, что моча становится слабощелочной. Повышение кислотности мочи отмечается при повышенной кислотности желудка. Пониженная кислотность желудочного сока не влияет на кислотность мочи. Изменение кислотности мочи чаще всего соответствует изменению кислотности крови. Кислотность мочи изменяется при многие заболевания или состояниях организма, поэтому определение кислотности мочи является важным диагностическим фактором.
В нормальных условиях у здорового человека реакция мочи слабокислая, pH колеблется в зависимости от режима питания между 4,5 и 8. При богатой белками пище моча обычно дает кислую, а при растительной пище – щелочную реакцию. При выделении дифосфатов наблюдается слабощелочная реакция. В патологических условиях моча также может дать сильно выраженную щелочную реакцию, и в таком случае обыкновенно мутна. При дыхательном алкалозе (гипервентиляции) или метаболическом алкалозе, потере кислот с желудочным соком, уменьшении количества калия в крови реакция мочи становится щелочной. Кислая реакция мочи наблюдается при голодании, тяжелых поносах, ацидозе или после принятия внутрь подкисляющих лекарственных средств (хлористого аммония). Исследования производят лишь со свежевыпущенной мочой. Проще всего производить исследования посредством синей и красной лакмусовой бумажки. Кислая моча меняет синий цвет лакмуса на красный, а щелочная – красный на синий. Истинная реакция мочи лучше определяется универсальной индикаторной бумагой с диапазоном от 1—14 (Ишманов М.Ю. и др.).
Кислотность влагалища, цервикального канала и полости матки
По данным Ившина В.Г. и др. (2020) в области наружного зева среда кислая: рН = 6,42 ± 0,026. По ходу цервикального канала величина рН плавно возрастает. В области внутреннего зева величина рН приближается к нейтральной: 6,96 ± 0,013. При продвижении датчика в полости матки отмечается плавное увеличение рН от 7,14 ± 0,11 до 7,19 ± 0,11. На слизистой дна матки среда слабощелочная: рН = 7,22 ± 0,007.
Публикации для профессионалов здравоохранения, затрагивающие проблематику кислотности в женских половых органах
Кислотность спермы
Кислотность кожи
Поверхность кожи покрыта воднолипидной кислотной мантией или мантией Маркионини, состоящей из смеси кожного сала и пота, в которую добавлены органические кислоты — молочная, лимонная и другие, образованные в результате биохимических процессов, протекающих в эпидермисе. Кислотная воднолипидная мантия кожи является первым барьером защиты от микроорганизмов. У большинства людей в норме кислотность мантии равна 3,5–6,7 рН. Бактерицидное свойство кожи, придающее ей способность противостоять микробной инвазии, обусловлено кислой реакцией кератина, своеобразным химическим составом кожного сала и пота, наличием на ее поверхности защитной воднолипидной мантии с высокой концентрацией водородных ионов. Входящие в ее состав низкомолекулярные жирные кислоты, в первую очередь гликофосфолипиды и свободные жирные кислоты, обладают бактериостатическим эффектом, селективным для патогенных микроорганизмов. Поверхность кожи заселена нормальной симбиотической микрофлорой, способной к существованию в кислой среде: Staphylococcus epidermidis, Staphylococcus aureus, Propionibacterium acnes и другие. Некоторые из этих бактерий сами вырабатывают молочную и другие кислоты, внося свой вклад в формирование кислотной мантии кожи.
Верхний слой эпидермиса (кератиновые чешуйки) имеет кислотность с величиной рН от 5,0 до 6,0. При некоторых кожных заболеваниях величина кислотности изменяется. Например, при грибковых заболеваниях рН возрастает до 6, при экземе до 6,5, при угревой сыпи до 7.
Кислотность других биологических жидкостей человека
Кислотность жидкостей внутри человеческого организма в норме совпадает с кислотностью крови и находится в пределах от 7,35 до 7,45 pH. Кислотность некоторых других биологических жидкостей человека в норме приведена в таблице:
| Биологическая жидкость | Кислотность в норме, ед. рН |
| Цитоплазма клеток | около 7,45 |
| Слеза | от 7,3 до 7,5 |
| Ликвор (спинномозговая жидкость) | от 7,35 до 7,8 |
| Желчь | от 8,0 до 8,5 |
| Женское молоко | от 6,9 до 7,5 |
| Панкреатический сок | от 7,5 до 9,0 |
| Синовиальная жидкость (коленный сустав) | от 7,3 до 7,6 |
| Сок предстательной железы | от 6,6 до 6,8 |
Публикации для профессионалов здравоохранения, затрагивающие проблематику кислотности в органах пищеварения
Меры и эталоны кислотности
Для поверки, калибровки средств измерения кислотности в медицине и технике выпускаются специальные «меры кислотности», «буферные растворы», «стандарт-титры». Они способны поддерживать строго установленную величину кислотности раствора, не меняющуюся при измерениях и в течение определённого времени. Подробнее см. «Стандарт-титры и буферные растворы для калибровки».
На фотографии справа: буферные растворы с рН=1,2 и рН=9,18 для калибровки рН-зондов.
Кислотность
Водоро́дный показа́тель, pH (произносится «пэ аш»), — это мера активности (в случае разбавленных растворов отражает концентрацию) ионов водорода в растворе, количественно выражающая его кислотность, вычисляется как отрицательный (взятый с обратным знаком) десятичный логарифм концентрации водородных ионов, выраженной в молях на литр: