Что такое метаболизм костной ткани простыми словами
Научная электронная библиотека
1.1. Особенности метаболизма костной ткани
В филогенетическом аспекте кость является самой молодой тканью. Она до сих пор находится в периоде адаптации к существованию в условиях гравитации. Кроме того, скелет человека подвержен воздействию такого фактора, как прямохождение, а в последние столетия претерпевает изменения, связанные с гипокинезией и различными вынужденными положениями.
В морфофункциональном отношении кость является одной из наиболее сложных и биологически активных тканей. По многим показателям она превосходит другие системы организма и является наиболее массивной, многофункциональной, обладает высокой метаболической и репаративной активностью. Костная ткань в разных участках на 20–25 % состоит из органического матрикса. Около 60–65 % массы сухого деминерализованного матрикса приходится на коллаген и 17–18 % на неколлагеновые белки, по своей структуре, являющиеся гликопротеинами. В состав стромы костного мозга входят недифференцированные стволовые мезенхимальные клетки – ретикулярные, соединительнотканные, эндостальные фибробластоподобные, эндотелиальные клетки, адипоциты, дифференцированные костные клетки (остеобласты, остеокласты, остеоциты), межклеточное вещество, клетки эндоста и периоста, костный мозг, сосудистые, лимфатические и нервные образования, интимно связанные с окружающими мягкими тканями [13, 28, 36, 52].
В костной ткани постоянно протекают два противоположно направленных процесса – резорбция и новообразование. Соотношение этих процессов зависит от различных факторов, в том числе от физических нагрузок на кость и возраста. Считается, что остеогенез происходит за счет клеток эндоста, периоста и костного мозга. Процесс физиологического ремоделирования губчатой костной ткани проходит несколько фаз, в каждую из которых ведущую роль выполняют те или иные клетки. Первоначально участок костной ткани, подлежащий резорбции, «помечается» остеоцитами при помощи специфических цитокинов (активация), разрушается протективный слой на костном матриксе. К оголенной поверхности кости мигрируют предшественники остеокластов и сливаются в многоядерную структуру – симпласт – зрелый остеокласт. Затем остеокласт деминерализует костный матрикс (резорбция), уступает место макрофагам, которые завершают разрушение органической матрицы межклеточного вещества кости и подготавливают поверхность к адгезии остеобластов (реверсия). На последнем этапе в зону разрушения прибывают предшественники, дифференцирующиеся в остеобласты, они синтезируют и минерализуют матрикс в соответствии с новыми условиями статической и динамической нагрузки на кость (формирование) [9, 14, 19, 45].
Регуляция остеогенеза имеет три уровня: локальный (местный), системный и генетический. Это обстоятельство в конечном итоге обеспечивает высокий уровень метаболизма костной ткани.
Локальную регуляцию осуществляет микроокружение посредством различных цитокинов, большим количеством факторов роста, рядом полипептидов, ферментов, межклеточных контактов.
Системная нейроэндокринная регуляция осуществляется гормонами и веществами с гормоноподобным действием. Наиболее изученными являются паратиреоидный гормон, половые гормоны, метаболиты вит. D, кальцитонин, глюкокортикоиды, тиреоидные гормоны [9, 52]. Морфофункциональная связь остеогенеза и кровообращения осуществляются не только анатомически, но и тесно функционально. Это подтверждено многочисленными исследованиями связей внутрикостной и внекостной системы артериального, венозного, лимфатического русла, нервной регуляции с остеорецепцией.
Красный костный мозг является депо крови, органом кроветворения, высокочувствительной рефлексогенной зоной, центральным звеном иммунной системы. Красный костный мозг – это источник практически неистощаемого пула мезенхимальных стволовых фибробластоподобных клеток – предшественников остеобластов, способных не только потенцировать остеогенез, но и строить кроветворное микроокружение и регулировать собственно кроветворение [49].
Нарушение процесса остеогенеза приводит к патологии. Исследования В.М. Чепоя (1978) с применением радиоактивного пирофосфата технеция показали, что при межпозвонковом остеохондрозе в телах позвонков отмечается значительное ослабление фибробластических процессов и усиление остеокластических изменений. Кость становится разреженной и хрупкой, как в старческом возрасте, т.е. развивается остеопороз. По мнению McMahon et al. (2002) дефицит в остеогенезе карбоангидразы-2 приводит к появлению симптомов остеосклероза.
По данным С.В. Либенсона (1989) при гипокинезии происходят существенные изменения в системе регуляции остеогенеза, выражающиеся в гипокальцемии, увеличении содержания паратгормина и кальцитонина в крови, гиперэкскреции с мочой минеральных и органических компонентов, участвующих в остеогенезе. Подобные же изменения автор наблюдал и при хроническом болевом синдроме.
Репаративная регенерация – это восстановление ткани после повреждения. Механизмы физиологической и репаративной регенерации костной ткани качественно едины, осуществляются на основе общих закономерностей. Репаративная регенерация – есть в той или иной мере усиленная физиологическая [34]. Одними из индукторов репаративной регенерации костной ткани и усиления метаболизма являются ее травматическое повреждение [10, 34], а также метод аутотрансплантации красного костного мозга, как источника мезенхимальных стволовых клеток – предшественников фибробластов.
Многие исследователи указывают на возможность локально возбуждать репаративную регенерацию костной ткани, тем самым изменять ее метаболизм, методом остеотомии, трепанации, туннелизации или перфорации в необходимых участках кости. Локализованная и дозированная альтерация костной ткани применяется, как средство терапевтического воздействия и приводит к купированию дегенеративно-дистрофических нарушений. Лечебный эффект проявляется местно в зоне стимуляции и регионарно в сегментарных областях за счет интенсификации гемоциркуляции [10, 32, 34].
Микротравматическое повреждение костной ткани приводит к возникновению остеоиндуктивного сигнала, который осуществляется морфогенетическим белком-2, при этом, как в костной ткани, так и в кровеносной системе, происходит стремительная активация ростовых факторов (инсулиноподобного фактора роста, фактора роста фибробластов, колониестимулирующего фактора, фактора некроза опухоли-α и т.д.) [6].
Индуцированный фактор некроза опухоли человека (hTNF)-α стимулирует образование одноядерных преостеокластоподобных клеток (POCs), увеличивает число мРНК рецепторов кальцитонина (CTR) в POCs, формирует образование колонийстимулирующего фактора макрофагов (M-CSF) и экспрессирует образование мРНК активатора ядерного фактора Каппа В лиганда (RANKL). Совместное влияние стволовых клеток красного костного мозга и hTNF-α с растворимым RANKL увеличивают образование многоядерных остеокластоподобных клеток (MNC-s) из макрофагов, осуществляя лизис и резорбцию перелома. RANKL не только участвует в сигнальной трансдукции преостеокластов и остеокластов, но и в резорбтивной функции и выживании зрелых остеокластов [50]. Сигнальные механизмы RANKL распространяются и на активируемые митогенами протеинкиназы – нейроэндокринный уровень регуляции [50]. HTNF-α, простагландин Е2 (PGE2), паратгормон (PNG), 1, 25 (ОН) 2 витамин D3 индуцируют образование интерлейкина 11 (IL-11), интерлейкина 11R (IL-11R) и гликопротеина (gp 130) остеобластами за счет мРНК.
Основной фактор роста фибробластов (bFGF) увеличивает в ККМ количество остеобластов и стимулирует образование белкового матрикса, ускоряя минерализацию и снижая уровень свободного фосфата.
При повреждении кости в красном костном мозге, так же экспрессируется мРНК фактора роста эндотелия сосудов (VEGF) с рецепторами. Ангиобласты способствуют окружению поврежденной зоны капиллярами. Действие механического повреждения может быть потенцировано введением аутологичных стволовых клеток костного мозга [36].
Особый интерес вызывают работы о применении внутрикостной трансплантации аллогенного костного мозга для лечения экспериментального сенильного остеопороза. В этом случае остеоиндуктивный сигнал осуществляется морфогенетическим белком-2 и макрофагами [25, 50]. Аденозинтрифосфат (АТФ) так же участвует в передаче сигналов факторов роста ККМ за счет повышения активности протеинкиназ. Таким образом, существенно усиливается метаболическая активность костной ткани.
Янковский Г.А. (1982) привел результаты лечения 135 больных пояснично-крестцовым радикулитом методом введения 1 мл изотонического раствора натрия хлорида в остистые отростки нижних поясничных позвонков. У 122 пациентов автор отметил значительный регресс неврологической симптоматики и в течение последующих 2-х лет у этих больных поясничные боли не отмечались. При рентгенденситометрии у данных пациентов было выявлено увеличении плотности костной ткани. Автор сделал вывод, что внутрикостная пункция остистого отростка вследствие общности кровообращения обуславливает улучшение трофики тела позвонка и, соответственно, межпозвонкового диска.
При гистологическом исследовании костной ткани И.Н. Атясовым (2000) после проведения внутрикостного введения 10 мл различных жидкостей или крови в 1 сутки определялось разрушение костных трабекул, повреждение стромы и паренхимы костномозговой ткани, нарушение кровообращения в очаге деструкции, что являлось следствием механического повреждения в момент внедрения иглы в кость.
Через 3 суток на месте внутрикостного вливания 10 мл жидкости наблюдалось разрастание нежноволокнистой ткани и гиперплазия эндостальных элементов в виде окружения близлежащих к очагу деструкции костных трабекул остеобластами, а в некоторых опытах (после внутрикостного введения лекарственных жидкостей вместе с аутологичным костным мозгом) – уже было видно образование и разрастание остеоидных балочек.
Через 5 суток разросшаяся нежноволокнистая ткань почти полностью замещала очаг кровоизлияний, определялась резко выраженная гиперплазия соединительнотканных и эндостальных элементов в виде разрастания множества остеоидных балочек и напластования остеоидных масс на окружающие зрелые костные балки.
По истечении 7 суток в месте введения жидкости определялась нежно-волокнистая ткань, полностью замещающая очаг кровоизлияний.
Через 15 суток в нежно-волокнистой соединительной ткани определялись скопления лимфоидных и жировых клеток, множество зрелых костных балок с явлениями активной перестройки с помощью остеобластов и остеокластов.
На 18–20 сутки определялись участки фиброза.
В последующие 30–60 суток в месте введения иглы в кость отмечалась разросшаяся фибринозная ткань неравномерной плотности, окруженная костными балками, находящимися в стадии дальнейшей перестройки.
К 60 суткам костная и костномозговая ткани полностью восстанавливали свою клеточную структуру [2, 3].
Костная ткань – это главное депо минеральных солей в организме, по своей химической структуре представляет собой кристаллы гидроксиапатита, поэтому обладает физическими свойствами пьезоэлектрика. При одноостных сжатиях, изгибах или кручениях постоянно изменяется пьезоэлектрический потенциал как всей кости, так и отдельных ее составляющих элементов. В основополагающих работах Фукады и Ясуды (1957) было показано, что поляризация линейно связана с механическим напряжением и деформацией. В состоянии покоя на поверхности кости нет связанных поляризационных зарядов, вызванных собственными механическими напряжениями, т.к. они компенсируются ионами электролита. Механическая деформация кости определенным образом изменяет пьезоэлектрические потенциалы.
Так, на вогнутой поверхности образуется отрицательный, а на выпуклой – положительный заряд. Сочетание положительных и отрицательных потенциалов так же существенно влияет на процессы активации остеокластов, остеобластов и других клеток кости и костного мозга, на движение ионов и заряженных молекул по кровеносным сосудам.
На вогнутой поверхности стимулируется костеобразование, а на выпуклой – резорбция кости. Кроме того, кровотоком создается электрохимический потенциал. Совокупность электропотенциалов распределена в кости таким образом, что венулы заряжены преимущественно положительно, что, по-видимому, является биологически оправданным механизмом предотвращения зарастания костных каналов, в которых они проходят.
Однако при недостаточных механических нагрузках на кость, незначительном внутрикостном кровотоке, венозном застое изменяется соотношение разнополярных потенциалов. Положительный заряд венул уменьшается или превращается в отрицательный. Это способствует костеобразованию в месте их выхода. Уменьшается диаметр отверстия, в котором проходит венула, что ограничивает возможности резервного оттока, усиливает отек, замедляет отток крови от кости. Таким образом, замыкается патологический круг.
Что такое метаболизм костной ткани простыми словами
Современная лабораторная диагностика остеопороза.
Значимость заболевания в современном обществе и медицине определяется его распространённостью среди населения, тяжестью течения и исходов, экономическими потерями больного, семьи и общества в целом. Остеопороз (ОП) — системное метаболическое заболевание скелета, характеризующееся снижением массы костной ткани и нарушением микроархитектоники её строения, что снижает прочность кости и увеличивает риск переломов. По мнению экспертов ВОЗ, ОП сегодня — одно из наиболее распространённых заболеваний, которое наряду с инфарктом миокарда, инсультом, раком и внезапной смертью занимает ведущее место в структуре заболеваемости и смертности населения.
Результаты многочисленных исследований убедительно доказали, что костная масса является главной детерминантой механических свойств костной ткани и определяет 75-80% её крепости. Риск переломов прямо связан с абсолютными значениями минеральной плотности костной ткани (МПКТ) позвоночника и шейки бедра, а костная денситометрия — единственный достоверный метод, позволяющий установить степень снижения костной массы. Риск перелома увеличивается с возрастом, который главным образом связан у пожилых людей с низкой МПКТ. Риск перелома бедра возрастает в 2-3 раза при каждом снижении МПКТ шейки бедра на одно стандартное отклонение в соответствии с критериями ВОЗ.
Патогенез остеопороза.
ОП сегодня широко используется как модель фундаментальных исследований в изучении молекулярных механизмов межклеточного взаимодействия. ОП – многофакторное заболевание, в основе которого лежат процессы нарушения костного ремоделирования с повышением резорбции костной ткани и снижением костеобразования. Ремоделирование костной ткани начинается с резорбции, осуществляемой в процессе остеокластогенеза с образованием полости резорбции. Остеобласты (ОБ) «атакуют» полость резорбции, где строят новый костный матрикс для последующей минерализации. Оба процесса костеобразования тесно связаны. Образование кости превышает резорбцию в течение роста скелета, и наоборот, резорбция превалирует в течение последующего периода жизни человека. Оба процесса костеобразования являются результатом тесного клеточного взаимодействия ОБ иостеокластов (ОК), которые берут начало от предшественников различных клеточных линий, а именно: ОБ — из мезенхиальных стволовых клеток, ОК — из макрофагально-моноцитарных клеток крови.
Кость формируется остеобластами. Основная их функция – синтез остеоида (протеинового матрикса), который на 90-95% состоит из коллагена 1 типа, на 5% из белка остеокальцина и впоследствии минерализуется кальцием и фосфатом из внеклеточной жидкости. ОБ содержат фермент щёлочную фосфатазу, несут рецепторы к паратиреоидному гормону (ПТГ) и кальцитриолу и способны к пролиферации. Минеральная часть кости состоит из гидроксиапатита и аморфного фосфата кальция, которые нековалентно связаны с белками органического матрикса
Резорбция кости осуществляется остеокластами. Это подвижные клетки. Выделяя протеолитические ферменты и кислую фосфатазу, вызывают деградацию коллагена, разрушение гидроксиапатита и выведение минералов из матрикса. Имеется корреляция между активностью тартратрезистентной кислой фосфатазы в сыворотке крови и выраженностью резорбтивных процессов в кости.
В норме оба процесса – образование и разрушение уравновешены.
Сроки физиологического ремоделирования кости.
| Фаза резорбции кости | 14-30 дней |
| Switch-over фаза (простагландин Е2 ответственен за апоптоз остекластов) | 10 дней |
| Фаза формирования кости | 90 дней |
| Фаза отдыха | 900 дней |
Биологический смысл феномена ремоделирования кости состоит в приспособлении механических свойств кости к постоянно меняющимся условиям окружающей среды. Рост и обновление скелета сопровождается регенерацией микроповреждений и поддержанием возможности перехода минералов в кровь и обратно. У взрослых людей остеобласты продуцируют чуть меньше костной ткани, чем требуется. Следствием этого является отрицательный баланс кости, который составляет 0,5-1% ежегодно. Данный феномен известен как «ассоциированная с возрастом остеопения».
OPG-остеопротегерин – остеокластингибирующий фактор, гликопротеин, широко экспрессированный в различных тканях, является мощным ингибитором костной резорбции. OPG действует для RANKL как «мнимый» рецептор, блокирует взаимодействие с RANK и таким образом ингибирует формирование зрелых ОК, нарушает процесс остеокластогенеза и резорбцию костной ткани. Баланс между RANKL и OPG фактически определяет количество резорбированной кости.
Недавно были получены данные, что Т-клетки принимают участие в регуляции костного метаболизма. При индукции интерлейкина-17 (IL-17),который в эксперименте индуцировал экспрессию СОХ-2-зависимого простагландина Е2 и RANKL в ОБ, авторы пришли к заключению, что IL-17 — важный цитокин для остеокластной резорбции. Однако наиболее важными медиаторами для действия различных систем в процессе ремоделирования костной ткани как в норме, так и при ОП является в настоящее время система RANKL-RANK-OPG.
Факторы, играющие важную роль в патогенезе ОП и его переломов: генетические, формирование низкого пика костной массы, потеря минеральной плотности кости, ассоциированная с возрастом и постменопаузой, нарушение архитектоники строения кости, особенности геометрии кости (бедра), травмы и падения, питание с низким содержанием кальция и витамина D, белка и др., низкая двигательная активность, вредные привычки (курение, алкоголь). При вторичном ОП к перечисленным факторам присоединяются факторы заболевания, отрицательного действия лекарственных препаратов (глюкокортикостероиды, иммунодепрессанты и др.), которые вызывают потерю костной массы и ОП.
Снижение костной массы при ОП, которое является основным фактором его патогенеза, рассматривается сегодня как следствие формирования неадекватно низкого пика костной массы в молодом возрасте и интенсивной потери кости, связанной с возрастом, в пожилом возрасте. Генетические факторы — главные детерминанты пика костной массы. Вклад генетических факторов составляет 60-80% в зависимости от методов исследования (близнецы, семьи). Различные гены рассматриваются в качестве кандидатов, участвующих в сложном процессе ремоделирования, формирования и эволюции костной массы, приводящих к ОП и переломам. Многочисленные комплексные исследования различных лабораторий мира направлены на поиск конкретных генов, изучение их полиморфизма, функции и взаимодействия в процессе костного ремоделирования и ОП.
Первичный остеопороз
Остеопороз, развивающийся в периоде постменопаузы, относится к классу первичных остеопорозов. Известно, что снижение секреции половых гормонов в период климактерия оказывает прямое и опосредованное влияние на состояние костного метаболизма. Снижение содержания эстрогенов приводит к нарушению кальциевого обмена, что сопровождается уменьшением минеральной плотности костной ткани. Кроме того, имеет место подавление активности остеобластов, что приводит к преобладанию резорбции над процессами формирования костной ткани. Постменопаузальный остеопороз составляет 85% общего количества первичного остеопороза.
Сенильный остеопороз — так называемый второй тип остеопороза, в патогенезе которого важную роль играет снижение всасываемости кальция в кишечнике, чему также способствует дефицит витамина D, вызванный уменьшением поступления его с пищей, замедлением образования его в коже из провитамина D. Наибольшее значение в патогенезе сенильного остеопороза имеет дефицит активных метаболитов витамина D вследствие снижения его синтеза в почках. При сенильном остеопорозе определённую роль играет развитие резистентности к витамину D — т.е. дефицит рецепторов 1,25(ОН)2D. Указанные факторы вызывают развитие транзиторной гипокальциемии, что приводит к усилению продукции паратиреоидного гормона. В результате вторичного гиперпаратиреоза усиливается резорбция костной ткани, в то время как костеообразование к старости снижено.
Вторичный ОП
Серьёзной медицинской проблемой является и вторичный ОП, возникающий при различных заболеваниях: ревматологических, эндокринологических, онкологических, обструктивных заболеваниях лёгких и бронхиальной астмы, заболеваниях почек, щитовидной железы, органов пищеварения, при иммобилизации и длительном приёме ряда медикаментов (кортикостероиды, иммунодепрессанты, антиконвульсанты, тиреоидные гормоны и др.).
Снижение МПКТ при вторичном ОП часто достигает критериальных величин ОП (-2,5 SD и более по Т-критерию) и даёт основание поставить диагноз.
У больных ревматоидным артритом (РА) в постменопаузе развитие ОП имело место в поясничном отделе позвоночника и шейке бедра у 36%, в предплечье у 40%, а у пациентов с сохранённым менструальным циклом — у 7 и 10% соответственно. Возраст больных и длительность менопаузы, наличие факторов риска, активность и длительность заболевания, степень функциональной недостаточности суставов, проводимая терапия (особенно назначение глюкокортикоидов — ГК) оказывают влияние на величину потери МПКТ и развитие остеопении. При обследовании больных с эндогенным гиперкортицизмом (синдром и болезнь Иценко-Кушинга) ОП обнаружен у 91%, переломы тел позвонков или рёбер — у 58%. ОП у больных бронхиальной астмой значительно утяжеляет течение основного заболевания, увеличивает стоимость лечения. По данным доктора И.А.Барановой, снижение МПКТ было выявлено у 42,8% больных бронхиальной астмой 20-49 лет, ранее не получавших гормональную терапию, и потеря МПКТ увеличивалась в 5 раз при среднетяжёлом течении (53,5%) по сравнению с легким (11%). У больных молодого и среднего возраста, принимавших ГК в средней дозе 10,20±5,99 мг/сут на протяжении 8-14 лет, снижение МПКТ обнаружено у 85%, у 13% зарегистрированы переломы скелета. В качестве причины развития ОП при РА, ряде воспалительных заболеваний, бронхиальной астме обсуждается непосредственное влияние самого заболевания на костную ткань, поскольку известно большое число общих цитокинов, принимающих участие в патогенезе хронического воспалительного процесса и костного ремоделирования, а также ГК, которые наиболее эффективны для базисной терапии при ряде системных заболеваний и в то же время занимающих ведущее место в индукции вторичного ОП. Изучение переломов при вторичном ОП остаётся актуальной задачей.
Стероидный остеопороз также относится к классу вторичных остеопорозов и вызывается патологическим повышением эндогенной продукции глюкокортикоидов надпочечниками или возникает при введении синтетических аналогов кортикостероидов, применяемых для лечения ревматологических, аллергических, гематологических, глазных болезней, заболеваний кожи, желудочно-кишечного тракта (ЖКТ), почек, печени. Стероидный остеопороз возникает при заболеваниях, характеризующихся повышенной секрецией кортикостероидов надпочечниками (Иценко-Кушинга).
Биохимические маркеры костного метаболизма
Их исследуют для оценки скорости протекания процессов костного ремоделирования и диагностики остеопороза с высоким или низким темпом костного обмена, разобщённости или дисбаланса его составляющих: костной резорбции и костеобразования. Разделение показателей на маркеры образования и резорбции кости является условным. Совместно они отражают итоговые изменения резорбции и костеобразования, направленные в ту или иную сторону.
Наиболее точными маркерами костного образования в настоящее время признают исследование содержания остеокальцина, коллагена 1 типа, остеопротегерина (OPG), Интерлейкина 17 в крови.
Исследование маркеров костного ремоделирования целесообразно для:
1. Динамической оценки костного метаболизма;
2. Прогноза потери костной массы (вторичная профилактика при выявленной остеопении);
3. Прогноза перелома костей;
4. Отбора пациентов для проведения терапии;
5. Быстрого мониторинга терапии.
Процесс костного ремоделирования регулируется многими системными гормонами, цитокинами, факторами роста, идентифицированы многие локальные факторы костного ремоделирования. При изучении ОП важна оценка параметров минерального кальций-фосфор-магниевого обмена (уровень общего и ионизированного кальция, фосфора, магния, меди, цинка, витаминов С и К), которые вовлечены в процесс костеобразования.
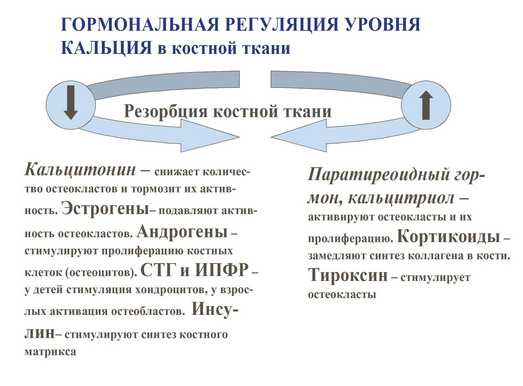
Гормональная регуляция уровня кальция в кости.
— паратиреоидный гормон – стимулирует резорбцию кости опосредованно воздействуя на остеокласты;
— кальцитонин – снижает количество остеокластов и тормозит их активность;
— эстрогены – подавляют активность остеокластов;
— андрогены – стимулируют пролиферацию остеоцитов и усиливают процессы костного синтеза;
— гормон роста и инсулинподобный фактор роста 1 (соматомедин-С) – активируют процесс синтеза кости за счёт стимуляции остеобластов;
— инсулин – стимулирует синтез костного матрикса;
— тироксин – стимулирует остеокласты, усиливая резорбцию костной ткани;
— кортикостероиды – замедляют синтез коллагена в костной ткани;
Из вышеперечисленного следует, что изучение уровня этих гормонов и маркеров костного ремоделирования на ранней стадии развития остеопении, особенно при вторичном ОП, позволит спрогнозировать и оценить вероятность дальнейшей резорбции костной ткани, провести профилактику ОП, назначить лечение.
Алгоритм лабораторной оценки костного ремоделирования.