Что такое нестабильные изотопы
Малюгина 10. Стабильные и нестабильные изотопы. Радиоактивность
Малюгина 10. Стабильные и нестабильные изотопы. Радиоактивность.
Все изотопы подразделяются на стабильные и нестабильные (радиоактивные).
Стабильные изотопы не подвергаются радиоактивному распаду, поэтому они и сохраняются в природных условиях.
Радиоактивные изотопы получены для всех химических элементов. Их известно около 1500. Элементы, состоящие только из радиоактивных изотопов, называются радиоактивными. Это элементы с Z = 43 (технеций), 61(прометий) и 84 – 107(полоний, астат, радон, франций, радий, актиний…). Относительные атомные массы нестабильных элементов указаны в периодической
системе химических элементов в квадратных скобках. По химическим свойствам радиоактивные изотопы почти не отличаются от стабильных. Поэтому, они служат в качестве “меченых” атомов, позволяющих по измерению их радиоактивности следить за поведением всех атомов данного элемента и за их передвижением. Радиоактивные изотопы широко применяются в научных исследованиях, в промышленности, сельском хозяйстве, медицине, биологии и химии. В настоящее время их получают в больших количествах.

Процессы, приводящие к образованию нового химического элемента, называются ядерными.
Вопросы для самоконтроля
1. На какие группы по устойчивости классифицируют изотопы?
2. Что такое радиоактивность?
3. На какие группы по происхождению делят радиоактивные изотопы?
4. Сколько науке известно радиоактивных изотопов?
5. Что такое «меченые» атомы?
6. Какие особенности имеют химические элементы, чьи атомные массы в периодической системе указаны в квадратных скобках?
7. Назовите нестабильные лантаноиды.
8. Назовите нестабильный элемент I группы главной подгруппы.
9. Какие процессы называют ядерными?
1. На стабильные и радиоактивные.
2. Самопроизвольное превращение неустойчивого изотопа одного химического элемента в изотоп другого элемента, при котором происходит испускание элементарных частиц.
3. На естественные и искусственные
5. Это изотопы одного элемента, которые заметно отличаются от других, каким-то свойством, которое позволяет их отследить среди других менее заметных изотопов. Таким свойством может служить их радиоактивность.
6. Это химические элементы, у которых все изотопы нестабильные (радиоактивные).
9. Процессы, приводящие к образованию нового химического элемента.
ИЗОТОПЫ
ИЗОТОПЫ – разновидности одного и того же химического элемента, близкие по своим физико-химическим свойствам, но имеющие разную атомную массу. Название «изотопы» было предложено в 1912 английским радиохимиком Фредериком Содди, который образовал его из двух греческих слов: isos – одинаковый и topos – место. Изотопы занимают одно и то же место в клетке периодической системы элементов Менделеева.
Атом любого химического элемента состоит из положительно заряженного ядра и окружающего его облака отрицательно заряженных электронов. Положение химического элемента в периодической системе Менделеева (его порядковый номер) определяется зарядом ядра его атомов. Изотопами называются поэтому разновидности одного и того же химического элемента, атомы которых имеют одинаковый заряд ядра (и, следовательно, практически одинаковые электронные оболочки), но отличаются значениями массы ядра. По образному выражению Ф.Содди, атомы изотопов одинаковы «снаружи», но различны «внутри».
В 1932 был открыт нейтрон – частица, не имеющая заряда, с массой, близкой к массе ядра атома водорода – протона, и создана протонно-нейтронная модель ядра. В результате в науке установилось окончательное современное определение понятия изотопов: изотопы – это вещества, ядра атомов которых состоят из одинакового числа протонов и отличаются лишь числом нейтронов в ядре. Каждый изотоп принято обозначать набором символов 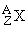
Из всех известных нам изотопов только изотопы водорода имеют собственные названия. Так, изотопы 2 H и 3 H носят названия дейтерия и трития и получили обозначения соответственно D и T (изотоп 1 H называют иногда протием).
В природе встречаются как стабильные изотопы, так и нестабильные – радиоактивные, ядра атомов которых подвержены самопроизвольному превращению в другие ядра с испусканием различных частиц (или процессам так называемого радиоактивного распада). Сейчас известно около 270 стабильных изотопов, причем стабильные изотопы встречаются только у элементов с атомным номером Z Ј 83. Число нестабильных изотопов превышает 2000, подавляющее большинство их получено искусственным путем в результате осуществления различных ядерных реакций. Число радиоактивных изотопов у многих элементов очень велико и может превышать два десятка. Число стабильных изотопов существенно меньше, Некоторые химические элементы состоят лишь из одного стабильного изотопа (бериллий, фтор, натрий, алюминий, фосфор, марганец, золото и ряд других элементов). Наибольшее число стабильных изотопов – 10 обнаружено у олова, у железа, например, их – 4, у ртути – 7.
Открытие изотопов, историческая справка.
В 1808 английский ученый натуралист Джон Дальтон впервые ввел определение химического элемента как вещества, состоящего из атомов одного вида. В 1869 химиком Д.И.Менделеевым была открыт периодический закон химических элементов. Одна из трудностей в обосновании понятия элемента как вещества, занимающего определенное место в клетке периодической системы, заключалась в наблюдаемой на опыте нецелочисленности атомных весов элементов. В 1866 английский физик и химик – сэр Вильям Крукс выдвинул гипотезу, что каждый природный химический элемент представляет собой некоторую смесь веществ, одинаковых по своим свойствам, но имеющих разные атомные масс, однако в то время такое предположение не имело еще экспериментального подтверждения и поэтому прошло мало замеченным.
Важным шагом на пути к открытию изотопов стало обнаружение явления радиоактивности и сформулированная Эрнстом Резерфордом и Фредериком Содди гипотеза радиоактивного распада: радиоактивность есть не что иное, как распад атома на заряженную частицу и атом другого элемента, по своим химическим свойствам отличающийся от исходного. В результате возникло представление о радиоактивных рядах или радиоактивных семействах, в начале которых есть первый материнский элемент, являющийся радиоактивным, и в конце – последний стабильный элемент. Анализ цепочек превращений показал, что в их ходе в одной клеточке периодической системы могут оказываться одни и те же радиоактивные элементы, отличающиеся лишь атомными массами. Фактически это и означало введение понятия изотопов.
Независимое подтверждение существования стабильных изотопов химических элементов было затем получено в экспериментах Дж. Дж. Томсона и Астона в 1912–1920 с пучками положительно заряженных частиц (или так называемых каналовых лучей), выходящих из разрядной трубки.
В 1919 Астон сконструировал прибор, названный масс-спектрографом (или масс-спектрометром). В качестве источника ионов по-прежнему использовалась разрядная трубка, однако Астон нашел способ, при котором последовательное отклонение пучка частиц в электрическом и магнитном полях приводило к фокусировке частиц с одинаковым значением отношения заряда к массе (независимо от их скорости) в одной и той же точке на экране. Наряду с Астоном масс-спектрометр несколько другой конструкции в те же годы был создан американцем Демпстером. В результате последующего использования и усовершенствования масс-спектрометров усилиями многих исследователей к 1935 году была составлена почти полная таблица изотопных составов всех известных к тому времени химических элементов.
Методы разделения изотопов.
Для изучения свойств изотопов и особенно для их применения в научных и прикладных целях требуется их получение в более или менее заметных количествах. В обычных масс-спектрометрах достигается практически полное разделение изотопов, однако количество их ничтожно мало. Поэтому усилия ученых и инженеров были направлены на поиски других возможных методов разделения изотопов. В первую очередь были освоены физико-химические методы разделения, основанные на различиях в таких свойствах изотопов одного итого же элемента, как скорости испарения, константы равновесия, скорости химических реакций и т.п. Наиболее эффективными среди них оказались методы ректификации и изотопного обмена, которые нашли широкое применение в промышленном производстве изотопов легких элементов: водорода, лития, бора, углерода, кислорода и азота.
Другую группу методов образуют так называемые молекулярно-кинетические методы: газовая диффузия, термодиффузия, масс-диффузия (диффузия в потоке пара), центрифугирование. Методы газовой диффузии, основанные на различной скорости диффузии изотопных компонентов в высокодисперсных пористых средах, были использованы в годы второй мировой войны при организации промышленного производства разделения изотопов урана в США в рамках так называемого Манхэттенского проекта по созданию атомной бомбы. Для получения необходимых количеств урана, обогащенного до 90% легким изотопом 235 U – главной «горючей» составляющей атомной бомбы, были построены заводы, занимавшие площади около четырех тысяч гектар. На создание атомного центра с заводами для получения обогащенного урана было ассигновано более 2-х млрд. долл. После войны в СССР были разработать и построены заводы по производству обогащенного урана для военных целей, также основанные на диффузионном методе разделения. В последние годы этот метод уступил место более эффективному и менее затратному методу центрифугирования. В этом методе эффект разделения изотопной смеси достигается за счет различного действия центробежных сил на компоненты изотопной смеси, заполняющей ротор центрифуги, который представляет собой тонкостенный и ограниченный сверху и снизу цилиндр, вращающийся с очень высокой скоростью в вакуумной камере. Сотни тысяч соединенных в каскады центрифуг, ротор каждой из которых совершает более тысячи оборотов в секунду, используются в настоящее время на современных разделительных производствах как в России, так и в других развитых странах мира. Центрифуги используются не только для получения обогащенного урана, необходимого для обеспечения работы ядерных реакторов атомных электростанций, но и для производства изотопов примерно тридцати химических элементов средней части периодической системы. Для разделения различных изотопов используются также установки электромагнитного разделения с мощными источниками ионов, в последние годы получили распространение также лазерные методы разделения.
Применение изотопов.
Разнообразные изотопы химических элементов находят широкое применение в научных исследованиях, в различных областях промышленности и сельского хозяйства, в ядерной энергетике, современной биологии и медицине, в исследованиях окружающей среды и других областях. В научных исследованиях (например, в химическом анализе) требуются, как правило, небольшие количества редких изотопов различных элементов, исчисляемые граммами и даже миллиграммами в год. Вместе с тем, для ряда изотопов, широко используемых в ядерной энергетике, медицине и других отраслях, потребность в их производстве может составлять многие килограммы и даже тонны. Так, в связи с использованием тяжелой воды D2O в ядерных реакторах ее общемировое производство к началу 1990-х прошлого века составляло около 5000 т в год. Входящий в состав тяжелой воды изотоп водорода дейтерий, концентрация которого в природной смеси водорода составляет всего 0,015%, наряду с тритием станет в будущем, по мнению ученых, основным компонентом топлива энергетических термоядерных реакторов, работающих на основе реакций ядерного синтеза. В этом случае потребность в производстве изотопов водорода окажется огромной.
В научных исследованиях стабильные и радиоактивные изотопы широко применяются в качестве изотопных индикаторов (меток) при изучении самых различных процессов, происходящих в природе.
В сельском хозяйстве изотопы («меченые» атомы) применяются, например, для изучения процессов фотосинтеза, усвояемости удобрений и для определения эффективности использования растениями азота, фосфора, калия, микроэлементов и др. веществ.
Разница между стабильными и нестабильными изотопами
Содержание:
Ключевые области покрыты
1. Что такое стабильные изотопы
— определение, свойства, применение
2. Что такое нестабильные изотопы
— определение, свойства, применение
3. В чем разница между стабильными и нестабильными изотопами
— Сравнение основных различий
Ключевые слова: альфа-распад, пояс стабильности, электроны, гелий, изотопы, магические числа, нейтроны, протоны, радиоактивность, уран
Что такое стабильные изотопы
Феномен «Магические числа»- это концепция в химии, которая описывает атомные числа наиболее стабильных изотопов. Магическое число может быть числом протонов или нейтронов. Если конкретный элемент имеет магическое число протонов или нейтронов, они являются стабильными изотопами.
Магические числа: 2, 8, 20, 28, 50, 82
Нейтроны: 126, 184 магические числа.
Рисунок 1: График количества нейтронов в зависимости от количества протонов. Цветная область называется поясом стабильности.
Хотя стабильные изотопы не являются радиоактивными, они имеют много применений. Например, водородный элемент имеет три основных изотопа. Это протий, дейтерий и тритий. Протий является наиболее стабильным и наиболее распространенным изотопом среди них. Тритий является наиболее нестабильным изотопом. Дейтерий также стабилен, но в природе его не так много. Тем не менее, Protium является изотопом, встречающимся почти везде. Дейтерий можно использовать в виде тяжелой воды для лабораторных применений.
Некоторые элементы имеют только один стабильный изотоп. Эти элементы называются моноизотопный, Существует 26 известных моноизотопных элементов. Другие элементы имеют более одного стабильного изотопа. Например, Tin (Sn) имеет 10 стабильных изотопов.
Что такое нестабильные изотопы
Нестабильный элемент может быть нестабильным по нескольким причинам. Наличие большого количества нейтронов по сравнению с числом протонов является одной из таких причин. В этом типе изотопов радиоактивный распад происходит, чтобы получить устойчивое состояние. Здесь нейтроны превращаются в протоны и электроны. Это может быть дано как ниже.
Некоторые изотопы нестабильны из-за присутствия большого количества протонов. Здесь протон может быть преобразован в нейтрон и позитрон. Позитрон похож на электрон, но электрический заряд равен +1.
Вот 0 1е указывает на позитрон.
Иногда может быть слишком много протонов и слишком много электронов. Это указывает на то, что атомная масса очень высока. Затем два протона и два нейтрона испускаются в виде атома гелия. Это называется альфа-распадом.
Рисунок 2: Альфа-распад радия-226
Радиоактивные элементы имеют много применений в исследовательской работе. Например, их можно использовать для определения возраста окаменелостей, анализа ДНК или в медицинских целях и т. Д.
В нестабильных изотопах радиоактивный распад может быть измерен по их периоду полураспада. Период полураспада вещества определяется как время, которое требуется этому веществу, чтобы стать половиной его первоначальной массы из-за распада.
Разница между стабильными и нестабильными изотопами
Определение
радиоактивность
Стабильные изотопы: Стабильные изотопы не показывают радиоактивность.
Нестабильные изотопы: Нестабильные изотопы показывают радиоактивность.
Волшебные числа
Стабильные изотопы: Магические числа показывают количество протонов или количество нейтронов, присутствующих в наиболее стабильных изотопах.
Нестабильные изотопы: Магические числа не указывают числа протонов или электронов в нестабильных изотопах.
Приложения
Стабильные изотопы: Стабильные изотопы используются для применений, где радиоактивность не должна присутствовать.
Нестабильные изотопы: Нестабильные изотопы используются в приложениях, где радиоактивность важна, таких как анализ ДНК.
Период полураспада
Стабильные изотопы: Период полураспада стабильного изотопа очень длинный или вообще не имеет периода полураспада.
Нестабильные изотопы: Период полураспада нестабильного изотопа короткий и может быть легко вычислен.
Заключение
Рекомендации:
Явление изотопии. Иммунобиологическая реактивность животных при действии ионизирующего излучения
| Рубрика | Биология и естествознание |
| Вид | контрольная работа |
| Язык | русский |
| Дата добавления | 09.07.2011 |
| Размер файла | 269,6 K |
Отправить свою хорошую работу в базу знаний просто. Используйте форму, расположенную ниже
Студенты, аспиранты, молодые ученые, использующие базу знаний в своей учебе и работе, будут вам очень благодарны.
Размещено на http://www.allbest.ru/
1. Явление изотопии. Стабильные и нестабильные изотопы
Атом любого химического элемента состоит из положительно заряженного ядра и окружающего его облака отрицательно заряженных электронов. Положение химического элемента в периодической системе Менделеева (его порядковый номер) определяется зарядом ядра его атомов. Изотопами называются поэтому разновидности одного и того же химического элемента, атомы которых имеют одинаковый заряд ядра (и, следовательно, практически одинаковые электронные оболочки), но отличаются значениями массы ядра. По образному выражению Ф.Содди, атомы изотопов одинаковы «снаружи», но различны «внутри».
Из всех известных нам изотопов только изотопы водорода имеют собственные названия. Так, изотопы 2 H и 3 H носят названия дейтерия и трития и получили обозначения соответственно D и T (изотоп 1 H называют иногда протием).
В 1919 Астон сконструировал прибор, названный масс-спектрографом (или масс-спектрометром). В качестве источника ионов по-прежнему использовалась разрядная трубка, однако Астон нашел способ, при котором последовательное отклонение пучка частиц в электрическом и магнитном полях приводило к фокусировке частиц с одинаковым значением отношения заряда к массе (независимо от их скорости) в одной и той же точке на экране. Наряду с Астоном масс-спектрометр несколько другой конструкции в те же годы был создан американцем Демпстером. В результате последующего использования и усовершенствования масс-спектрометров усилиями многих исследователей к 1935 году была составлена почти полная таблица изотопных составов всех известных к тому времени химических элементов.
2. Прогнозирование загрязнения сельскохозяйственнОЙ продукции радионуклидами
Прогноз загрязнения сельскохозяйственной продукции позволяет планировать размещение культур по полям севооборотов с учетом использования получаемой продукции (продовольственные цели, фураж, промышленная переработка и т. д.).
Прогнозирование основывается на коэффициентах перехода радионуклидов в урожай различных культур, результатах радиологического и агрохимического обследования почв в виде карт и агрохимических паспортов полей. Особенно важен прогноз использования пастбищ для дойного стада на почвах, загрязненных стронцием-90 (рис. 1).
Рис. 1. Прогноз возможности получения продукции животноводства с допустимым содержанием стронция-90 в зависимости от плотности загрязнения почв
Прогноз содержания радионуклидов в сельскохозяйственных культурах с учетом особенностей каждого поля и животноводческой фермы сделан для хозяйств одиннадцати наиболее загрязненных районов.
На этой основе подготовлены проекты защитных мер, предусматривающие снижение поступления радионуклидов в пищевую продукцию в 1,8-2,0 раза.
Анализ проектов показал, что производство кормов в зоне загрязнения для дойного стада и получение цельного молока с допустимым содержанием радионуклидов возможно на 86,6 % пахотных земель, 75,4 % улучшенных сенокосов и пастбищ и 36,3 % естественных луговых угодий. На остальной площади сельскохозяйственных угодий в настоящее время возможно производить корма только для производства мяса и получения молока-сырья. Это еще раз подчеркивает ведущую роль окультуренности почв в снижении накопления радионуклидов в продукции.
В случаях, когда скот выпасается на естественных кормовых угодьях, когда невозможно получение молока и мяса с допустимым содержанием цезия-137 из-за высокого содержания в корме, весьма эффективным является введение в рацион животных цезийсвязывающих препаратов на основе берлинской лазури.
Например, применение ферроцианидов совместно с комбикормом в течение 40 суток в дозах от 1,0 до 6,0 г на голову при содержании радиоцезия в суточном рационе 37 кБк позволяет в 4,5-6,8 раз снизить концентрацию радионуклида в мышечной ткани животных при откорме на мясо. Результаты эксперимента показали также высокую эффективность ферроцина в составе соли-лизунца для снижения поступления радиоцезия из корма в молоко (рис. 2).
Рис. 2. Содержание цезия-137 в молоке в результате применения брикетов соли-лизунца с ферроцином, Бк/л
Например, ферроциновые препараты, предназначенные в основном для крупного рогатого скота в частном секторе, где для выпаса скота чаще используются естественные кормовые угодья, позволяют снизить содержание радиоцезия в молоке в 2-5 раз.
3. Иммунобиологическая реактивность животных при действии ионизирующего излучения
изотоп радионуклид загрязнение сельскохозяйственный
Ионизирующее излучение действует на организм как из внешних, так и из внутренних источников облучения. В последнем случае радиоактивные вещества поступают в организм с пищей, водой, через кожные покровы. Возможно комбинированное действие внешнего и внутреннего облучения.
Повреждающее действие различных видов ионизирующей радиации зависит от их проникающей активности и, следовательно, от плотности ионизации в тканях. Чем короче путь прохождения луча, тем больше плотность ионизации и сильнее повреждающее действие.
Процессы взаимодействия ионизирующего излучения с веществом в живых организмах приводят к специфическому биологическому действию, завершающемуся повреждением организма. В процессе этого повреждающего действия условно можно выделить три этапа:
— первичное действие ионизирующего излучения;
— влияние радиации на клетки;
— действие радиации на целый организм.
Первичные процессы ионизации не вызывают больших нарушений в живых тканях. Повреждающее действие излучения связано, по-видимому, со вторичными реакциями, при которых происходит разрыв связей внутри сложных органических молекул, например SH-групп в белках, хромофорных групп азотистых оснований в ДНК, ненасыщенных связей в липидах и пр.
Влияние ионизирующего излучения на клетки обусловлено взаимодействием свободных радикалов с молекулами белков, нуклеиновых кислот и липидов, когда вследствие всех этих процессов образуются органические перекиси и возникают быстропреходящие реакции окисления. В результате перекисного Окисления накапливается множество измененных молекул, в результате чего начальный радиационный эффект многократно усиливается. Все это отражается прежде всего на структуре биологических мембран, меняются их сорбционные свойства и повышается проницаемость (в том числе мембран лизосом и митохондрий). Изменения в мембранах лизосом приводят к освобождению и активации ДНК-азы, РНК-азы, катепсинов, фосфатазы, ферментов гидролиза мукополисахаридов и ряда других ферментов.
Высвобождающиеся гидролитические ферменты могут путем простой диффузии достичь любой органеллы клетки, в которую они легко проникают благодаря повышению проницаемости мембран. Под действием этих ферментов происходит дальнейший распад макромолекулярных компонентов клетки, в том числе нуклеиновых кислот, белков. Разобщение окислительного фосфорилирования в результате выхода ряда ферментов из митохондрий в свою очередь приводит к угнетению синтеза АТФ, а отсюда и к нарушению биосинтеза белков.
Ионизирующее излучение действует на клетки тем сильнее, чем они моложе и чем менее дифференцированны. На основании морфологических признаков поражаемое органы и ткани распределяются в следующем нисходящем порядке: лимфоидные органы (лимфатические узлы, селезенка, зобная железа, лимфоидная ткань других органов), костный мозг, семенники, яичники, слизистая оболочка желудочно-кишечного тракта. Еще меньше поражаются кожа с придатками, хрящи, кости, эндотелий сосудов. Высокой радиоустойчивостью обладают паренхиматозные органы: печень, надпочечники, почки, слюнные железы, легкие.
Повреждающее действие ионизирующего излучения на клетки при достаточно высоких дозах завершается гибелью. Гибель клетки в основном является результатом подавления митотической активности и необратимого нарушения хромосомного аппарата клетки, но возможна и интерфазная гибель (вне периода митоза) из-за нарушения метаболизма клетки и интоксикации упомянутыми выше радиотоксинами. В результате происходит опустошение тканей из-за того, что не восполняется естественная убыль клеток за счет образования новых.
Размещено на Allbest.ru
Подобные документы
Реагирование организма на изменения жизнедеятельности под воздействием различных факторов окружающей среды. Факторы, характеризующие реактивность. Классификация реактивности. Устойчивость организма против различных внешних болезнетворных воздействий.
реферат [35,6 K], добавлен 10.05.2012
Сущность явления радиолиза и основные стадии его протекания: физическая, физико-химическая и химическая. Влияние свободных радикалов на живые организмы: их ДНК, легкие, жиры, сердечнососудистую систему. Значение данных соединений в развитии диабета.
реферат [31,3 K], добавлен 10.12.2015
Проведение исследований с целью изучения влияния ионизирующего излучения на биологические ткани. Виды радиобиологических повреждений у млекопитающих. Основные источники облучения населения и его последствия. Градация доз радиации, ее воздействие на биоту.
презентация [7,7 M], добавлен 10.02.2014
Понятие, сущность и назначение дозиметрии, а также описание ее основных методов (биологических, физических, химических, ионизационных и люминесцентных). Особенности регистрации радиационно-индуцированных эффектов в детекторе ионизирующего излучения.
реферат [149,5 K], добавлен 30.11.2010
Уровни включения стабильных изотопов дейтерия. Молекулы секретируемых аминокислот L-фенилаланинпродуцирующего штамма Brevibacterium methylicum и L-лейцинпродуцирующего штамма Methylobacillus flagellatum. Аминокислотные остатки суммарных белков.
статья [1,7 M], добавлен 23.10.2006
Понятие, отличительные особенности ионизирующего излучения, оценка негативного воздействия на живые организмы. Теории действия радиации: «мишени» и стохастическая, свободных радикалов. Структурно-метаболическая теория радиационного поражения А.М. Кузина.
презентация [1,8 M], добавлен 17.12.2014
реферат [917,1 K], добавлен 12.02.2015