Что такое обструкция мочевых путей
Обструктивная уропатия – когда нужно срочно обращаться к врачу
Обструктивная уропатия – состояние, при котором закупорка препятствует прохождению мочи по мочевыводящему каналу. Возникает в любом участке системы – от почек, где моча образуется, до канала, через который она покидает организм. Состояние повышает давление в мочевыделительном канале и угрожает осложнениями, если вовремя не будет диагностировано.
Причины
Причины развития обструктивной уропатии и рефлюкс-уропатии отличаются в разных возрастных группах:
Обструктивная уропатия у мужчин встречается чаще, у женщин же она часто встречается во время беременности. Это связано с давлением плода и матки на мочевыводящий канал.
Дополнительно причинами заболевания становятся:
Новообразования в простате у мужчин и в матке у женщин способны сужать просвет мочеточника, потому врач проводит дифференциальную диагностику с определением сопутствующих заболеваний и первопричин.
Непроходимость мочевыводящих путей – симптомы
Признаки уропатии зависят от локализации, продолжительности состояния. Пациентов беспокоят такие симптомы:
Если непроходимость возникает быстро, она причиняет боль и описанные состояния. При медленно прогрессирующей уропатии болезненность не отмечается на первых стадиях. В этом случае заболевание угрожает гидронефрозом.
Нарушение оттока мочи – повод немедленно обратиться к урологу! Патология может развиваться критически быстро, но своевременная диагностика и лечение предотвратят острые состояния и осложнения.
Диагностика
Для обнаружения обструктивной уропатии у мужчин и женщин назначаются лабораторные и инструментальные обследования:
В клинике урологии имени Р. М. Фронштейна Первого Московского Государственного Медицинского Университета имени И.М. Сеченова можно пройти диагностику и получить консультацию опытного уролога. Современные диагностические аппараты, врачи высшей категории помогут справиться с заболеванием на любой стадии в короткие сроки. Не откладывайте визит к врачу, позаботьтесь о здоровье сегодня!
Выбор оптимального метода дренирования верхних мочевых путей при остром обструктивном пиелонефрите
Иванов В.Ю., Малхасян В.А., Семенякин И.В., Гаджиев Н.К., Тедеев А.В., Пушкарь Д.Ю.
МАТЕРИАЛЫ И МЕТОДЫ
Изначально мы планировали выполнение рандомизированного исследования. Основываясь на данных о пациентах с острым обструктивным пиелонефритом, пролеченных в нашей клинике в предшествующий нашему исследованию период времени, нами была определена численность пациентов в каждой из групп в 100 пациентов. Однако авторы не пришли к консенсусу касательно этического вопроса, касающегося возможности проведения слепой рандомизации при угрожающих жизни состояниях. Поэтому решено было оставить запланированное количество пациентов в каждой группе, но изменить дизайн стратификации пациентов по группам.
Согласно дизайну исследования метод дренирования ВМП у каждого пациента определялся оперирующим хирургом в зависимости от тяжести состояния больного, степени расширения полостной системы почки и личного мнения хирурга. Из исследования исключались пациентки на разных сроках беременности и пациенты с не корригированной на момент включения в исследование коагулопатией. При поступлении пациенты информировались о недостатках и преимуществах существующих методов дренирования верхних мочевых путей, после чего пациентов просили заполнить специально разработанный опросник.
Дренирование верхних мочевых путей внутренним мочеточниковым стентом выполнялось по стандартной методике. Пункция полостной системы почки при выполнении чрескожной пункционной нефростомии проводилась под ультразвуковым контролем, дренирование осуществлялось «Pigtaib- дренажем по методу Сельдингера под рентгенологическим контролем. Большинство операций было выполнено двумя хирургами, владеющими техникой выполнения эндоурологических вмешательств на экспертном уровне, незначительное число вмешательств было выполнено дежурными врачами-урологами общей специализации.
Для изучения факторов, влияющих на принятие решения о методе дренирования, нами были включены в анализ следующие параметры: пол, возраст пациентов, степень расширения полостной системы почки, температура тела пациента и количество лейкоцитов в периферической крови на момент поступления. Для анализа эффективности лечебных мероприятий и осложнений анализировались следующие критерии: продолжительность госпитализации, уровень снижения лейкоцитов в периферической крови, уровень снижения гемоглобина в периферической крови, необходимость гемотрансфузии, необходимость повторного дренирования, субъективная оценка хирургом сложности выполненного вмешательства. Пациентов, у которых дренирование мочевых путей выполнялось под местной анестезией, после операции просили оценить степень дискомфорта, возникшего во время манипуляции, используя визуальную аналоговую шкалу от ноля до десяти баллов, где 0 баллов оценивается как отсутствие какого либо дискомфорта, 5 баллов означает умеренный (терпимый) дискомфорт, а 10 баллов означает выраженный дискомфорт или выраженные болевые ощущения.
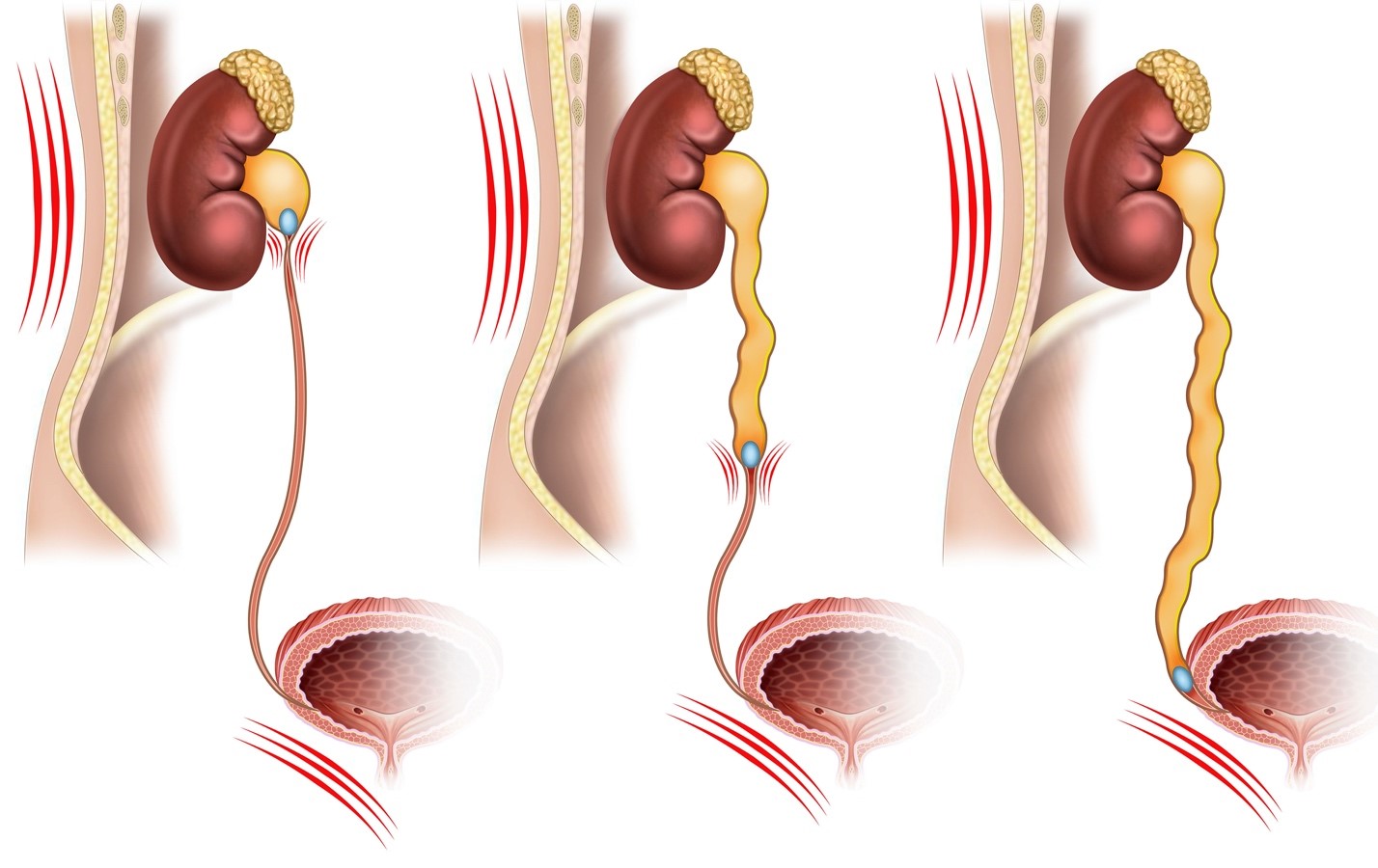
Обструкция мочеточников
Обструкция мочеточников – это препятствие нормальному току мочи по мочеточникам от почек до мочевого пузыря. Обструкция мочеточников может быть устранена с помощью лечения, однако без лечения тяжесть состояния может быстро нарастать, и умеренные проявления (боль, лихорадка, инфекции) сменятся тяжелыми (почечная недостаточность, сепсис), возможен летальный исход.
Работа мочевыделительной системы заключается в выведении продуктов обмена и избытка жидкости из организма. Нормальная мочевая система состоит из двух почек и двух трубок (мочеточников), соединяющих каждую почку с мочевым пузырем, и еще одной трубки (мочеиспускательного канала), по которой моча выводится из мочевого пузыря во внешнюю среду. Обструкция мочеточника – это препятствие току мочи на каком-либо уровне.
Некоторые состояния, в том числе врожденные пороки развития мочеполового аппарата, склонность к образованию камней в почках или недавнее вмешательство по поводу онкологического заболевания, повышают риск развития обструкции мочеточника.
Пороки развития мочеполового аппарата:
Внутренняя или внешняя обструкция мочеточника.
Часто врачи могут диагностировать обструкцию мочеточника еще до рождения во время рутинного УЗИ плода, которое может показать детали развивающегося плода, в том числе нарушения развития почек, мочеточников и мочевого пузыря. Обычно выполняют еще одно УЗИ после рождения, чтобы повторно осмотреть почки.
Если врач подозревает обструкцию мочеточника, вам может быть назначен ряд обследований, например:
Целью лечения обструкции мочеточника является ее устранение, если это возможно, или создание обходного пути тока мочи, что позволяет избежать развития необратимого повреждения почек. Из-за особенностей строения мочевой системы вам может понадобиться несколько видов лечения лечения.
Восстановление тока мочи
Если обструкция мочеточника вызывает сильную боль, может потребоваться немедленное хирургическое вмешательство для удаления мочи из организма и временного облегчения состояния. Ваш врач (уролог) может рекомендовать:
Эндоскопическая хирургия
Эндоскопическое вмешательство является минимально инвазивным. Через уретру в мочевой пузырь и другие отделы мочевых путей вводится специальный оптический инструмент – эндоскоп. Хирург делает разрез в пораженной области мочеточника и вводит полую трубку (стент), который поддерживает проходимость мочеточника. Эндоскопические вмешательства могут иметь диагностический и лечебный характер.
Другие виды хирургических вмешательств
Хирургические процедуры для коррекции обструкции мочеточника включают в себя:
Эти хирургические вмешательства могут быть выполнены из различных доступов:
Основные различия между этими подходами – время восстановления после операции и количество и размеры разрезов, используемых хирургами. Ваш врач (уролог) определит, какой вид оперативного вмешательства будет оптимальным для вас.
Медикаментозное лечение
Обструкция мочеточника осложняться инфекцией мочевых путей, которая требует лечения.
После хирургического вмешательства врач может назначить вам однократное применение антибиотика. Более длинный курс антибактериальной терапии требуется, если обструкция мочеточника осложнялась инфекцией мочевых путей. Антибиотики могут быть рекомендованы к применению, после удаления стента или катетера при чрескожной нефростомии.
Если стояние стента сопровождается болью в животе, врач может назначит препараты из группы альфа-адреноблокаторов для устранения этого побочного эффекта.
Инфекция мочевых путей и ее лечение в возрастном аспекте
Рассмотрены виды инфекций мочевых путей, эпидемиология заболевания, факторы риска, этиология, патогенез. Описаны клиническая картина острого и хронического пиелонефрита. Приведены подходы к лечению инфекций мочевых путей у различных групп пациентов, включ
Are examined the forms of the infections of urinary tracts, epidemiology of disease, factors of risk, etiology, pathogenesis. Are described the clinical picture of acute and chronic pyelonephritis. Approaches to the treatment of the infections of urinary tracts in the different groups of patients are given, including children and pregnant women.
Термином «инфекция мочевых путей» (ИМП) обозначают воспалительный процесс, локализующийся в различных отделах мочевыделительной системы. Выделяют инфекцию нижних (цистит, уретрит) и верхних мочевых путей (пиелонефрит, абсцесс и карбункул почки, апостематозный пиелонефрит). Пиелонефрит — инфекционно-воспалительный процесс, протекающий преимущественно в чашечно-лоханочной системе и интерстиции почки.
В структуре инфекционной заболеваемости ИМП занимает второе место, уступая лишь респираторным инфекциям, в то время как собственно пиелонефрит встречается во много раз реже. В структуре внутрибольничных инфекций доля ИМП может достигать 40%.
По возникновению выделяют внебольничные (возникающие в амбулаторных условиях) и нозокомиальные (развивающиеся после 48 ч пребывания пациента в стационаре) ИМП. В США на долю ИМП приходится более 7 млн визитов к врачу в год, из которых более 2 млн связаны с циститом, в то время как собственно пиелонефрит является причиной более 100 000 госпитализаций в год [14]. Около 15% всех амбулаторно назначаемых в США антибиотиков, общей стоимостью более 1 млрд долларов, выписываются по поводу ИМП [20]. Не менее 40% всех нозокомиальных инфекций обусловлены ИМП, вызванной в большинстве случаев катетеризацией мочевого пузыря [15, 20, 22].
По характеру течения ИМП делятся на неосложненную и осложненную. Неосложненная ИМП развивается, как правило, у людей без обструктивных уропатий и структурных изменений в почках и мочевыводящих путях. Осложненные инфекции возникают у больных с обструктивными уропатиями, мочекаменной болезнью, поликистозом почек, доброкачественной гиперплазией предстательной железы (ДГПЖ), на фоне катетеризации мочевого пузыря и/или при инструментальных (инвазивных) методах исследования, а также у больных с сопутствующими заболеваниями, такими как сахарный диабет, подагра, другие метаболические нарушения. У мужчин любые ИМП обычно трактуются как осложненные.
Пиелонефрит и ИМП — не равнозначные понятия, хотя клинически установить уровень, на котором протекает воспалительный процесс, особенно в амбулаторных условиях, бывает чрезвычайно сложно. Поэтому зачастую во многих странах предпочитают избегать топической диагностики, говоря о неосложненной, осложненной и рецидивирующей ИМП.
Эпидемиология. Распространенность ИМП зависит от возраста и пола (табл.). Если в первые 3 месяца жизни мальчики болеют в полтора раза чаще девочек, то в последующие месяцы эти показатели уравниваются, а к концу 1 года жизни частота ИМП среди девочек уже в 3–4 раза выше, чем у мальчиков. После первого года жизни встречаемость ИМП у девочек в десять и более раз превышает таковую у мальчиков. В целом распространенность ИМП в детской популяции составляет 20–22 случая на 1000 детей. Известно, что у 8% девочек и 2% мальчиков до семилетнего возраста отмечается хотя бы один эпизод ИМП, а в период от 0 до 2 месяцев жизни около 5% случаев фебрильной лихорадки обусловлены развитием острого пиелонефрита. В дальнейшем примерно у 30% детей с ИМП в течение первого года жизни отмечается ее рецидив. ИМП является самой частой причиной лихорадки неясного генеза у мальчиков до трех лет [2, 6, 10, 24]. Весомая доля случаев ИМП в детском возрасте, особенно у мальчиков, развивается на фоне различных морфофункциональных нарушений органов мочевой системы, поэтому мальчикам после одного эпизода, а девочкам после двух эпизодов ИМП показано полное нефроурологическое обследование.
Среди взрослой популяции женщины в 30–50 раз чаще, чем мужчины, страдают от ИМП, а в течение жизни до 60% женщин сталкиваются с эпизодом ИМП. У каждой четвертой пациентки этой возрастной группы в течение года ИМП рецидивирует [18]. В пожилом и старческом возрасте частота ИМП у женщин и мужчин постепенно сравнивается, что обусловлено развивающейся практически в 100% ДГПЖ, нарушающей уродинамику. В целом ИМП, включая пиелонефрит, регистрируется существенно чаще у женщин, чем у мужчин. И если острый пиелонефрит зачастую возникает у людей без почечного анамнеза, то развитию хронического процесса способствует наличие обструкции мочевых путей, аномалий и нарушения структуры почечной ткани. Предрасполагают к развитию пиелонефрита повторные эпизоды инфекции в нижележащих отделах мочевой системы, состояния, влияющие на иммунитет.
Факторы риска ИМП
Этиология. Неосложненные ИМП более чем в 95% случаев вызываются грамотрицательными микроорганизмами из семейства Enterobacteriacеae, причем основным возбудителем является Escherichia coli, названная в честь австрийского педиатра Теодора Эшериха (Theodor Escherich). E. сoli, постоянный обитатель толстого отдела кишечника человека и животных, вызывает неосложненную ИМП в 80–90% случаев. Значительно реже при неосложненной ИМП выделяют Staphylococcus saprophyticus (3–5%), Klebsiella spp., Proteus mirabilis и др.
Со стороны макроорганизма имеется ряд факторов, препятствующих инфицированию мочевых путей. К ним относятся:
Патогенез. Попадание микробов в мочевую систему возможно гематогенным и лимфогенным путем, однако чаще всего ИМП развивается при восходящем распространении из уретры бактерий кишечной группы.
У девочек и женщин важную роль в инфицировании мочевых путей играют особенности строения наружных половых органов и уретры. Близость наружного отверстия мочеиспускательного канала к анальному отверстию и влагалищу объясняет практически 100% микробное обсеменение дистальных отделов уретры, а малая длина и относительно большой диаметр допускают проникновение инфекции в мочевой пузырь. В связи с этим особое значение для девочек раннего возраста имеет правильность гигиенического ухода в период пеленания и прививание соответствующих гигиенических навыков.
Гематогенное инфицирование почек обычно происходит на фоне системных инфекций, протекающих с бактериемией. В этих случаях, как правило, развивается острый гнойный пиелонефрит, тяжело протекающий и сопровождающийся высокой лихорадкой, лейкоцитозом и явлениями общей интоксикации.
Острый пиелонефрит. Собственно острый пиелонефрит, обычно развивающийся на фоне препятствий оттоку мочи, или после диагностических манипуляций на мочевых путях, или на фоне системных инфекций, протекает типично, начинаясь в 80% случаев с потрясающего озноба, повышения температуры нередко до 39–40 °С, интенсивных болей в пояснице, симптомов общей интоксикации — слабости, разбитости, болей в суставах и мышцах. Больные жалуются на расстройства мочеиспускания — дизурию, поллакиурию и т. д., обезвожены, наблюдается умеренное вздутие живота, повышение тонуса поясничных мышц, вынужденное сгибание и приведение ноги к туловищу на стороне поражения. Симптом поколачивания положительный. У 10% больных с острым обструктивным пиелонефритом возникает бактериемический шок с падением АД, снижением адекватной перфузии почек и развитием острой почечной недостаточности. Необструктивный пиелонефрит протекает с менее выраженной клинической симптоматикой и нередко дебютирует явлениями цистита.
У детей младшего возраста острый пиелонефрит протекает с выраженным преобладанием симптомов общей интоксикации, что может явиться причиной диагностических ошибок. В старшем детском возрасте картина острого пиелонефрита сходна с таковой у взрослых.
Как и бактериемический шок, гнойные осложнения пиелонефрита чаще регистрируются у пожилых людей со сниженным иммунитетом. Другой клинической особенностью течения острого пиелонефрита у пожилых является преобладание общих симптомов — нарушения ментальности, развитие летаргии, снижение социальной активности, в то время как местные проявления выражены слабо, возможно, вследствие сниженного восприятия симптомов. Стертость клинической симптоматики в такой ситуации приводит к несвоевременной установке диагноза, запоздалому лечению, ухудшает прогноз.
Механизмы хронизации острого пиелонефрита во многом остаются неясными, но в первую очередь этому способствуют анатомические изменения мочевой системы (врожденные и приобретенные), сохраняющаяся обструкция, состояние макроорганизма, особенности возбудителя, адекватность терапии и т. д.
Хронический пиелонефрит. Клиническая картина хронического пиелонефрита обусловлена распространенностью воспалительного и склеротического процессов в почках, выраженностью воспаления, функциональным состоянием почек, сопутствующими заболеваниями. Основным морфологическим признаком хронического пиелонефрита, отличающим его от других тубулоинтерстициальных изменений, является обязательное вовлечение в процесс чашечно-лоханочной системы.
Вне обострения хронический пиелонефрит протекает с весьма скудной симптоматикой, с жалобами на утомляемость, снижение работоспособности и т. д., которые обычно не ассоциируются с конкретным заболеванием. Целенаправленный расспрос больных выявляет такие симптомы, как боли в поясничной области, эпизоды немотивированного субфебрилитета, познабливания, расстройства мочеотделения (полиурия, никтурия). Нередко единственным проявлением хронического пиелонефрита является изолированный мочевой синдром (лейкоцитурия, бактериурия, протеинурия, обычно не более 1 г/сут) или сочетание мочевого синдрома с анемией (в отсутствие почечной недостаточности), артериальной гипертензией.
Для подтверждения диагноза хронического пиелонефрита особую роль играет внутривенная урография, выявляющая снижение тонуса верхних мочевых путей, деформацию чашечек, пиелоэктазии. Компьютерная томография позволяет составить впечатление о массе и плотности паренхимы почек, состоянии лоханок, сосудистой ножки, паранефральной клетчатки. С помощью ультразвуковых методов уточняются размеры органа, можно обнаружить рентгеннегативные камни (уратные, цистиновые), внутрипаренхиматозные кисты.
Наиболее весомым диагностическим признаком хронического пиелонефрита является различие в величине и функции почек, подтверждаемое данными радиоизотопного исследования (ренография, динамическая сцинтиграфия).
Диагноз хронического пиелонефрита основывается главным образом на обнаружении этих различий.
В отсутствие визуализационных различий дифференциальный диагноз между собственно пиелонефритом и ИМП без специальных методов обследования представляет трудную задачу, что ведет к гипердиагностике пиелонефрита, «списыванию» на пиелонефрит других нозологических форм, подвергая больных риску длительного необоснованного лечения.
Бессимптомная бактериурия. Бессимптомная бактериурия (ББ) — бактериологический диагноз, который устанавливается при исследовании мочи, собранной с максимальным соблюдением стерильности и доставленной в лабораторию в предельно короткие сроки. По определению Американского общества инфекционных болезней (Infectious Diseases Society of America, IDSA), ББ — это изолированная бактериурия в образце мочи, полученном в условиях, исключающих контаминацию, и при отсутствии симптомов мочевой инфекции [21]. Диагноз ББ может быть установлен:
У женщин при ББ наиболее часто выделяется E. coli, тогда как для мужчин наиболее характерно выделение P. mirabilis, коагулазонегативных стафилококков и Enterococcus spp. [21]. Штаммы кишечной палочки, высеваемые при ББ у женщин, характеризуются меньшей вирулентностью, чем штаммы E. coli, выделенные от пациенток, страдающих клинически выраженными ИМП.
ИМП и беременность. Беременность является фактором риска развития как осложненной, так и неосложненной ИМП, которая у беременных нередко проявляется в виде ББ. Частота ББ у беременных составляет около 6%, острый цистит и острый пиелонефрит встречаются несколько реже — в 1–2,5% случаев, однако у 20–40% беременных с ББ во II и III триместрах развивается острый пиелонефрит [12, 25], а примерно у 1/3 пациенток, страдающих хроническим пиелонефритом, во время беременности отмечается обострение существующего до беременности заболевания [16].
Лечение ИМП. Как и при других бактериальных инфекциях, чувствительность возбудителей к антибиотикам имеет решающее значение при выборе препарата для эмпирической терапии ИМП. При этом структура возбудителей, вызывающих неосложненную ИМП, достаточно предсказуема, поскольку в 75–90% инфекцию вызывает E. coli. Антибиотикорезистентность, долгое время считавшаяся проблемой при лечении внутрибольничных и осложненных ИМП, в настоящее время становится актуальной и при лечении неосложненной ИМП.
В России в последние годы отмечается высокая частота устойчивости внебольничных штаммов E. coli к ампициллину (неосложненные инфекции — 37%, осложненные — 46%) и ко-тримоксазолу (неосложненные инфекции — 21%, осложненные — 30%), поэтому указанные препараты не рекомендуется использовать в качестве препаратов выбора для лечения ИМП [7].
Одними из наиболее часто используемых препаратов для лечения ИМП являются фторхинолоны, которые во многих международных руководствах указываются как препараты выбора в терапии ИМП. Однако в настоящее время отмечается быстрый рост резистентности уропатогенной E. coli к препаратам этой группы. Считается, что при уровне резистентности в популяции более 10% на применение препаратов вводятся ограничения. В России уровень устойчивости уропатогенной E. coli к фторхинолонам, по данным различных исследований, колеблется от 4,3% до 12,9%, составляя в среднем около 7–8% [1, 9, 17, 23].
Лучше всего поддается лечению неосложненная ИМП. Препаратами выбора при острой неосложненной ИМП являются пероральные фторхинолоны (левофлоксацин, норфлоксацин, офлоксацин, пефлоксацин). В случае их непереносимости можно использовать амоксициллин/клавуланат, фосфомицина трометамол, нитрофурантоин [7]. Использование налидиксовой кислоты и нитрофурантоинов имеет определенные недостатки в связи с необходимостью применения этих препаратов 3–4 раза в сутки, а также слабой активностью нитрофурантоина в отношении Proteus spp., а налидиксовой кислоты — в отношении S. saprophyticus [4].
Длительность терапии острого цистита при отсутствии факторов риска составляет 3–5 дней, острого пиелонефрита — не менее 2 недель. При остром цистите фосфомицина трометамол применяется однократно. При острой осложненной ИМП или при наличии факторов риска применяются те же антимикробные препараты, что и при неосложненной ИМП, однако длительность терапии увеличивается до 7–14 дней или более — в отсутствие эффекта [19].
В ряде рандомизированных контролируемых исследований (G. Iravani и соавт., 1998; P. Diakos и соавт., 1987; C. Naber и соавт., 1998; H. Asbach и соавт., 1991) была продемонстрирована эффективность цефалоспоринов III поколения (цефиксим 400 мг однократно; 200 мг 2 раза в сутки) в лечении как неосложненной, так и осложненной ИМП [8], которые в ряде случаев (например, акушерской и гинекологической практике) являются препаратами выбора. Отличительной чертой цефалоспоринов III поколения является высокая активность в отношении микроорганизмов семейства Enterobacteriaceae, устойчивость к действию бета-лактамаз, длительный период полувыведения [13].
В детском возрасте, по сравнению с взрослыми, антибактериальная терапия пиелонефрита проводится более длительным курсом, причем чем младше ребенок, тем длиннее может быть курс терапии. Это связано с несовершенством общего иммунитета и местных факторов защиты мочевых путей, наличием анатомических и длительно сохраняющихся функциональных вариантов обструкции току мочи, что создает предпосылки для возникновения рецидивов ИМП. Поэтому лечение острого неосложненного пиелонефрита проводится в два этапа — стартовая антибиотикотерапия (14–20 дней), затем противорецидивная терапия уросептиками с постепенным снижением дозы препарата (до 28 дней). При наличии анатомической обструкции, связанной с различными аномалиями развития мочевой системы, пузырно-мочеточникового рефлюкса, а также нарушении иннервации тазовых органов, длительность противорецидивной терапии может составлять несколько месяцев или даже лет вплоть до ликвидации первопричины заболевания. Выбор, способ введения и доза антибиотика для стартовой терапии пиелонефрита зависят от возраста ребенка и тяжести течения заболевания [19].
Детям первых 3 месяцев жизни назначаются парентерально цефалоспорины III и IV поколений (цефотаксим — 50 мг/кг/8 ч, цефтриаксон — 50 мг/кг/24 ч, цефтазидим — 30–50 мг/кг/8 ч, цефепим — 50 мг/кг/24 ч) и аминогликозиды (нетромицин — 2,5 мг/кг/8 ч, амикацин — 10 мг/кг/8 ч, гентамицин — 2,5 мг/кг/8 ч). У детей старше трех месяцев жизни при легком и среднетяжелом течении пиелонефрита используются перорально защищенные пенициллины (амоксициллин/клавунат — 40–60 мг/кг/24 ч) и цефалоспорины III поколения (цефтибутен — 9 мг/кг/24 ч, цефиксим — 8 мг/кг/24 ч); при тяжелых формах — парентерально цефалоспорины III (цефотаксим — 50–100 мг/кг/24 ч, цефтриаксон — 50–75 мг/кг/24 ч, цефтазидим — 50–100 мг/кг/24 ч) и IV поколений (цефепим — 50 мг/кг/24 ч) и аминогликозиды (гентамицин — 3–5 мг/кг/24 ч, нетромицин — 4–7,5 мг/кг/24 ч, амикацин — 15–20 мг/кг/24 ч) [2, 24].
Для противорецидивной терапии у детей используются производные 5-нитрофурана (Фурагин — 6–8 мг/кг/24 ч, не более 200 мг/24 ч, Фурамаг — 5 мг/кг/24 ч, не более 400 мг/24 ч), производные пипемидиновой кислоты (Палин — 15 мг/кг/24 ч), налидиксовой кислоты (Неграм, Невиграмон — 55 мг/кг/24 ч), производные 8-оксихинолина (5-НОК, нитроксолин — 5–8 мг/кг/24 ч). Фторированные хинолоны в детском возрасте применяются только по жизненным показаниям [2, 6].
Беременным женщинам с ББ антимикробная терапия показана при развитии бактериурии после трансплантации почки и перед планирующимися урологическими вмешательствами. Лечение ББ снижает у них риск развития пиелонефрита на 20–35%, а также процент преждевременных родов и внутриутробной гипотрофии плода [3, 21].
ББ у женщин, страдающих сахарным диабетом (СД), выявляется достаточно часто. Однако анализ большого числа исследований показал, что выявление ББ и проведение антибактериальной терапии в этой группе больных не приводит к уменьшению частоты заболеваний мочевыводящих путей и осложнений диабета. В то же время у пациенток данной группы наблюдается большее число осложнений антибактериальной терапии, таких как дисбактериоз кишечника, системный кандидоз, аллергические реакции и пр. Таким образом, антимикробная терапия при ББ в большинстве случаев, включая у больных СД, по-видимому, необоснованна [5, 11].
При хроническом пиелонефрите обострения общепринято лечить как острый пиелонефрит. Не подлежит сомнению необходимость устранения обструкции, восстановления нормального пассажа мочи, стимуляции иммунитета, профилактики обострений ИМП. Значение этих мероприятий особенно показательно у детей с пузырно-мочеточниковым рефлюксом и рефлюкс-нефропатией.
Вне обострения пиелонефрита желательно применение растительных уросептиков в сочетании с профилактическими мероприятиями — употребление не менее 2 литров жидкости в сутки, регулярное опорожнение мочевого пузыря, обязательное в ночное время и после полового сношения, борьба с запорами. Противорецидивные курсы антибиотиков с ежемесячной сменой препарата неоправданны.
Неосложненная мочевая инфекция (в т. ч. неосложненный пиелонефрит) практически не приводит к развитию хронической почечной недостаточности (ХПН). Основной причиной терминальной почечной недостаточности в настоящее время является не хронический пиелонефрит, а СД и артериальная гипертензия, удельный вес которых в структуре ХПН постоянно увеличивается. Для предупреждения или замедления прогрессирования ХПН у больных хроническим пиелонефритом значение имеют не длительная антибиотикотерапия, а жесткий контроль артериального давления и коррекция метаболических нарушений, таких как гиперлипидемия, гиперурикемия и т. д.
Литература
В. М. Ермоленко, доктор медицинских наук, профессор
Н. Н. Филатова, кандидат медицинских наук, доцент
А. В. Малкоч, кандидат медицинских наук, доцент
ГБОУ ДПО РМАПО Минздравсоцразвития России, Москва
.gif)