какие факторы влияют на активность ферментов
Факторы, влияющие на ферментативную активность



Активность ферментов может быть усилена, ослаблена или подавлена за счет влияния ряда факторов (температуры, рН, наличия активаторов и ингибиторов, концентрации субстрата и фермента).
Оптимальная температура не является постоянной величиной, она зависит от длительности температурного воздействия и влажности среды, в которой фермент действует. Ферменты очень чувствительны к нагреванию в присутствии значительного количества воды. И наоборот, при низкой влажности и в сухом состоянии ферменты выдерживают температуру близкую к 100 °С без значительной инактивации.
Различают конкурентное и неконкурентное ингибирование.
Если концентрация молекул ингибитора значительно больше концентрации субстрата, то контактная площадка фермента почти всегда занята ингибитором. В этом случае субстрату некуда разместиться, так как площадка очень мала, и ферментативная реакция не идет.
Если количество молекул субстрата и ингибитора оказывается соизмеримым, то субстрату иногда удается попасть на контактную площадку. В этом случае ферментативная реакция не прекращается, а только замедляется. Скорость ее будет зависеть от количества ингибитора.
В обоих случаях связь ингибитора с ферментом непрочная и такие ингибиторы называются конкурентными.
Ряд ингибиторов, заняв контактную площадку, вступают в химическое взаимодействие с отдельными функциональными группами каталитически активного центра, прочно связываются с ферментом и блокируют его действие. Такой тип ингибирования называется неконкурентным или необратимым.
Существует также аллостерическая (структурно несвязанная) регуляция. В белковой части фермента кроме каталитического центра может находиться аллостерическиий центр, играющий очень важную роль в регуляции ферментативной активности. Данный тип регуляции основан на изменении конформации (пространственной конфигурации) фермента, ведущей к изменению его активности. Аллостерический центр распознает и связывает эффекторы, тем самым, влияя на каталитический центр, изменяя его активность. В качестве эффекторов выступают конечный продукт данной цепи реакций или иные низкомолекулярные вещества. Они отличаются по своей структуре от субстрата. Эффекторы могут быть положительными и отрицательными (соответственно увеличивают или снижают ферментативную активность).
Скорость большинства ферментативных реакций прямо пропорциональна концентрации фермента (рис.14) в реакционной смеси (концентрация субстрата при этом постоянна).
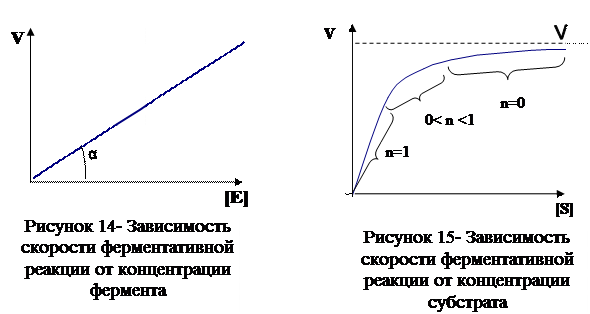
Активность фермента определяется по скорости реакции, которую в свою очередь можно определить либо по убыли субстрата или по количеству продуктов реакции.
ГК «Униконс»
Продвижение и реализация комплексных пищевых добавок, антисептиков и др. продукции.
«Антисептики Септоцил»
Септоцил. Бытовая химия, антисептики.
«Петритест»
Микробиологические экспресс-тесты. Первые результаты уже через 4 часа.
«АльтерСтарт»
Закваски, стартовые культуры. Изготовление любых заквасок для любых целей.
Факторы, влияющие на реакции ферментации
На активность ферментов, а следовательно, и на скорость реакции ферментативного катализа оказывают влияние различные факторы. К числу основных относятся:
• концентрация и доступность субстрата;
• наличие ингибиторов или активаторов.
В общем случае при низких концентрациях субстратов реакции ферментации относятся к кинетическим реакциям нулевого порядка. Участие ферментов в пищевых технологиях исчисляется минутами, поэтому концентрации субстратов значительно превосходят концентрации ферментов. Скорость большинства реакций ферментации соответствует кинетическому уравнению первого порядка
где dP/dT— скорость образования продукта, (S-P) — остаточная концентрация субстрата в данный момент.
Следовательно, скорость реакции зависит от остаточной концентрации субстрата. Важным практическим применением концентрации субстрата является использование его для повышения стабильности ферментов. Ферменты значительно быстрее денатурируют в разбавленных растворах. При высоких концентрациях субстратов каталитические центры ферментов насыщаются (заполняются) субстратом, повышая стабильность. В практическом отношении принципиальной является доступность субстратов. Наличие высоких концентраций субстратов совершенно не гарантирует протекания реакции. Для проведения катализа субстрат должен находиться в контакте с ферментом. Типичным примером вышесказанного является гидролиз триа-цилглицерина липазами. Фермент гидрофилен, в то время как субстрат гидрофобен. Применение эмульгатора, обеспечивающего контакт фермента и субстрата, значительно увеличивает скорость гидролиза.
Концентрация ферментов всегда относительно невелика. Для большинства пищевых применений скорость реакций пропорциональна концентрации ферментов Исключение составляют те случаи, когда реакции доводят до очень низких уровней субстрата.
Влияние температуры на ферменты двояко Для большинства химических реакций скорость реакции с повышением температуры увеличивается за счет кинетической энергии реагентов До критической температуры ферменты ведут себя аналогично, выше критической — начинается снижение скорости процесса Поэтому температура процесса ферментации крайне важна При повышенных температурах скорости реакции и денатурации ферментов одинаково велики В большинстве случаев температура оптимизируется с учетом обеих реакций Температура также используется для стабилизации ферментов относительно других факторов. Например, при снижении температуры реакции может быть увеличен диапазон рН ферментативного катализа.
Абсолютной является зависимость активности ферментов от величины рН При этом для одних ферментов диапазон оптимальных значений рН узкий, а для других — широкий Стабильность ферментов также зависит от рН. Даже ограниченные изменения рН могут неблагоприятно сказываться на реакции, катализируемой ферментами В связи с чем обоснованным является введение ферментов в реакционную массу только после того, как достигнуто требуемое значение рН.
Важным фактором в реакциях ферментации является время Для реакции ферментативного катализа первого порядка скорость реакции со временем уменьшается, так как уменьшается доступность субстрата Такие реакции ферментативного катализа требуют достаточно много времени для ее завершения
Химические вещества, способные оказывать вредное воздействие на реакцию ферментации, получили название «ингибиторы» В качестве таких веществ могут выступать металлы (медь, железо, кальций) или соединения из субстратов. Примером ингибитора, связанного с субстратом, является трипсин — ингибитор из сои
В зависимости от вида воздействия ингибиторы подразделяют на пять групп
Некоторые вещества способны, наоборот, активировать или стабилизировать ферменты В связи с этим в составе ферментных препаратов могут содержаться некоторые химические вещества из числа пищевых добавок (хлорид калия, фосфат натрия, глицерин и др.), введенные для стандартизации активности и повышения стабильности. Некоторые виды ферментных препаратов выпускаются в виде иммобилизованных, нанесенных на твердый или коллоидный носитель.
Ферменты

Этот термин постоянно на слуху, правда, далеко не все понимают, что такое фермент или энзим, какие функции выполняет это вещество, а также чем отличаются ферменты от энзимов и отличаются ли вообще. Все это сейчас и узнаем.
Без этих веществ ни люди, ни животные не смогли бы переваривать пищу. А впервые к применению ферментов в быту человечество прибегло более 5 тысяч лет тому назад, когда наши предки научились хранить молоко в «посуде» из желудков животных. В таких условиях под воздействием сычужного фермента молоко превращалось в сыр. И это только один из примеров работы энзима в качестве катализатора, ускоряющего биологические процессы. Сегодня ферменты незаменимы в промышленности, они важны для производства сахара, маргаринов, йогуртов, пива, кожи, текстиля, спирта и даже бетона. В моющих средствах и стиральных порошках также присутствуют эти полезные вещества – помогают выводить пятна при низких температурах.
История открытия
Энзим в переводе с греческого означает «закваска». А открытию этого вещества человечество обязано голландцу Яну Баптисту Ван-Гельмонту, жившему в XVI веке. В свое время он весьма заинтересовался спиртовым брожением и в ходе исследования нашел неизвестное вещество, ускоряющее этот процесс. Голландец назвал его fermentum, что в переводе означает «брожение». Затем, почти тремя веками позже, француз Луи Пастер, также наблюдая за процессами брожения, пришел к выводу, что ферменты – не что иное, как вещества живой клетки. А через некоторое время немец Эдуард Бухнер добыл фермент из дрожжей и определил, что это вещество не является живым организмом. Он также дал ему свое название – «зимаза». Еще несколькими годами позже другой немец Вилли Кюне предложил все белковые катализаторы разделить на две группы: ферменты и энзимы. Причем вторым термином он предложил называть «закваску», действия которой распространяются вне живых организмов. И лишь 1897 год положил конец всем научным спорам: оба термины (энзим и фермент) решено использовать как абсолютные синонимы.
Структура: цепь из тысяч аминокислот

Каждая аминокислота соединена с другой определенным типом химической связи, а каждый фермент имеет свою уникальную последовательность аминокислот. Для создания большинства из них используются примерно по 20 видов. Даже незначительные изменения последовательности аминокислот могут кардинально менять внешний вид и «таланты» фермента.
Биохимические свойства
Хотя при участии ферментов в природе происходит огромное количество реакций, но все они могут быть разделены на 6 категорий. Соответственно, каждая из этих шести реакций протекает под влиянием определенного типа ферментов.
Реакции при участии энзимов:
Ферменты, участвующие в этих реакциях, называются оксидоредуктазами. В качестве примера можно вспомнить как, алкогольдегидрогеназы преобразуют первичные спирты в альдегид.
Ферменты, благодаря которым происходят эти реакции, называются трансферазами. Они обладают умением перемещать функциональные группы от одной молекулы к другой. Так происходит, например, когда аланинаминотрансферазы перемещают альфа-аминогруппы между аланином и аспартатом. Также трансферазы перемещают фосфатные группы между АТФ и другими соединениями, а из остатков глюкозы создают дисахариды.

Этот вид реакций негидролитическим путем происходит при участии лиазы.
Во многих химических реакциях положение функциональной группы изменяется в пределах молекулы, но сама молекула состоит из того же количества и типов атомов, что были до начала реакции. Иными словами, субстрат и продукт реакции являются изомерами. Такого типа трансформации возможны под влиянием ферментов изомеразы.
Гидролазы разрушают связь, добавляя в молекулу элементы воды. Лиазы осуществляют обратную реакцию, удаляя водную часть из функциональных групп. Таким образом, создают простую связь.
Как работают в организме
Ферменты ускоряют практически все химические реакции, происходящие в клетках. Они имеют жизненно важное значение для человека, облегчают пищеварение и ускоряют метаболизм.
Некоторые из этих веществ помогают разрушать слишком большие молекулы на более мелкие «куски», которые организм сможет переварить. Другие наоборот связывают мелкие молекулы. Но ферменты, говоря научным языком, обладают высокой селективностью. Это значит, что каждое из этих веществ способно ускорять только определенную реакцию. Молекулы, с которыми «работают» ферменты, называются субстратами. Субстраты в свою очередь создают связь с частью фермента, именуемой активным центром.
Существуют два принципа, объясняющие специфику взаимодействия ферментов и субстратов. В так называемой модели «ключ-замок» активный центр фермента занимает в субстрате место строго определенной конфигурации. Согласно другой модели, оба участника реакции, активный центр и субстрат, меняют свои формы, чтобы соединиться.
По какому бы принципу ни происходило взаимодействие результат всегда одинаковый – реакция под воздействием энзима протекает во много раз быстрее. Вследствие такого взаимодействия «рождаются» новые молекулы, которые потом отделяются от фермента. А вещество-катализатор продолжает выполнять свою работу, но уже при участии других частиц.
Гипер- и гипоактивность
Бывают случаи, когда энзимы выполняют свои функции с неправильной интенсивностью. Чрезмерная активность вызывает чрезмерное формирование продукта реакции и дефицит субстрата. В результате – ухудшение самочувствия и серьезные болезни. Причиной гиперактивности энзима может быть как генетическое нарушение, так и избыток витаминов или микроэлементов, используемых в реакции.
Гипоактивность ферментов может даже стать причиной смерти, когда, например, энзимы не выводят из организма токсины либо возникает дефицит АТФ. Причиной такого состояния также могут быть мутированные гены или, наоборот, гиповитаминоз и дефицит других питательных веществ. Кроме того, пониженная температура тела аналогично замедляет функционирование энзимов.
Катализатор и не только

Энзимы – это биологические молекулы, жизненный цикл которых не определяется рамками от рождения и смерти. Они просто работают в организме до тех пор, пока не растворятся. Как правило, это происходит под воздействием других ферментов.
В процессе биохимической реакции они не становятся частью конечного продукта. Когда реакция завершена, фермент покидает субстрат. После этого вещество готово снова приступить к работе, но уже на другой молекуле. И так продолжается столько, сколько необходимо организму.
Уникальность ферментов в том, что каждый из них выполняет только одну, ему отведенную функцию. Биологическая реакция происходит только тогда, когда фермент находит правильный для него субстрат. Это взаимодействие можно сравнить с принципом работы ключа и замка – только правильно подобранные элементы смогут «сработаться». Еще одна особенность: они могут работать при низких температурах и умеренном рН, а в роли катализаторов являются более стабильными, чем любые другие химические вещества.
Ферменты в качестве катализаторов ускоряют процессы метаболизма и другие реакции.
Как правило, эти процессы состоят из определенных этапов, каждый из которых требует работы определенного энзима. Без этого цикл преобразования или ускорения не сможет завершиться.
Пожалуй, из всех функций ферментов наиболее известна – роль катализатора. Это значит, что энзимы комбинируют химические реагенты таким образом, чтобы снизить энергетические затраты, необходимые для более быстрого формирования продукта. Без этих веществ химические реакции протекали бы в сотни раз медленнее. Но на этом способности энзимов не исчерпываются. Все живые организмы содержат энергию, необходимую им для продолжения жизни. Аденозинтрифосфат, или АТФ, это своего рода заряженная батарейка, которая снабжает клетки энергией. Но функционирование АТФ невозможно без ферментов. И главный энзим, производящий АТФ, – синтаза. Для каждой молекулы глюкозы, которая трансформируется в энергию, синтаза производит около 32-34 молекул АТФ.
Помимо этого, энзимы (липаза, амилаза, протеаза) активно применяются в медицине. В частности, служат компонентом ферментативных препаратов, таких как «Фестал», «Мезим», «Панзинорм», «Панкреатин», применяемых для лечения несварения желудка. Но некоторые энзимы способны также влиять на кровеносную систему (растворяют тромбы), ускорять заживление гнойных ран. И даже в противораковой терапии также прибегают к помощи ферментов.
Факторы, определяющие активность энзимов
Поскольку энзим способен ускорять реакции во много раз, его активность определяется так называемым числом оборотов. Этот термин обозначает количество молекул субстрата (реагирующего вещества), которую способна трансформировать 1 молекула фермента за 1 минуту. Однако существует ряд факторов, определяющих скорость реакции:

Обычно повышение температуры ведет к ускорению реакций. Это правило работает для большинства ферментативных реакций, но только до тех пор, пока температура не поднимется выше 40 градусов по Цельсию. После этой отметки скорость реакции, наоборот, начинает резко снижаться. Если температура опустится ниже критической отметки, скорость ферментативных реакций повысится снова. Если температура продолжает расти, ковалентные связи рушатся, а каталитическая активность фермента теряется навсегда.
На скорость ферментативных реакций также влияет показатель рН. Для каждого фермента существует свой оптимальный уровень кислотности, при котором реакция проходит наиболее адекватно. Изменение уровня рН сказывается на активности фермента, а значит, и скорости реакции. Если изменения слишком велики, субстрат теряет способность связываться с активным ядром, а энзим больше не может катализировать реакцию. С восстановлением необходимого уровня рН, активность фермента также восстанавливается.
Ферменты для пищеварения
Ферменты, присутствующие в человеческом организме, можно разделить на 2 группы:
Метаболические «работают» над нейтрализацией токсических веществ, а также способствуют выработке энергии и белков. Ну и, конечно, ускоряют биохимические процессы в организме.
За что отвечают пищеварительные – понятно из названия. Но и здесь срабатывает принцип селективности: определенный тип ферментов влияет только на один вид пищи. Поэтому для улучшения пищеварения можно прибегнуть к маленькой хитрости. Если организм плохо переваривает что-то из еды, значит надо дополнить рацион продуктом, содержащим фермент, который способен расщепить трудно перевариваемую пищу.
Пищевые ферменты – катализаторы, которые расщепляют продукты питания до состояния, в котором организм способен поглощать из них полезные вещества. Пищеварительные энзимы бывают нескольких типов. В человеческом организме разные виды ферментов содержатся на разных участках пищеварительного тракта.
Ротовая полость

Желудок
Здесь пепсин расщепляет белки до состояния пептидов, а желатиназа – желатин и коллаген, содержащиеся в мясе.
Поджелудочная железа
На этом этапе «работают»:
Тонкая кишка
Над пищевыми частицами «колдуют»:
Толстый кишечник

Кроме названных энзимов, существуют еще:
Катализаторы в продуктах
Ферменты имеют решающее значение для здоровья, поскольку помогают организму расщеплять пищевые компоненты до состояния, пригодного для использования питательных веществ. Кишечник и поджелудочная железа производят широкий спектр ферментов. Но кроме этого, многие из полезных веществ, способствующих пищеварению, содержатся также и в некоторых продуктах.
Ферментированные продукты являются практически идеальным источником полезных бактерий, необходимых для правильного пищеварения. И в то время, когда аптечные пробиотики «работают» только в верхнем отделе пищеварительной системы и часто не добираются до кишечника, эффект от ферментативных продуктов ощущается во всем желудочно-кишечном тракте.
Например, абрикосы содержат в себе смесь полезных энзимов, в том числе инвертазу, которая отвечает за расщепление глюкозы и способствует быстрому высвобождению энергии.
Натуральным источником липазы (способствует более быстрому перевариванию липидов) может послужить авокадо. В организме это вещество производит поджелудочная железа. Но дабы облегчить жизнь этому органу, можно побаловать себя, например, салатом с авокадо – вкусно и полезно.
Кроме того, что банан, пожалуй, самый известный источник калия, он также поставляет в организм амилазу и мальтазу. Амилаза содержится также в хлебе, картофеле, крупах. Мальтаза способствует расщеплению мальтозы, так называемого солодового сахара, который в обилии представлен в пиве и кукурузном сиропе.
Другой экзотический фрукт – ананас содержит в себе целый набор энзимов, в том числе и бромелайн. А он, согласно некоторым исследованиям, еще и обладает противораковыми и противовоспалительными свойствами.
Экстремофилы и промышленность
Экстремофилы – это вещества, способны сохранять жизнедеятельность в экстремальных условиях.
Живые организмы, а также ферменты, позволяющие им функционировать, были найдены в гейзерах, где температура близка к точке кипения, и глубоко во льдах, а также в условиях крайней солености (Долина Смерти в США). Кроме того, ученые находили энзимы, для которых уровень рН, как оказалось, также не принципиальное требование для эффективной работы. Исследователи с особым интересом изучают ферменты-экстремофилы, как вещества, которые могут быть широко использованы в промышленности. Хотя и сегодня энзимы уже нашли свое применение в индустрии как биологически и экологически чистые вещества. К применению энзимов прибегают в пищевой промышленности, косметологии, производстве бытовой химии.
Более того, «услуги» ферментов в таких случаях обходятся дешевле, чем синтетических аналогов. Кроме того, натуральные вещества являются биоразлагаемыми, что делает их использование безопасным для экологии. В природе существуют микроорганизмы, способные расщепить ферменты на отдельные аминокислоты, которые затем становятся компонентами новой биологической цепочки. Но это, как говорится, уже совсем другая история.
Больше свежей и актуальной информации о здоровье на нашем канале в Telegram. Подписывайтесь: https://t.me/foodandhealthru







