какие соединения называются оксидами
Урок №43. Оксиды: классификация, номенклатура, свойства, получение, применение
Сегодня мы начинаем подробное знакомство с важнейшими классами неорганических соединений. Неорганические вещества по составу делятся, как вы уже знаете, на простые (металлы и неметаллы) и сложные:
А – кислотный остаток
ОН – гидроксильная группа
Сложные неорганические вещества подразделяют на четыре класса: оксиды, кислоты, основания, соли. Мы начинаем с класса оксидов.
ОКСИДЫ
оксид углерода ( II )
оксид марганца (VII )
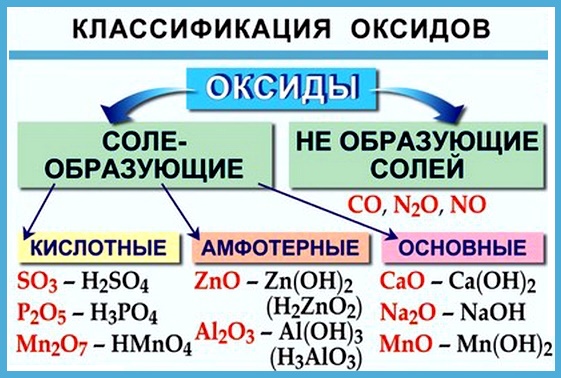
Классификация оксидов
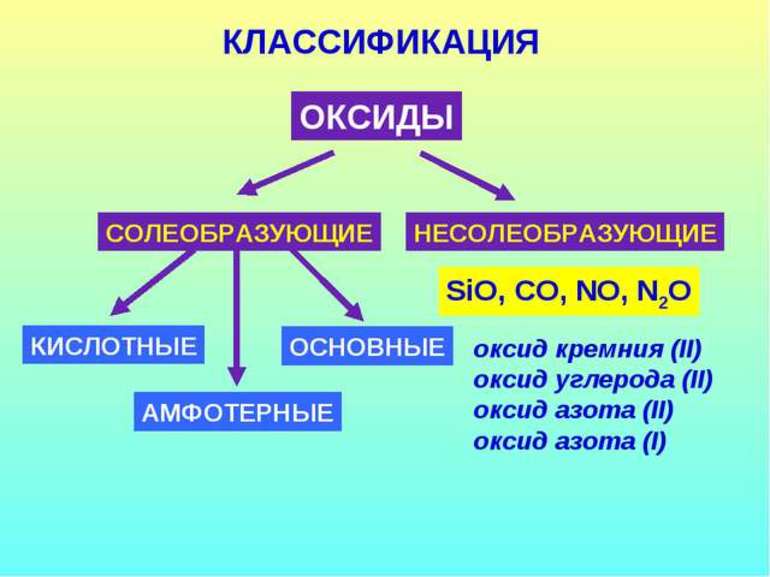
Все оксиды можно разделить на две группы: солеобразующие (основные, кислотные, амфотерные) и несолеобразующие или безразличные.
4). Несолеобразующие оксиды – это оксиды безразличные к кислотам и основаниям. К ним относятся оксиды неметаллов с валентностью I и II (Например, N 2 O, NO, CO).
Вывод: характер свойств оксидов в первую очередь зависит от валентности элемента.
Например, оксиды хрома:
Классификация по растворимости в воде
Кислотные оксиды
(не растворим в воде)
Основные оксиды
В воде растворяются только оксиды щелочных и щелочноземельных металлов
Амфотерные оксиды
С водой не взаимодействуют.
В воде не растворимы
Выполните задания:
1. Выпишите отдельно химические формулы солеобразующих кислотных и основных оксидов.
Выпишите оксиды и классифицируйте их.
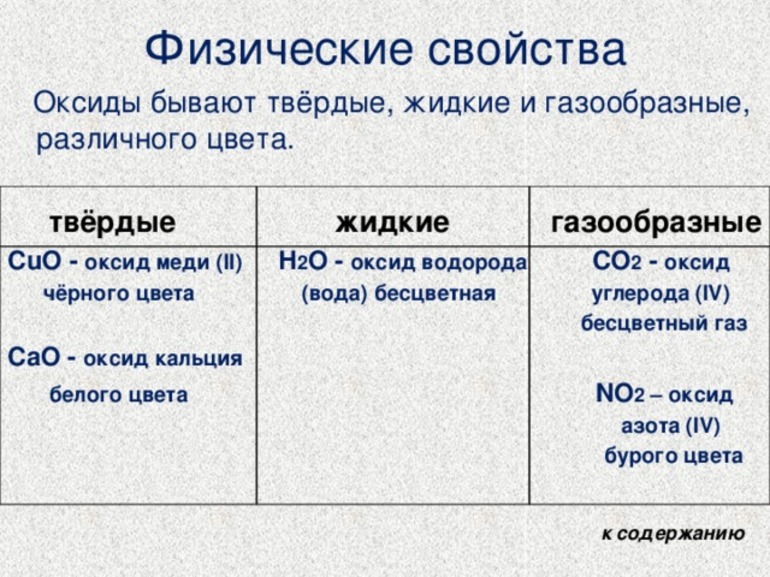
Физические свойства оксидов
Химические свойства оксидов
ХИМИЧЕСКИЕ СВОЙСТВА ОСНОВНЫХ ОКСИДОВ
1. Основной оксид + Кислотный оксид = Соль (р. соединения)
3K 2 O + 2H 3 PO 4 = 2K 3 PO 4 + 3H 2 O
Na 2 O + H 2 O = 2NaOH
ХИМИЧЕСКИЕ СВОЙСТВА КИСЛОТНЫХ ОКСИДОВ
2. Кислотный оксид + Основание = Соль + Н 2 О (р. обмена)
P 2 O 5 + 6KOH = 2K 3 PO 4 + 3H 2 O
3. Основной оксид + Кислотный оксид = Соль (р. соединения)
4. Менее летучие вытесняют более летучие из их солей
CaCO 3 + SiO 2 = CaSiO 3 +CO 2
ХИМИЧЕСКИЕ СВОЙСТВА АМФОТЕРНЫХ ОКСИДОВ
Взаимодействуют как с кислотами, так и со щелочами.
ZnO + 2 HCl = ZnCl 2 + H 2 O
ZnO + 2 NaOH + H 2 O = Na 2 [Zn(OH) 4 ] ( в растворе)
ZnO + 2 NaOH = Na 2 ZnO 2 + H 2 O (при сплавлении)
Применение оксидов
Некоторые оксиды не растворяются в воде, но многие вступают с водой в реакции соединения:
В результате часто получаются очень нужные и полезные соединения. Например, H 2 SO 4 – серная кислота, Са(ОН) 2 – гашеная известь и т.д.
Если оксиды нерастворимы в воде, то люди умело используют и это их свойство. Например, оксид цинка ZnO – вещество белого цвета, поэтому используется для приготовления белой масляной краски (цинковые белила). Поскольку ZnO практически не растворим в воде, то цинковыми белилами можно красить любые поверхности, в том числе и те, которые подвергаются воздействию атмосферных осадков. Нерастворимость и неядовитость позволяют использовать этот оксид при изготовлении косметических кремов, пудры. Фармацевты делают из него вяжущий и подсушивающий порошок для наружного применения.
Такими же ценными свойствами обладает оксид титана (IV) – TiO 2 . Он тоже имеет красивый белый цвет и применяется для изготовления титановых белил. TiO 2 не растворяется не только в воде, но и в кислотах, поэтому покрытия из этого оксида особенно устойчивы. Этот оксид добавляют в пластмассу для придания ей белого цвета. Он входит в состав эмалей для металлической и керамической посуды.
Оксид хрома (III) – Cr 2 O 3 – очень прочные кристаллы темно-зеленого цвета, не растворимые в воде. Cr 2 O 3 используют как пигмент (краску) при изготовлении декоративного зеленого стекла и керамики. Известная многим паста ГОИ (сокращение от наименования “Государственный оптический институт”) применяется для шлифовки и полировки оптики, металлических изделий, в ювелирном деле.
Оксиды: классификация, получение и химические свойства
В зависимости от второго элемента оксиды проявляют разные химические свойства. В школьном курсе оксиды традиционно делят на солеобразующие и несолеобразующие. Некоторые оксиды относят к солеобразным (двойным).
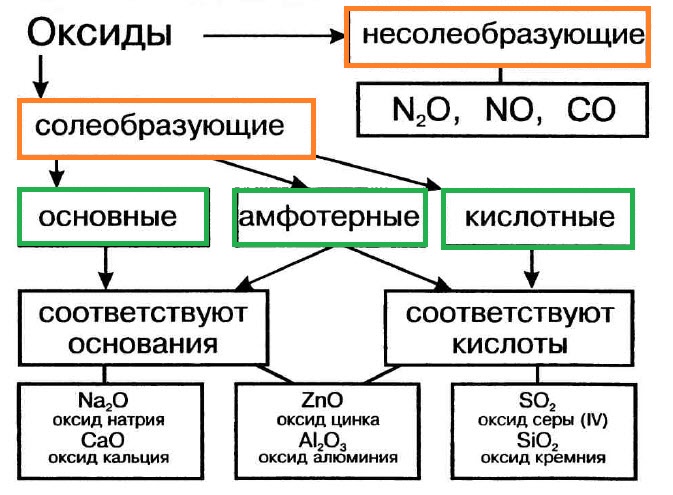
Солеобразующие оксиды делят на основные, амфотерные и кислотные.
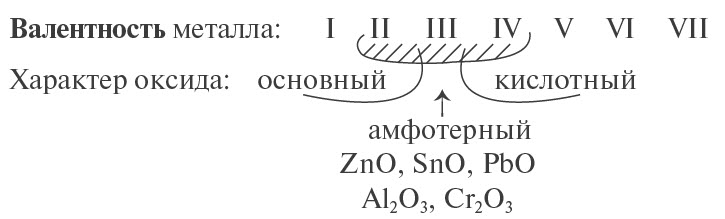
Основные оксиды — это оксиды, обладающие характерными основными свойствами. К ним относят оксиды, образованные атомами металлов со степень окисления +1 и +2.
Кислотные оксиды — это оксиды, характеризующиеся кислотными свойствами. К ним относят оксиды, образованные атомами металлов со степенью окисления +5, +6 и +7, а также атомами неметаллов.
Амфотерные оксиды — это оксиды, характеризующиеся и основными, и кислотными свойствами. Это оксиды металлов со степенью окисления +3 и +4, а также четыре оксида со степенью окисления +2: ZnO, PbO, SnO и BeO.
Несолеобразующие оксиды не проявляют характерных основных или кислотных свойств, им не соответствуют гидроксиды. К несолеобразующим относят четыре оксида: CO, NO, N2O и SiO.
Классификация оксидов
Получение оксидов
Общие способы получения оксидов:
1. Взаимодействие простых веществ с кислородом :
1.1. Окисление металлов: большинство металлов окисляются кислородом до оксидов с устойчивыми степенями окисления.
Не взаимодействуют с кислородом золото, платина, палладий.
Натрий при окислении кислородом воздуха образует преимущественно пероксид Na2O2,
Калий, цезий, рубидий образуют преимущественно пероксиды состава MeO2:
Примечания : металлы с переменной степенью окисления окисляются кислородом воздуха, как правило, до промежуточной степени окисления (+3):
Железо также горит с образованием железной окалины — оксида железа (II, III):
1.2. Окисление простых веществ-неметаллов.
Как правило, при окислении неметаллов образуется оксид неметалла с высшей степенью окисления, если кислород в избытке, или оксид неметалла с промежуточной степенью окисления, если кислород в недостатке.
Оксид серы (VI) можно получить только окислением оксида серы (IV) в жестких условиях в присутствии катализатора:
2SO2 + O2 = 2SO3
Азот окисляется кислородом только при очень высокой температуре (около 2000 о С), либо под действием электрического разряда, и только до оксида азота (II):
Не окисляется кислородом фтор F2 (сам фтор окисляет кислород). Не взаимодействуют с кислородом прочие галогены (хлор Cl2, бром и др.), инертные газы (гелий He, неон, аргон, криптон).
2. Окисление сложных веществ (бинарных соединений): сульфидов, гидридов, фосфидов и т.д.
При окислении кислородом сложных веществ, состоящих, как правило, из двух элементов, образуется смесь оксидов этих элементов в устойчивых степенях окисления.
Сероводород горит с образованием оксида серы (IV) при избытке кислорода и с образованием серы при недостатке кислорода:
А вот аммиак горит с образованием простого вещества N2, т.к. азот реагирует с кислородом только в жестких условиях:
А вот в присутствии катализатора аммиак окисляется кислородом до оксида азота (II):
3. Разложение гидроксидов. Оксиды можно получить также из гидроксидов — кислот или оснований. Некоторые гидроксиды неустойчивы, и самопроизвольную распадаются на оксид и воду; для разложения некоторых других (как правило, нерастворимых в воде) гидроксидов необходимо их нагревать (прокаливать).
гидроксид → оксид + вода
Самопроизвольно разлагаются в водном растворе угольная кислота, сернистая кислота, гидроксид аммония, гидроксиды серебра (I), меди (I):
2AgOH → Ag2O + H2O
2CuOH → Cu2O + H2O
При нагревании разлагаются на оксиды большинство нерастворимых гидроксидов — кремниевая кислота, гидроксиды тяжелых металлов — гидроксид железа (III) и др.:
Соли, образованные сильными кислотами-окислителями (нитраты, сульфаты, перхлораты и др.), при нагревании, как правило, разлагаются с с изменением степени окисления:
Более подробно про разложение нитратов можно прочитать в статье Окислительно-восстановительные реакции.
Химические свойства оксидов
Значительная часть химических свойств оксидов описывается схемой взаимосвязи основных классов неорганических веществ.
Химические свойства основных оксидов
Подробно про химические свойства оксидов можно прочитать в соответствующих статьях:
Какие соединения называются оксидами
Ключевые слова конспекта: оксиды, названия оксидов, классификация оксидов, получение оксидов, химические свойства.
Оксиды — сложные вещества, молекулы которых состоят из атомов двух химических элементов, один из которых — кислород. Атом кислорода в оксидах всегда имеет степень окисления –2.
К примеру, оксидом является соединение P2O5. А вот РН3 и H3PO4 — не являются оксидами, потому что в состав РН3 не входит атом кислорода, а в состав H3PO4 входят атомы трёх химических элементов, а не двух.
Оксиды подразделяют на солеобразующие (основные, кислотные, амфотерные) и несолеобразующие (безразличные). Особое положение у оксида «вода».
Названия оксидов
Названия оксидов состоят из двух слов: 1-е – «оксид», 2-е – название элемента в родительном падеже. Например, СаО – оксид кальция.
Если оксид образован химическим элементом с переменной валентностью, то после названия элемента, нужно указать его валентность. Например: Fe2О3 — оксид железа (III), FеО — оксид железа (II). Если у элемента постоянная валентность, то ее не обозначают в названии.
Некоторые оксиды имеют особые (тривиальные) названия: Н2О — вода, СО — угарный газ, СО2 — углекислый газ и др.
Если элемент образует оксиды в нескольких степенях окисления, то оксид с наименьшей валентностью – низший оксид, а с наибольшей – высший оксид. Так, оксид хрома (II) СгО – низший оксид, а оксид хрома (VI) СгO3 – высший оксид.
Классификация оксидов
Многие оксиды могут реагировать с кислотами или основаниями. Продуктами таких реакций являются соли. Поэтому такие оксиды называются солеобразующими.
Однако существует небольшая группа оксидов, которые к таким реакциям не способны. Такие оксиды называются несолеобразующими (безразличными): H2O, CO, N2O, NO, F2O. Безразличные оксиды образуются только неметаллами.
Вот некоторые правила образования солеобразующих оксидов:
Предсказать свойства оксида металла может помочь эта схема.
Основные оксиды металлов от кислотных оксидов металлов отличить легко: малая валентность металла — основный оксид; большая — кислотный. Валентность металлов в амфотерных оксидах — III. Но есть и исключения. Поэтому желательно запомнить формулы наиболее часто встречающихся амфотерных оксидов.
Схема определения типа оксида:
Получение оксидов
Oксиды образуются при взаимодействии простых и сложных веществ с кислородом:
4Аl + 3O2 = 2Аl2O3; Si + O2 = SiO2;
SiH4 + 2O2 = SiO2 + 2Н2O; 2Н2S + 3O2 = 2SO2 + 2Н2O.
В реакциях с простыми веществами из одних оксидов могут получаться другие оксиды:
Fe2O3 + С = 2FeO + СО; 2CuO + Н2 = Сu2O + Н2O.
Oксиды образуются при разложении некоторых сложных веществ, обычно при нагревании:
СаСO3 = СаО + СO2; 2Аl(ОН)3 = Аl2O3 + 3Н2O.
Химические свойства оксидов
1. При разложении (при нагревании) неустойчивых оксидов – оксида серебра Ag2O и оксида ртути (II) HgO – образуется соответствующий металл и кислород:
2Ag2O = 4Ag + O2 ↑, 2HgO = 2Hg + O2 ↑.
2. Некоторые oксиды при нагревании образуют другие оксиды. Так, из красного оксида хрома (VI) получается зеленый оксид хрома (III): 4СrO3 = 2Сr2O3 + 3O2 ↑.
4. Oксиды металлов обычно реагируют с оксидами неметаллов:
СаО + SO2 = CaSO3, MgO + СO2 = MgCO3.
Реакции оксидов с основаниями, кислотами и солями будут рассмотрены позже.
Конспект урока «Оксиды (названия, классификация, получение, свойства)».
Общие сведения
В 1775 году французский химик А. Лавуазье правильно истолковал результаты опытов Д. Пристли. Он понял, что газ, поддерживающий горение в герметичном сосуде, — это не часть воздуха, а новый химический элемент. Лавуазье назвал его оксигеном, что в переводе с греческого означает «образующий кислоты», так как думал, что новый элемент входит во все кислоты. Однако такая теория не была верной. Название кислород — это своего рода калька с французского, введенная М. В. Ломоносовым.
Кислород — газ без цвета, запаха и вкуса. При сильном охлаждении превращается сначала в голубую жидкость, затем — в кристаллы синего цвета. Имеет валентность 2 и семь степеней окисления в зависимости от вещества, с которым взаимодействует.
Степени окисления для разных соединений:
Образование оксидов
Получаются оксиды как при непосредственном вступлении кислорода в реакцию с другим химическим элементом, так и при косвенном взаимодействии — в результате разложения кислот, солей и оснований. Самый простой способ получения окисла — это сжигание вещества в кислороде. Формулы оксидов можно определить исходя из значений валентности кислорода и второго химического вещества, а номенклатура названий образуется по схеме:
Например, Mn2O7 — оксид марганца (VII). Допускается название по количеству атомов кислорода — монооксид, диоксид и т. п. Широко распространены и названия, сложившиеся исторически.
Все существующие оксиды разделяются на солеобразующие и несолеобразующие. Последние являются оксидами неметаллов, не имеющих соответственных гидроксидов. Таких соединений немного, к ним относятся оксиды одно- и двухвалентных неметаллов — вода H2O, токсичные газы монооксид углерода CO и оксид азота (II) NO, «веселящий газ» N2O, соединения с кислородом серы и кремния. Они довольно инертны, если и взаимодействуют с другими веществами, то солей не образовывают. Например, при растворении в воде N2O и SO2 образуется серная кислота, и выделяется азот.
Классификация солеобразующих соединений
В химии соединения с кислородом разделяют по характеру их соответствия основаниям, кислотам и амфотерным образованиям. Если металл, составляющий формулу с кислородом, имеет несколько степеней окисления, то промежуточное значение будет у амфотерного, самое большое — у кислотного, а самое низкое — у основного соединения.
К основным оксидам относятся соединения металлов, степень окисления которых равна +1 или +2. Им соответствуют гидроксиды, относящиеся к классу оснований. Реагируют с кислотами, в результате чего получаются соль и вода. В периодической системе усиление основных характеристик наблюдается в главных подгруппах сверху вниз. Список основных оксидов:
К кислотным или ангидридам относятся оксиды неметаллов и металлов со степенью окисления больше +5.
Поскольку в них химические элементы находятся в высшей степени активности, их еще называют высшими. Кислотные свойства таких соединений повышаются по мере продвижения по таблице Менделеева слева направо, так как увеличивается положительный заряд ионов элемента с возрастанием номера периода.
Ангидриды соответствуют гидроксидам, относящимся к кислотам, они могут растворяться в щелочах, образуя при этом соль и воду. Некоторые вступают в реакцию с водой. Типичные представители кислотных оксидов: SO2, SO3, CrO3, P2O5, Cl2O7, Mn2O7. Металлы, которые могут иметь степень окисления +2, +3, +4, образуют с кислородом амфотерные соединения, проявляющие то кислотные, то основные свойства в зависимости от условий химической реакции. К ним относятся Fe2O3, Cr2O3, Al2O3, ZnO, BeO и MnO2.
Физические и химические свойства
Свойства оксидов физического характера определяются структурой их строения. Окислам металлов присуще ионное строение, что определяет и их свойства. Чаще всего это твердые вещества самых разных окрасок. Не растворяются в воде, за исключением соединений щелочных и щелочноземельных металлов. Имеют высокие температуры кипения и плавления. Другие свойства определяются их составом.
Вещества, образованные неметаллическими элементами, чаще всего имеют молекулярный вид строения и более разнообразны по агрегатному состоянию — встречаются жидкие, газообразные и твердые оксиды. К жидкостям относятся:
Окиси серы, углерода и азота при нормальных условиях находятся в газообразном состоянии. Главные химические свойства основных оксидов:
Разные соединения имеют и уникальные свойства. CuO при сплавлении с основаниями, т. е. когда смесь веществ дополнительно нагревают, образует купраты (двойные соли меди и другого металла). Это говорит о слабовыраженных амфотерных свойствах окиси меди.
Также она довольно хорошо восстанавливается до металлического состояния аммиаком, углем и водородом.
FeO распадается при среднем нагревании, но если продолжать поднимать температуру, то получатся оксид Fe3O4 и железо. Может вступать в реакцию с сероводородом и восстанавливаться водородом и коксом. BaO при нагревании до 600 градусов переходит в пероксид бария и может восстановиться до металла при повышении температуры с цинком, магнием и кремнием.
Кислотные оксиды также хорошо реагируют с водой, взаимодействуют с основаниями и основными оксидами. Углекислый газ, растворяясь в воде, образует слабую угольную кислоту, ее применяют для газирования воды, при этом происходит обратная реакция. Диоксид углерода, вступая в реакцию с едким натром NaOH, образует соль угольной кислоты, известную в обиходе как кальцинированная сода. Из углекислого газа получается и так называемая горькая соль MgCO3, для этого нужно соединить CO2 и MgO.
Амфотерные оксиды вступают в химические реакции и с кислотами, и с основаниями. При взаимодействии со щелочами часто получаются соли двойных металлов.
Области применения
Оксиды очень широко применяются в быту, промышленности, медицине и других областях. Вода H2O — источник жизни на земле. Гематит или красный железняк Fe2O3 используют для пигментации красных красок, а магнетит или магнитный железняк Fe3O4 — в металлургии и для изготовления электродов, так как он хорошо проводит электрический ток.
Негашеная известь применяется в строительстве и быту для борьбы с вредителями древесины. Мелкие кристаллы корунда Al2O3 наносят на наждачную бумагу для создания хорошего шлифовального эффекта. Крупные используют в изготовлении искусственных рубинов и сапфиров для ювелирных изделий и часов.
Нанесение оксида железа (II) на сталь называется воронением или чернением. Соединение образовывает прочный тонкий слой на поверхности. Регулируя его толщину, можно получить так называемые цвета побежалости — пленки, изменяющей свой цвет в радужном спектре. Это свойство используют в технологии нанесения цветных рисунков на сталь.
Углекислый газ CO2 используют и в твердом, и в жидком виде. В пищевой промышленности его применяют при изготовлении разнообразных газированных напитков, соды, сахара. В виде сухого льда он используется для сильного охлаждения продуктов и материалов. Жидкой углекислотой наполняют огнетушители.
Широкое применение получил сернистый газ SO2. Его используют в химической промышленности для производства серной кислоты. Способность сернистого газа убивать микроорганизмы и плесень позволила использовать его для дезинфекции подвалов, погребов, складских помещений, а также для хранения и перевозки фруктов и ягод.
Оксид кремния (IV) SiO2 — тугоплавкое и твердое вещество. Встречается в природе в кристаллическом и аморфном состоянии. Кристаллический кремнезем — это минералы кварца в виде халцедона, агата, яшмы, горного хрусталя. Кварцевый песок используют для изготовления стекла, бетона и кирпича. Полудрагоценные камни обрабатывают ювелиры, особенно красиво кристаллы выглядят при использовании одновременно с SiO2 оксида свинца PbO.
Аморфный кремнезем называется опалом и выражается формулой SiO2 ∙ nH2O. Из него делают украшения, химическую посуду, кварцевые лампы. Соединения, имеющие устойчивый цвет, используют для пигментации стекол и красок. CO2O3 придает материалам синий, Cr2O3 — зеленый, ZnO — белый, MnO2 — розовый цвет.
Окись цинка нашла и медицинское применение, ее добавляют в маски и кремы, подсушивают раны при кожных заболевания. Жженую магнезию MgO из-за ее способности хорошо реагировать с соляной кислотой желудочного сока назначают как средство при повышенной кислотности, она помогает убрать изжогу и выступает сорбентом. Оксид хрома (VI) CrO3 используется в восстановительной хирургии. Это вещество безвредно для человеческого организма.