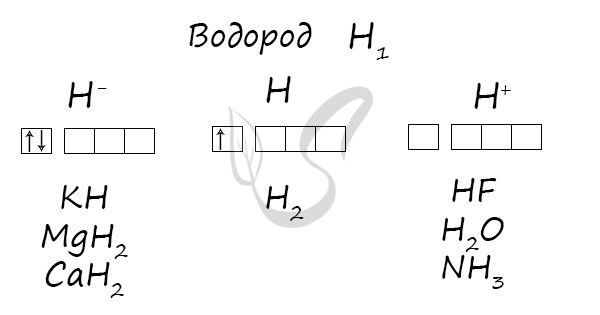
какие свойства проявляет водород
Водород: химия водорода и его соединений
Водород
Положение в периодической системе химических элементов
Водород расположен в главной подгруппе I группы и в первом периоде периодической системы химических элементов Д.И. Менделеева.
Электронное строение водорода
Электронная конфигурация водорода в основном состоянии :
+1H 1s 1 1s
Атом водорода содержит на внешнем энергетическом уровне один неспаренный электрон в основном энергетическом состоянии.
Физические свойства
Водород – легкий газ без цвета, без запаха. Молекула водорода состоит из двух атомов, связанных между собой ковалентной неполярной связью:
Соединения водорода
Типичные соединения водорода:
| Степень окисления | Типичные соединения |
| +1 | кислоты H2SO4, H2S, HCl и др. вода H2O и др. летучие водородные соединения (HCl, HBr) кислые соли (NaHCO3 и др.) основания NaOH, Cu(OH)2 основные соли (CuOH)2CO3 |
| -1 | гидриды металлов NaH, CaH2 и др. |
Способы получения
Еще один важный промышленный способ получения водорода — паровая конверсия метана. При взаимодействии перегретого водяного пара с метаном образуется угарный газ и водород:
Также возможна паровая конверсия угля:
C 0 + H2 + O → C +2 O + H2 0
Химические свойства
1. Водород проявляет свойства окислителя и свойства восстановителя. Поэтому водород реагирует с металлами и неметаллами.
1.1. С активными металлами водород реагирует с образованием гидридов :
2Na + H2 → 2NaH
1.2. В специальных условиях водород реагирует с серой с образованием бинарного соединения сероводорода:
1.4. С азотом водород реагирует при нагревании под давлением в присутствии катализатора с образованием аммиака:
2. Водород взаимодействует со сложными веществами:
ZnO + H2 → Zn + H2O
Также водород восстанавливает медь из оксида меди:
СuO + H2 → Cu + H2O
2.2. С органическими веществами водород вступает в реакции присоединения (реакции гидрирования).
Применение водорода
Применение водорода основано на его физических и химических свойствах:
Водородные соединения металлов
Соединения металлов с водородом — солеобразные гидриды МеНх. Это твердые вещества белого цвета с ионным строением. Устойчивые гидриды образуют активные металлы (щелочные, щелочноземельные и др.).
Способы получения
Гидриды металлов можно получить непосредственным взаимодействием активных металлов и водорода.
2Na + H2 → 2NaH
Гидрид кальция можно получить из кальция и водорода:
Химические свойства
NaH + H2O → NaOH + H2
2. При взаимодействии с кислотами гидриды металлов образуют соль и водород.
NaH + HCl → NaCl + H2
3. Солеобразные гидриды проявляют сильные восстановительные свойства и взаимодействуют с окислителями (кислород, галогены и др.)
2NaH + O2 = 2NaOH
Гидрид натрия также окисляется хлором :
NaH + Cl2 = NaCl + HCl
Летучие водородные соединения
Соединения водорода с неметаллами — летучие водородные соединения.
Строение и физические свойства
Все летучие водородные соединения — газы (кроме воды).
| CH4 — метан | NH3 — аммиак | H2O — вода | HF –фтороводород |
| SiH4 — силан | PH3 — фосфин | H2S — сероводород | HCl –хлороводород |
| AsH3 — арсин | H2Se — селеноводород | HBr –бромоводород | |
| H2Te — теллуроводород | HI –иодоводород |
Способы получения силана
Силан образуется при взаимодействии соляной кислоты с силицидом магния:
Видеоопыт получения силана из силицида магния можно посмотреть здесь.
Способы получения аммиака
В лаборатории аммиак получают при взаимодействии солей аммония с щелочами. Поск ольку аммиак очень хорошо растворим в воде, для получения чистого аммиака используют твердые вещества.
Тщательно растирают ступкой смесь соли и основания и нагревают смесь. Выделяющийся газ собирают в пробирку (аммиак — легкий газ и пробирку нужно перевернуть вверх дном). Влажная лакмусовая бумажка синеет в присутствии аммиака.
Видеоопыт получения аммиака из хлорида аммония и гидроксида кальция можно посмотреть здесь.
Еще один лабораторный способ получения аммиака – гидролиз нитридов.
В промышленности аммиак получают с помощью процесса Габера: прямым синтезом из водорода и азота.
Процесс проводят при температуре 500-550 о С и в присутствии катализатора. Для синтеза аммиака применяют давления 15-30 МПа. В качестве катализатора используют губчатое железо с добавками оксидов алюминия, калия, кальция, кремния. Для полного использования исходных веществ применяют метод циркуляции непрореагировавших реагентов: не вступившие в реакцию азот и водород вновь возвращают в реактор.
Более подробно про технологию производства аммиака можно прочитать здесь.
Способы получения фосфина
В лаборатории фосфин получают водным или кислотным гидролизом фосфидов – бинарных соединений фосфора и металлов.
Еще один лабораторный способ получения фосфина – диспропорционирование фосфора в щелочах.
Способы получения сероводорода
1. В лаборатории сероводород получают действием минеральных кислот на сульфиды металлов, расположенных в ряду напряжений левее железа.
FeS + 2HCl → FeCl2 + H2S↑
Еще один способ получения сероводорода – прямой синтез из водорода и серы:
Еще один лабораторный способ получения сероводорода – нагревание парафина с серой.
Видеоопыт получения и обнаружения сероводорода можно посмотреть здесь.
2. Также сероводород образуется при взаимодействии растворимых солей хрома (III) и алюминия с растворимыми сульфидами. Сульфиды хрома (III) и алюминия необратимо гидролизуются в водном растворе.
Например: х лорид хрома (III) реагирует с сульфидом натрия с образованием гидроксида хрома (III), сероводорода и хлорида натрия:
Химические свойства силана
1. Силан — неустойчивое водородное соединение (самовоспламеняется на воздухе). При сгорании силана на воздухе образуется оксид кремния (IV) и вода:
Видеоопыт сгорания силана можно посмотреть здесь.
2. Силан разлагается водой с выделением водорода:
3. Силан разлагается (окисляется) щелочами :
4. Силан при нагревании разлагается :
Химические свойства фосфина
Соли фосфония неустойчивые, легко гидролизуются.
3. Как сильный восстановитель, фосфин легко окисляется под действием окислителей.
Серная кислота также окисляет фосфин:
С фосфином также реагируют другие соединения фосфора, с более высокими степенями окисления фосфора.
2PH3 + 2PCl3 → 4P + 6HCl
Химические свойства сероводорода
1. В водном растворе сероводород проявляет слабые кислотные свойства. Взаимодействует с сильными основаниями, образуя сульфиды и гидросульфиды:
H2S + 2NaOH → Na2S + 2H2O
H2S + NaOH → NaНS + H2O
В избытке кислорода:
3. Как сильный восстановитель, сероводород легко окисляется под действием окислителей.
Например, бром и хлор окисляют сероводород до молекулярной серы:
H2S + Br2 → 2HBr + S↓
H2S + Cl2 → 2HCl + S↓
Под действием избытка хлора в водном растворе сероводород окисляется до серной кислоты:
При кипячении сера окисляется до серной кислоты:
Прочие окислители окисляют сероводород, как правило, до молекулярной серы.
Соединения железа (III) также окисляют сероводород:
H2S + 2FeCl3 → 2FeCl2 + S + 2HCl
Бихроматы, хроматы и прочие окислители также окисляют сероводород до молекулярной серы:
Серная кислота окисляет сероводород либо до молекулярной серы:
Либо до оксида серы (IV):
4. Сероводород в растворе реагирует с растворимыми солями тяжелых металлов : меди, серебра, свинца, ртути, образуя черные сульфиды, нерастворимые ни в воде, ни в минеральных кислотах.
Взаимодействие с нитратом свинца в растворе – это качественная реакция на сероводород и сульфид-ионы.
Видеоопыт взаимодействия сероводорода с нитратом свинца можно посмотреть здесь.
Химические свойства прочих водородных соединений
Кислоты образуют в водном растворе: водородные соединения VIA (кроме воды) и VIIA подгрупп.
Прочитать про химические свойства галогеноводородов вы можете здесь.
Физические свойства
Молекулы воды связаны водородными связями: nH2O = (Н2O)n, поэтому вода жидкая в отличие от ее газообразных аналогов H2S, H2Se и Н2Те.
Химические свойства
1.1. С активными металлами вода реагирует при комнатной температуре с образованием щелочей и водорода :
2Na + 2H2O → 2NaOH + H2
Ag + Н2O ≠
3. Вода взаимодействует с кислотными оксидами (кроме SiO2):
4. Некоторые соли реагируют с с водой. Как правило, в таблице растворимости такие соли отмечены прочерком :
6. Бинарные соединения неметаллов также гидролизуются водой.
6. Некоторые органические вещества гидролизуются водой или вступают в реакции присоединения с водой (алкены, алкины, алкадиены, сложные эфиры и др.).
Водород
Степени окисления
Получение
Химические свойства
В реакциях водород проявляет себя как восстановитель и окислитель. Как восстановитель реагирует с элементами, электроотрицательность которых выше, чем у водорода:
H2 + F2 → HF (со взрывом в темноте)
H2 + Cl2 → (t) HCl (со взрывом только на свету)
Na + H2 → NaH (гидрид натрия)
Металлы, стоящие в ряду активности до водорода, вытесняют водород из воды.
Кристаллогидраты
В задачах бывает дана масса медного купороса. Надо помнить о том, что часто в реакции не участвует кристаллическая вода. В таком случае следует вычесть кристаллизационную воду и найти массу безводного сульфата калия.
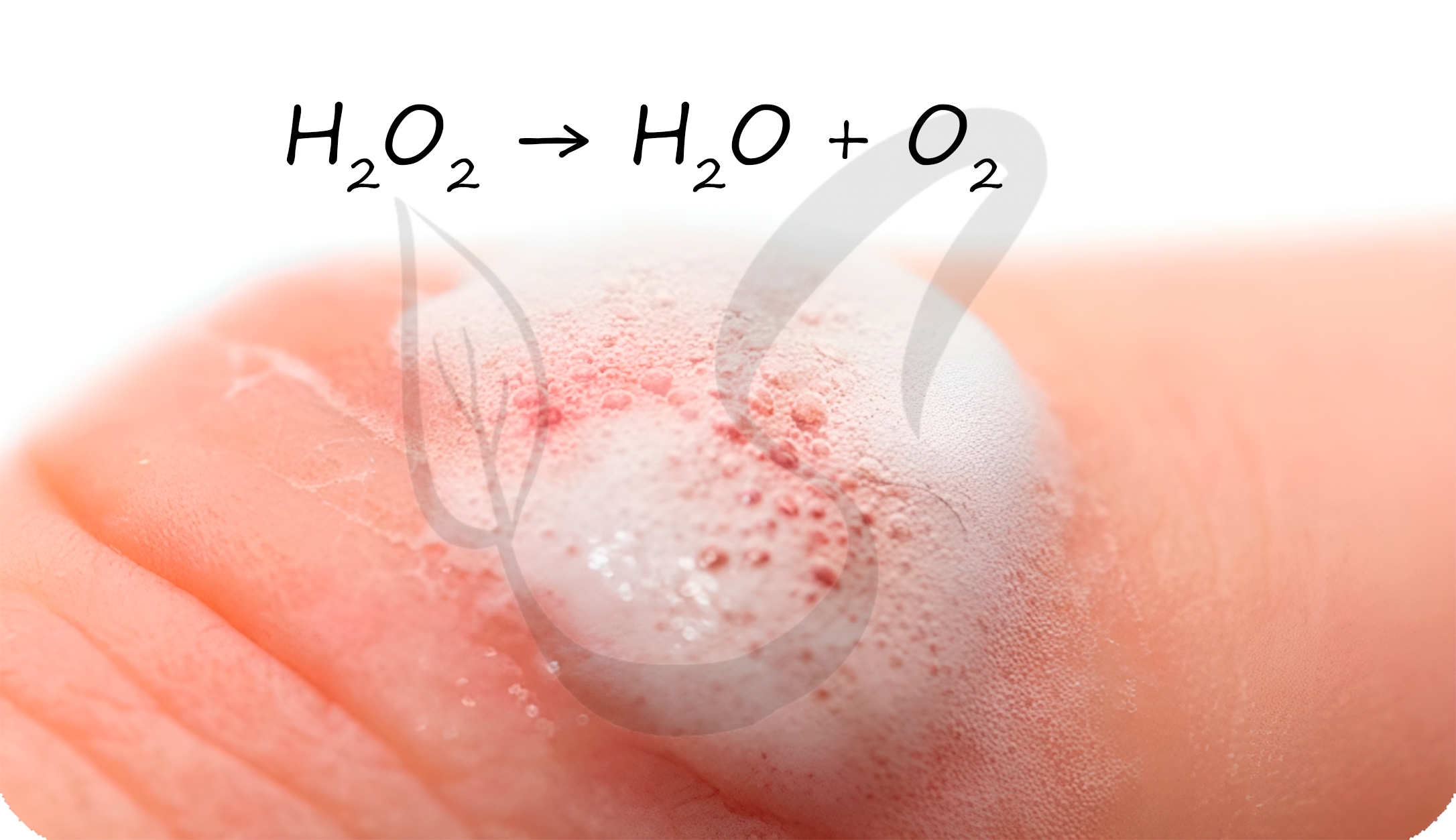
Пероксид водорода
Представляет собой бесцветную жидкость с металлическим вкусом. Концентрированные растворы пероксида водорода взрывоопасны.
Получают пероксид водорода в реакции с пероксидами и супероксидами металлов.
В разбавленных растворах пероксид водорода легко разлагается:
Также перекись проявляет окислительные свойства:
Перекисью водорода обрабатывают раневую поверхность. Выделяющийся при разложении атомарный кислород разрушает бактериальные клетки, предотвращая осложнение в виде бактериальной инфекции.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Водород. Физические и химические свойства, получение

Водород занимает первое место в периодической системе (Z = 1). Он имеет простейшее строение атома: ядро атома – 1 протон, окружено электронным облаком, состоящим из 1 электрона.
В одних условиях водород проявляет металлические свойства (отдает электрон), в других — неметаллические (принимает электрон).
В природе встречаются изотопы водорода: 1Н — протий (ядро состоит из одного протона), 2Н — дейтерий (D — ядро состоит из одного протона и одного нейтрона), 3Н — тритий (Т — ядро состоит из одного протона и двух нейтронов).
Простое вещество водород
Молекула водорода состоит из двух атомов, связанных между собой ковалентной неполярной связью.
Физические свойства. Водород — бесцветный нетоксичный газ без запаха и вкуса. Молекула водорода не полярна. Поэтому силы межмолекулярного взаимодействия в газообразном водороде малы. Это проявляется в низких температурах кипения (-252,6 0С) и плавления (-259,2 0С).
Водород легче воздуха, D (по воздуху) = 0,069; незначительно растворяется в воде (в 100 объемах H2O растворяется 2 объема H2). Поэтому водород при его получении в лаборатории можно собирать методами вытеснения воздуха или воды.
Получение водорода
1.Действие разбавленных кислот на металлы:
Zn +2HCl → ZnCl2 +H2↑
2.Взаимодействие щелочных и щ-з металлов с водой:
Ca +2H2O → Ca(OH)2 +H2↑
3.Гидролиз гидридов: гидриды металлов легко разлагаются водой с образованием соответствующей щелочи и водорода:
NaH +H2O → NaOH +H2↑
СаH2 + 2Н2О = Са(ОН)2 + 2Н2↑
5. Электролиз воды. Для увеличения электрической проводимости воды к ней добавляют электролит, например NаОН, Н2SO4 или Na2SO4. На катоде образуется 2 объема водорода, на аноде — 1 объем кислорода.
2H2O → 2H2+О2
Промышленное получение водорода
1. Конверсия метана с водяным паром, Ni 800 °С (самый дешевый):
CH4 + H2O → CO + 3 H2
CO + H2O → CO2 + H2
2. Пары воды через раскаленный кокс при 1000 о С:
С + H2O → CO + H2
CO +H2O → CO2 + H2
Образующийся оксид углерода (IV) поглощается водой, этим способом получают 50 % промышленного водорода.
3. Нагреванием метана до 350°С в присутствии железного или никелевого катализатора:
СH4 → С + 2Н2↑
4. Электролизом водных растворов KCl или NaCl, как побочный продукт:
2Н2О + 2NaCl→ Cl2↑ + H2↑ + 2NaOH
Химические свойства водорода
1) С галогенами образует галогеноводороды:
Н2 + Cl2 → 2НСl.
При этом с фтором — взрывается, с хлором и бромом реагирует лишь при освещении или нагревании, а с йодом только при нагревании.
2) С кислородом:
2Н2 + О2 → 2Н2О
с выделением тепла. При обычных температурах реакция протекает медленно, выше 550°С — со взрывом. Смесь 2 объемов Н2 и 1 объема О2 называется гремучим газом.
3) При нагревании энергично реагирует с серойь(значительно труднее с селеном и теллуром):
Н2 + S → H2S (сероводород),
4) С азотом с образованием аммиака лишь на катализаторе и при повышенных температурах и давлениях:
ЗН2 + N2 → 2NН3
5) С углеродом при высоких температурах:
2Н2 + С → СН4 (метан)
Со сложными веществами:
7) С оксидами металлов (используется для восстановления металлов):
CuO + H2 → Cu + H2O
Fe3O4 + 4H2 → 3Fe + 4Н2О
8) с оксидом углерода (II):
CO + 2H2 → CH3OH
Синтез — газ (смесь водорода и угарного газа) имеет важное практическое значение, тк в зависимости от температуры, давления и катализатора образуются различные органические соединения, например НСНО, СН3ОН и другие.
9)Ненасыщенные углеводороды реагируют с водородом, переходя в насыщенные:
СnН2n + Н2 → СnН2n+2.
Водород, свойства атома, химические и физические свойства
Водород, свойства атома, химические и физические свойства.
Водород — первый элемент периодической системы химических элементов Д. И. Менделеева с атомным номером 1. Расположен в 1-й группе, первом периоде периодической системы.
Атом и молекула водорода. Формула водорода. Строение атома водорода:
Водород (лат. hydrogenium, от др.-греч. ὕδωρ – «вода» и γεννάω – «рождаю», т.е. «рождающий воду») – первый элемент периодической системы химических элементов Д. И. Менделеева с обозначением H и атомным номером 1. Расположен в 1-й группе, первом периоде периодической системы.
Водород обозначается символом Н.
Как простое вещество водород при нормальных условиях представляет собой двухатомный газ без цвета, вкуса и запаха.
Молекула водорода двухатомна.
Химическая формула водорода Н2.
Строение атома водорода – вокруг ядра, состоящего из одного протона, вращается по единственной s-орбитали один электрон. Гелий относится к элементам s-семейства.
Радиус атома водорода (вычисленный) составляет 53 пм.
Атомная масса атома водорода составляет 1,00784-1,00811 а. е. м.
При высокой температуре молекула водорода Н2 диссоциирует на атомарный водород. При 2000 К на атомарный водород диссоциирует 0,081% молекулярного водорода, при 3000 К – 7,85%, при 5000 К – 95,5%. Переход в атомарное состояние вызывается также электрическим разрядом или под действием излучения с длиной волны менее 85 нм. Распад на атомы требует затраты энергии 104,2 ккал/моль при 25 о С. Под давлением 0,2 мм.рт.ст. атомарный водород может существовать около 1 секунды.
Атомарный водород значительно химически активнее молекулярного.
Изотопы и модификации водорода. Протий, дейтерий, тритий. Ортоводород, параводород:
Молекулярный водород существует в двух спиновых формах (модификациях): ортоводород и параводород. Модификации немного различаются по физическим свойствам, оптическим спектрам, также по характеристикам рассеивания нейтронов. В молекуле ортоводорода o-H2 (температура плавления −259,10 °C, температура кипения −252,56 °C) спины ядер параллельны, а у параводорода p-H2 (температура плавления −259,32 °C, температура кипения −252,89 °C) — противоположно друг другу (антипараллельны). Равновесная смесь o-H2 и p-H2 при заданной температуре называется равновесный водород e-H2.
При комнатной температуре водород представляет собой равновесную смесь орто-Н2 (75%) и пара-Н2 (25%) форм. При очень низких температурах равновесие между ортоводородом и параводородом почти нацело сдвинуто в сторону параводорода, так как энергия пара-молекулы немного ниже энергии орто-молекулы. При 80 К соотношение модификаций приблизительно 1:1.
Разделить две формы водорода возможно путем адсорбции на активном угле при температуре жидкого азота. При этом активный уголь катализирует превращение ортоводорода в параводород. Десорбированный с угля параводород при комнатной температуре превращается в ортоводород до образования равновесной смеси (75:25), однако это превращение без катализатора происходит медленно, что дает возможность изучить свойства отдельных аллотропных форм.
Водород имеет три природных изотопа: 1 H – протий, 2 H – дейтерий и 3 H – тритий (радиоактивен).
Ядро самого распространённого изотопа – протия ( 1 H) – состоит из одного только протона и не содержит нейтронов.
Ядро дейтерия ( 2 H) состоит из одного протона и одного нейтрона.
Ядро трития ( 3 H) состоит из одного протона и двух нейтронов.
Эти изотопы имеют собственные химические символы: протий – H, дейтерий – D, тритий – T.
Протий и дейтерий стабильны. Содержание этих изотопов в природном водороде составляет 99,9885 ± 0,0070 % и 0,0115 ± 0,0070 % соответственно. Оно может незначительно меняться в зависимости от источника и способа получения водорода.
Природный молекулярный водород состоит из молекул H2 и HD (дейтероводород) в соотношении 3200:1. Содержание в нём молекул из чистого дейтерия D2 ещё меньше, отношение концентраций HD и D2 составляет примерно 6400:1.
Физические свойства изотопов водорода (плотность, температура плавления, температура кипения, критическая температура, критическое давление и пр.) отличаются друг от друга наиболее сильно. Это связано с наибольшим относительным изменением масс атомов.
Искусственно получены также другие – тяжёлые радиоактивные изотопы водорода с массовыми числами 4-7 и периодами полураспада 10 −21 −10 −23 с:
– 4 H, состоящий из одного протона и трех нейтронов,
– 5 H, состоящий из одного протона и четырех нейтронов,
– 6 H, состоящий из одного протона и пяти нейтронов,
– 7 H, состоящий из одного протона и шести нейтронов.
Молекулы водорода могут быть образованы как чистыми изотопами H2, D2, T2, так и смешанным составом: HD, HT, DT.
Молекулы чистых протия, дейтерия и трития могут существовать в двух аллотропных модификациях (отличающихся взаимной ориентацией спинов ядер) – орто- и параводород: o-D2, p-D2, o-T2, p-T2. Молекулы водорода с другим изотопным составом (HD, HT, DT) не имеют орто- и парамодификаций.
Свойства водорода (таблица): температура, плотность, давление и пр.:
| 100 | Общие сведения | |
| 101 | Название | Водород |
| 102 | Прежнее название | |
| 103 | Латинское название | Hydrogenium |
| 104 | Английское название | Hydrogen |
| 105 | Символ | Н |
| 106 | Атомный номер (номер в таблице) | 1 |
| 107 | Тип | Неметалл |
| 108 | Группа | |
| 109 | Открыт | Генри Кавендиш, Великобритания, 1766 г. |
| 110 | Год открытия | 1766 г. |
| 111 | Внешний вид и пр. | Газ без цвета, запаха и вкуса |
| 112 | Происхождение | Природный материал |
| 113 | Модификации | o-H2 – ортоводород, p-H2 – параводород |
| 114 | Аллотропные модификации | |
| 115 | Температура и иные условия перехода аллотропных модификаций друг в друга | |
| 116 | Конденсат Бозе-Эйнштейна | |
| 117 | Двумерные материалы | |
| 118 | Содержание в атмосфере и воздухе (по массе) | 0,00008 % |
| 119 | Содержание в земной коре (по массе) | 0,15 % |
| 120 | Содержание в морях и океанах (по массе) | 11 % |
| 121 | Содержание во Вселенной и космосе (по массе) | 75 % |
| 122 | Содержание в Солнце (по массе) | 75 % |
| 123 | Содержание в метеоритах (по массе) | 2,4 % |
| 124 | Содержание в организме человека (по массе) | 10 % |
| 200 | Свойства атома | |
| 201 | Атомная масса (молярная масса)* | 1,00784-1,00811 а. е. м. (г/моль) |
| 202 | Электронная конфигурация | 1s 1 |
| 203 | Электронная оболочка | K1 L0 M0 N0 O0 P0 Q0 R0 |
| 204 | Радиус атома (вычисленный) | 53 пм |
| 205 | Эмпирический радиус атома | 25 пм |
| 206 | Ковалентный радиус* | 31 пм |
| 207 | Радиус иона (кристаллический) | H + 0,1815 Вт/(м·К) (при 300 K) |
| 500 | Кристаллическая решётка | |
| 511 | Кристаллическая решётка #1 | |
| 512 | Структура решётки | Гексагональная |
| 513 | Параметры решётки | a = 3,780 Å, c = 6,167 Å |
| 514 | Отношение c/a | 1,631 |
| 515 | Температура Дебая | 110 K |
| 516 | Название пространственной группы симметрии | P63/mmc |
| 517 | Номер пространственной группы симметрии | 194 |
| 900 | Дополнительные сведения | |
| 901 | Номер CAS | 12385-13-6 |
201* Указан диапазон значений атомной массы в связи с различной распространённостью изотопов данного элемента в природе.
206* Ковалентный радиус водорода согласно [1] и [3] составляет 31±5 пм и 32 пм соответственно.
408* Удельная теплота испарения (энтальпия кипения ΔHкип) водорода согласно [4] составляет 0,916 кДж/моль.
410* Молярная теплоемкость водорода согласно [3] составляет 28,47 Дж/(K·моль).
Физические свойства водорода:
При стандартных температуре и давлении водород – бесцветный, не имеющий запаха и вкуса, нетоксичный двухатомный газ с химической формулой H2.
Водород – самый лёгкий газ. Он легче воздуха в 14,5 раз. Поэтому, например, мыльные пузыри, наполненные водородом, на воздухе стремятся вверх.
Плотность водорода (Н2) составляет 0,00008988 г/см 3 при 20 °C и иных стандартных условиях ; а также 0,0000899 г/см 3 при 0 °C и иных стандартных условиях .
Общеизвестно, что чем меньше масса молекул, тем выше их скорость при одной и той же температуре. Как самые лёгкие, молекулы водорода движутся быстрее молекул любого другого газа и тем самым быстрее могут передавать теплоту от одного тела к другому. Отсюда следует, что водород обладает самой высокой теплопроводностью среди газообразных веществ. Теплопроводность водорода при 300 K составляет 0,1815 Вт/(м·К). Теплопроводность водорода примерно в 7 раз выше теплопроводности воздуха – 0,0243 Вт/(м·К).
Водород (Н2) почти не растворяется в воде и органических растворителях. Так, растворимость водорода в воде составляет 0,000157 г/100 г (при температуре 25 °C).
Водород растворяется в металлах: алюминии, железе, никеле, палладии, платине, практически не растворим в серебре. Растворимость в железе и меди мешает при выплавке этих металлов, так как приводит к образованию пустот. Так, растворимость водорода в железе (объемов водорода на объем железа) составляет: при 500 о С – 0,05; при 700 о С – 0,14; при 900 о С – 0,37; при 1100 о С – 0,55; при 1200 о С – 0,65; при 1350 о С – 0,80; при 1450 о С – 0,87; при 1550 о С – 2,05. Растворимость водорода в палладии составляет 850 объёмов H2 на 1 объём Pd.
При обычных условиях и выше −80 о С при расширении водород разогревается, а не охлаждается как большинство газов (“нормально” он начинает себя вести ниже −80 о С).
При комнатной температуре водород представляет собой равновесную смесь орто-Н2 (75%) и пара-Н2 (25%) форм. В молекулах ортоводорода (температура плавления −259,10 °C, температура кипения −252,56 °C) ядерные спины направлены одинаково, а у параводорода (температура плавления −259,32 °C, температура кипения −252,89 °C) – противоположно друг другу.
Температура кипения водорода (Н2) составляет −252,77 °C [согласно https://ru.wikipedia.org/wiki/Водород)].
Жидкий водород существует в очень узком интервале температур от −252,77 до −259,19 °C. Жидкий водород – это бесцветная жидкость, очень лёгкая (плотность при −253 °C составляет 0,0708 г/см³) и текучая (вязкость при −253 °C 13,8 сП). В жидком состоянии равновесный водород состоит из 99,79 % пара-Н2, 0,21 % орто-Н2.
Температура плавления водорода (Н2) составляет −259,19 °C [согласно https://ru.wikipedia.org/wiki/Водород)].
Твёрдый водород, температура плавления −259,19 °C, плотность 0,0807 г/см³ (при −262 °C) – снегоподобная масса, кристаллы гексагональной сингонии, пространственная группа P6/mmc, параметры ячейки a = 0,378 нм и c = 0,6167 нм.
Температура разложения водорода (Н2) составляет 1700-5000 °C.
Критические параметры водорода (Н2) очень низкие: критическая температура водорода −239,91 °C и критическое давление водорода 1,297 МПа [согласно https://ru.wikipedia.org/wiki/Водород)]. Этим объясняются трудности при сжижении водорода.
Скорость звука в водороде (Н2) составляет: 1284 м/с (при 0 °C, состояние вещества – газ), 1301 м/с (при 18 °C, состояние вещества – газ), 1463 м/с (при 100 °C, состояние вещества – газ).
Водород коррозионно неактивен.
В смеси с воздухом и кислородом водород пожаровзрывоопасен, что обусловлено низким значением минимальной энергии зажигания водородно-воздушной смеси (0,017 мДж), высоким значением минимальной теплоты сгорания (121000 кДж/кг) и широкой областью горения и детонации.
Химические свойства водорода. Взаимодействие водорода. Реакции с водородом:
При нормальных условиях водород химически малоактивен.
Химические свойства водорода связаны со строением его электронной оболочки: в атоме один валентный электрон (как у щелочных металлов), а для завершения внешнего электронного слоя не хватает одного электрона (как у атомов гелия и других галогенов).
Поэтому в химических реакциях атом водорода может отдавать или принимать электрон, проявляя при этом в соединениях как положительную, так и отрицательную степени окисления: +1, 0 или –1.
Степень окисления +1 водород проявляет в соединениях с более электроотрицательными неметаллами (H2O, NH3, HCl и пр.); степень окисления 0 водород проявляет в молекулах протия H2, дейтерия D2, трития T2, протодейтерия HD, прототрития HT и дейтеротрития DT, т.к. эти молекулы образуются за счет ковалентных неполярных связей; степень окисления –1 водород проявляет в соединениях с металлами, кремнием и бором (NaH, LiH, Ca2H, SiH4 и пр.).
В соединениях с неметаллами водород образует ковалентную связь, в соединениях с металлами – ионную связь. В газообразном состоянии водород находится в виде двухатомных молекул, соединенных неполярной ковалентной связью.
Поскольку для водорода возможны положительная и отрицательная степени окисления, водород может проявлять и восстановительные, и окислительные свойства.
Проявляя окислительные свойства, водород взаимодействует с активными металлами.
Проявляя восстановительные свойства, водород взаимодействует с оксидами и галогенидами. В соединениях водород гораздо сильнее проявляет свои восстановительные свойства, чем окислительные. Водород является самым сильным восстановителем после угля, алюминия и кальция. Это свойство используются в промышленности для получения металлов и неметаллов (простых веществ) из оксидов.
Атомарный водород значительно химически активнее молекулярного.
Химическая активность водорода увеличивается при повышении температуры, под действием ультрафиолетового и радиоактивного излучений.
Получение водорода:
Водород может быть получен в результате:
Применение водорода:
Водород используется во многих областях промышленности и быту:
– в химической промышленности при получении некоторых металлов;
– в нефтеперерабатывающей промышленности в процессах гидрокрекинга и гидроочистки Он способствует увеличению глубины переработки сырой нефти и повышению качества конечных продуктов;
– в пищевой промышленности для производства твердых жиров из растительных масел. Водород зарегистрирован в качестве пищевой добавки E949;
– в атомной энергетике;
– в качестве ракетного топлива;
– для сварки и резки металлов при высокой температуре. Температура горения водорода в кислороде составляет 2600 °C.