лиценопс что за болезнь
Лейциноз – наследственная болезнь, в основе которой лежит дефицит дегидрогеназ кетокислот с разветвленной цепью, а также нарушение метаболизма аминокислот лейцина, изолейцина и валина. Проявляется патологической слабостью, тихим плачем, рвотой, мышечными подергиваниями, характерным «кленовым» запахом мочи, задержкой психомоторного развития. При кризе возникают нарушения дыхания и кровообращения, потеря сознания. Диагностика включает анализ на аминокислоты и производные (кровь, моча), молекулярное-генетическое исследование и скрининговые пробы мочи. Для лечения используется диета с протеиновыми смесями, освобожденными от разветвленно-цепочечных аминокислот (BCAA).
МКБ-10
Общие сведения
Синонимы лейциноза – болезнь разветвленных кислот, разветвленноцепочечная кетонурия, короткоцепочечная кетоацидурия, болезнь мочи с запахом кленового сиропа, болезнь кленового сиропа. Происхождение синонимичных названий связано с историей исследования данной патологии. В начале 1954 года австрийско-американский детский невролог Дж. Х. Менкес впервые описал заболевание, при котором у больных определялся специфический запах мочи, схожий с запахом древесного сиропа и жженого сахара. Еще одно, менее распространенное название – синдром Менкеса. Болезнь отнесена к категории редких (орфанных, «сиротских») патологий. Диагностируется с частотой 1 случай на 120-300 тысяч новорожденных.
Причины лейциноза
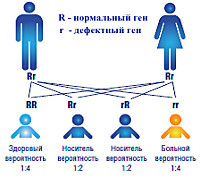
Развитие болезни обусловлено наличием пары мутационных генов, кодирующих производство дегидрогеназы разветвленных альфа-кетокислот. При недостаточности этого фермента нарушается процесс катаболического распада лейцина, аллоизолейцина, изолейцина, валина. Структура дегидрогеназы представлена четырьмя белковыми соединениями: Е3, Е2, альфа-субъединицей E1, бета-субъединицей Е1. Выявлена локализация генов, ответственных за синтез компонентов энзимных комплексов: a-субъединицу протеина E1 кодирует ген BCKDHA на 19 хромосоме, b-субъединицу E1 – ген BCKDHB на 6 хромосоме, Е2-протеин – ген DBT на 1 хромосоме, протеин Е3 – ген DLD на 7 хромосоме. Наследственная передача происходит аутосомно-рецессивно, заболевание проявляется у ребенка, получившего пару мутантных генов одной локализации. При передаче мутации только от одного родителя симптоматика отсутствует, потому что доминантный ген обеспечивает организм необходимым количеством фермента.
Патогенез
В основе заболевания лежит генетическая недостаточность дегидрогеназ кетокислот, имеющих боковые цепи. В жидкостях организма накапливаются разветвленно-цепочечные аминокислоты и их производные: 2-кетоизокапроновая, 2-кето-3-метилвалериановая и 2-кетоизвалериановая кислоты. Избыток лейцина и его метаболитов оказывает нейротоксическое действие. При этом возникает дефицит других аминокислот, таких как аланин, глицин, глутамин, тирозин, триптофан. Нарушается их транспорт внутри клеток, формируются расстройства нейромедиаторной передачи. Развивается кетоацидоз, гипогликемия на фоне снижения глюконеогенеза, гипонатриемия, гипераммониемия, угнетаются процессы окислительного фосфорилирования.
При форме лейциноза, вызванной деструкцией протеина E3, патогенез более сложен. Данная субъединица является компонентом нескольких ферментных комплексов, которые принимают участие в метаболизме пирувата и осуществлении цикла Кребса. В результате структурного и функционального дефекта этих комплексов меняется энергетический обмен клеток, возникает лактатацидоз.
Классификация
На начальных этапах исследования лейциноз описывался как быстро прогрессирующее, развивающееся с первых дней жизни и неизбежно приводящее к летальному исходу заболевание. Позже было установлено, что существует несколько разновидностей патологии с разным временем дебюта, течением и прогнозом. В настоящее время выделяют пять форм лейциноза:
Симптомы лейциноза
У детей с классической формой заболевания симптоматика появляется в первую неделю жизни. Начало всегда острое. Дебют лейциноза характеризуется резким ухудшением общего состояния новорожденного – развитием генерализованных судорог, патологической возбудимости, гипертонии мышц, неукротимой рвоты, обезвоженности. Ребенок кричит, отказывается есть. Состояние возбужденности сменяется патологической вялостью. Обнаруживаются признаки угнетения ЦНС, нарастает сомноленция, а затем кома. Поверхность кожи слущивается, покрывается эритемами. Моча пахнет кленовым сиропом. Ребенок чрезмерно уязвим в отношении инфекций, отстает в психическом, моторном развитии. Заболевание завершается скорой смертью, основной причиной которой становится отек головного мозга.
При интермиттирующей форме приступы сопровождаются возникновением мозжечковой атаксии – у больного нарушается походка и координация движений. Между приступами клиническая симптоматика отсутствует. Промежуточный лейциноз протекает тяжелее. Приступы не имеют четких временных границ, волнообразно нарастают и затихают. Дети отстают в развитии, страдают от атаксии, судорог и мышечной гипотонии, поздно осваивают ходьбу, манипулятивные действия, речь. Симптомы тиаминзависимой формы могут быть легкими или умеренными. Как и двух предыдущих вариантах, доминируют признаки нарушения походки и координации движений, мышечный тонус снижен, возможны судороги. У пациентов с Е3-зависимой формой наблюдается прогрессирующее отставание моторного и психического развития, рвота, мышечный гипотонус, расстройства дыхания. Периодически выявляется гипогликемия с апатией, слабостью, головокружениями, повышенной сонливостью.
Осложнения
При совместимых с жизнью формах лейциноза основным осложнением является отставание в психическом и физическом развитии. Выраженность нарушений варьируется: иногда больные способны к самообслуживанию, ведут автономный образ жизни, посещают школу, в других случаях нуждаются в постоянном уходе, с трудом осваивают простые двигательные навыки и речь. Отсутствие медицинской помощи пациентам с острой формой лейциноза и при кризах приводит к тяжелым осложнениям – отеку мозга, острой недостаточности почек и печени. Данные состояния становятся причиной смерти больных.
Диагностика
Обследованию на лейциноз подлежат все дети с отягощенным семейным анамнезом, особенно если диагноз был подтвержден у старших братьев и сестер, а также если у новорожденного после периода удовлетворительного состояния проявились характерные симптомы: отказ от еды, рвота, судороги, патологическое возбуждение или летаргия, атаксия, кома, ацидоз. Диагностика осуществляется специалистами разных направлений: педиатрами, неврологами, врачами-генетиками. На начальном этапе проводится изучение анамнеза и жалоб родителей, общий осмотр ребенка с определением мышечного тонуса и веса, оценкой двигательной активности. С целью подтверждения диагноза, исключения гипоксических поражений ЦНС, внутримозговых кровоизлияний, острых инфекций и наследственных патологий обмена веществ назначаются лабораторные исследования:
Лечение лейциноза
Терапевтическая тактика ориентирована на подавление производства токсичных метаболитов BCAA, стимуляцию процессов анаболизма, снижение скорости кетоацидоза, предупреждение отека мозга и поражения внутренних органов. Лечебные мероприятия всем больным проводятся в плановом режиме, при развитии острого криза – в экстренном порядке. Плановые процедуры включают:
Метаболический криз требует немедленной госпитализации и проведения интенсивной терапии. Больных полностью переводят на питание из смеси аминокислот. При отказе от пищи или частой рвоте используют зонд, гастростому. Высокая калорийность питания обеспечивается введением растворов глюкозы и мальтодекстрина. Токсические продукты метаболизма удаляют с помощью перитонеального диализа и гемодиализа. При отеке головного мозга вводят гипертонический солевой раствор, диуретики.
Прогноз и профилактика
Классическая (острая) форма лейциноза характеризуется тяжелым прогрессивным течением. Ее прогноз неблагоприятен, эффективная терапия не разработана, сохраняется высокий риск летального исхода. При других вариантах болезни строгое соблюдение диеты и назначение медикаментозной терапии позволяет повысить качество жизни больных, сократить отставание общего развития, улучшить социальную адаптацию. Профилактика заключается в проведении пренатальной диагностики – определении аминокислотного состава амниотической жидкости, молекулярно-генетическом исследовании полученного при биопсии хориона материала с выявлением мутаций соответствующих генов.
Лейциноз
Заболевание лейциноз называют еще «болезнью кленового сиропа» из-за характерного запаха мочи. Данная проблема связана с нарушением обмена аминокислот. В результате, в моче обнаружено повышенное количество вещества лейцина.
Данное заболевание встречается крайне редко, его часто очень сложно диагностировать ввиду того, что недуг может протекать практически бессимптомно у детей грудного возраста.
Различают несколько вариантов лейциноза:
Причины
Лейциноз – это наследственное заболевание. Основными причинами данного недуга являются следующие факторы:
Симптомы лейциноза
Главными симптомами заболевания лейциноз принято считать такие проявления:
Как правило, заболевание проявляется на 3-14 сутки после рождения ребенка.
Если Вы обнаружили у себя схожие симптомы, незамедлительно обратитесь к врачу. Легче предупредить болезнь, чем бороться с последствиями.
Лучшие врачи по лечению лейциноза
Диагностика
Для диагностики лейциноза необходимо выполнить следующие манипуляции:
Лечение лейциноза
Чем раньше приняты меры по лечению лейциноза, тем более благоприятный прогноз выздоровления пациента. Основные моменты в лечении таковы:
Опасность
При тяжелом течении болезни могут наступать обморочные состояния и нарушение дыхания. Если не принимать комплексные меры по лечению болезни, прогноз заболевания неблагоприятный. Во избежание физического и психомоторного развития малыша, следует принимать экстренные меры после точной диагностики.
Профилактика
Профилактических мер данное заболевание не имеет. Но при своевременной диагностике и комплексном лечении возможно полное выздоровление пациента.
Данная статья размещена исключительно в познавательных целях и не является научным материалом или профессиональным медицинским советом.
Текст утверждён врачом-эндокринологом Жестовский Сергей Серафимович
Лейциноз (болезнь кленового сиропа)
Впервые это заболевание описано в 1954 г. В английской и американской литературе оно больше известно под названием болезни кленового сиропа из-за запаха мочи, который похож на запах сиропа из кленового дерева.
Что провоцирует / Причины Лейциноза (болезни кленового сиропа):
Наследственное заболевание с аутосомно-рецессивным типом наследования встречается с частотой 1 на 120-300 тыс. новорождённых.
Патогенез (что происходит?) во время Лейциноза (болезни кленового сиропа):
Симптомы Лейциноза (болезни кленового сиропа):
Заболевание начинает проявляться через 3-14 дней после рождения ребенка: малыш отказывается от пищи, тихо плачет, могут быть частые срыгивания и даже рвота. Если не обратиться за врачебной помощью, могут развиться подергивания отдельных групп мышц, мышечный тонус увеличивается, в связи с чем все тело вытягивается, а нижние конечности скрещиваются.
При тяжелом течении болезни могут наступить нарушения дыхания и сознания, и, если с первых недель жизни лечение не проводилось, прогноз заболевания плохой. Такие дети резко отстают в весе и психомоторном развитии.
Диагностика Лейциноза (болезни кленового сиропа):
Лечение Лейциноза (болезни кленового сиропа):
Состоит в снижении уровня лейцина, изолейцина и валина в плазме крови, для чего применяется специальная диета, в которой вместо белка назначается особая микстура, состоящая из смеси 18 аминокислот в той пропорции, как и в женском молоке. Жиры в такой смеси присутствуют в виде кукурузного масла, а углеводы заменяются декстрин-мальтозой. Также добавляются минеральные вещества и витамины. Как только общее состояние ребенка улучшается, появляется аппетит, нормализуется мышечный тонус, в рацион вводится небольшое количество коровьего молока. Фрукты и овощи, которые также содержат белок, но в небольшом количестве, разрешается давать ребенку уже с 3 месяцев. В 6-8 месяцев в рацион вводят желатин, который не содержит указанных аминокислот. С 9,5 месяцев ежедневная порция молока составляет 120 мл.
К каким докторам следует обращаться если у Вас Лейциноз (болезнь кленового сиропа):
Вас что-то беспокоит? Вы хотите узнать более детальную информацию о Лейциноза (болезни кленового сиропа), ее причинах, симптомах, методах лечения и профилактики, ходе течения болезни и соблюдении диеты после нее? Или же Вам необходим осмотр? Вы можете записаться на прием к доктору – клиника Euro lab всегда к Вашим услугам! Лучшие врачи осмотрят Вас, изучат внешние признаки и помогут определить болезнь по симптомам, проконсультируют Вас и окажут необходимую помощь и поставят диагноз. Вы также можете вызвать врача на дом. Клиника Euro lab открыта для Вас круглосуточно.
Как обратиться в клинику:
Телефон нашей клиники в Киеве: (+38 044) 206-20-00 (многоканальный). Секретарь клиники подберет Вам удобный день и час визита к врачу. Наши координаты и схема проезда указаны здесь. Посмотрите детальнее о всех услугах клиники на ее персональной странице.
Если Вами ранее были выполнены какие-либо исследования, обязательно возьмите их результаты на консультацию к врачу. Если исследования выполнены не были, мы сделаем все необходимое в нашей клинике или у наших коллег в других клиниках.
Если Вы хотите задать вопрос врачу – воспользуйтесь разделом онлайн консультации, возможно Вы найдете там ответы на свои вопросы и прочитаете советы по уходу за собой. Если Вас интересуют отзывы о клиниках и врачах – попробуйте найти нужную Вам информацию в разделе Вся медицина. Также зарегистрируйтесь на медицинском портале Euro lab, чтобы быть постоянно в курсе последних новостей и обновлений информации на сайте, которые будут автоматически высылаться Вам на почту.
Помочь тем, кого нельзя обнять
Автор
Редактор
Статья на конкурс «био/мол/текст»: «Мальчик, который остался без кожи». Это не название очередного фильма ужасов. Это документальный фильм режиссера Патрика Коллертона, запечатлевшего последние месяцы жизни 36-летнего Джонни Кеннеди, страдавшего редким генетическим заболеванием — дистрофическим буллезным эпидермолизом. Фильм привлек внимание пяти миллионов зрителей по всей Великобритании и помог собрать 500 000 фунтов стерлингов на благотворительность для международной ассоциации DEBRA, чья деятельность направлена на изучение и лечение буллезного эпидермолиза. Жизнь людей с этим диагнозом и их родных — это путь, который осилит не каждый: он тяжел как физически, так и морально, и требует мужества и невероятной воли к жизни. Детей, страдающих этим недугом, называют детьми-бабочками, сравнивая хрупкость их кожи с хрупкостью крыла бабочки. Что же такое буллезный эпидермолиз и каковы прогнозы на будущее?
Обратите внимание!
Эта работа опубликована в номинации «лучшая обзорная статья» конкурса «био/мол/текст»-2015.
Спонсором номинации «Лучшая статья о механизмах старения и долголетия» является фонд «Наука за продление жизни». Спонсором приза зрительских симпатий выступила фирма Helicon.
Спонсоры конкурса: Лаборатория биотехнологических исследований 3D Bioprinting Solutions и Студия научной графики, анимации и моделирования Visual Science.
Я знаю только один способ быть в ладу с собственной совестью: этот способ — не уклоняться от страдания.
Антуан де Сент-Экзюпери
Что такое буллезный эпидермолиз?
Буллезный эпидермолиз (БЭ) — группа редких генетически и клинически гетерогенных заболеваний, характеризующихся образованием пузырей и эрозий на коже и слизистых оболочках в результате незначительной механической травмы [1].
Кожа человека состоит из трех слоев: наружного — эпидермиса, среднего — дермы — и самого нижнего — подкожно-жировой клетчатки (гиподермы) (рис. 1).
Рисунок 1. Строение кожи человека. Рисунок с сайта lechenie-simptomy.ru.
Эпидермис кожи человека состоит из пяти различных слоев эпителиальных клеток, или кератиноцитов, самый нижний из которых — базальный эпителий — прикрепляется к дерме с помощью множества разных белков (рис. 2). Эти белки не только определяют стабильность соединения клеток базального эпителия с дермой, но и их собственную прочность. Мутации в генах, кодирующих эти белки, приводят к снижению прочности этого соединения, делая кожу чрезвычайно чувствительной к механическим воздействиям. Даже самое легкое надавливание — трение швов одежды, нежные объятия матери — может привести к образованию пузырей и причинить нестерпимую боль (рис. 3) [1].
Рисунок 2. Белки, участвующие в патогенезе различных типов наследственного БЭ. ПБЭ — простой БЭ; ПогрБЭ — пограничный БЭ; ДБЭ — дистрофический БЭ; СК — синдром Киндлера; БМ — базальная мембрана. Рисунок из [1], с изменениями.
Рисунок 3. Микроструктура образца кожи больного БЭ. При БЭ соединение между эпидермисом и дермой непрочное. В результате механического воздействия эпидермис отслаивается от дермы. В месте повреждения увеличивается проницаемость капилляров, и жидкая часть крови (плазма), а также клетки, участвующие в воспалении (лейкоциты), выходят в рану — образуется воспалительный экссудат. В месте отслоения формируется пузырь, который увеличится в размерах, если его вовремя не проткнуть стерильной иглой. Рисунок с сайта dermaamin.com, с изменениями.
Как правило, заболевание заметно сразу после рождения ребенка или в первые месяцы его жизни. Каждый новый день — настоящее испытание для больных БЭ и их опекунов: смена повязок, защищающих хрупкую кожу от повреждений и закрывающих уже существующие раны, обработка ран антисептиками — эти жизненно важные, чрезвычайно болезненные и изнурительные процедуры являются практически единственной составляющей современного лечения БЭ. При тяжелых формах заболевание поражает помимо кожных покровов слизистые оболочки и даже внутренние органы. БЭ относится к так называемым орфанным, то есть редким, заболеваниям. Частота встречаемости различных типов БЭ варьирует от 1:30 000 до 1:1 000 000 и зависит от популяции [2].
Классификация
В зависимости от уровня, на котором происходит повреждение кожи, выделяют четыре типа БЭ: простой, пограничный, дистрофический и синдром Киндлера.
Простой БЭ относится к так называемому интраэпидермальному типу БЭ, то есть повреждения затрагивают только эпидермис. Простой БЭ развивается в результате мутаций в генах белков, обеспечивающих прочность клеток базального слоя эпителия (рис. 2). Пузыри образуются ближе к поверхности кожи. Это самая легкая форма БЭ, при которой происходит полноценное заживление ран. Пограничный и дистрофический БЭ относятся к субэпидермальным типам БЭ, поскольку затрагивают не только эпидермис, но и дерму. При этих типах БЭ поврежденными оказываются белки, участвующие непосредственно в соединении двух слоев кожи (рис. 4). Полноценного заживления ран не происходит — на месте нормальной кожи в конечном счете образуются рубцы. Пограничный БЭ, в свою очередь, подразделяется на два типа: Герлиц и не-Герлиц, первый из которых летален. Дистрофический же БЭ в зависимости от типа наследования подразделяется на доминантную и рецессивную формы. Синдром Киндлера относится к смешанному типу БЭ, поскольку пузыри образуются на разных уровнях [1].
Рисунок 4. Иммунофлуоресцентное картирование образца кожи пациента с рецессивным дистрофическим БЭ. Для картирования использовали антитела к коллагену VII (зеленый цвет). а — Пониженное количество коллагена VII в биоптате от пациента с рецессивным дистрофическим БЭ. б — Кожа здорового донора. Ядра клеток окрашены йодидом пропидия (красный цвет). Рисунок из [3], с изменениями.
Диагностика
Для того чтобы подтвердить диагноз БЭ, необходимо провести тщательное обследование пациента. Самым важным этапом диагностики является исследование биоптата поврежденных участков кожи. Для этого используют такие методы, как световая, флуоресцентная и электронная микроскопия, а также генетический анализ.
Исследование с помощью световой микроскопии позволяет отличить интраэпидермальный тип БЭ от субэпидермальных. Для более точного определения уровня повреждения используют электронную и флуоресцентную микроскопии. С помощью электронной микроскопии можно отличить рецессивную форму дистрофического БЭ от доминантной (рис. 5). Так, при рецессивном дистрофическом БЭ наблюдается значительное снижение или полное отсутствие продукции коллагена VII типа, в то время как при доминантном дистрофическом БЭ дефектный белок вырабатывается в нормальном или слегка сниженном количестве. Однако из-за трудоемкости методов электронной микроскопии в настоящее время на первый план выходит микроскопия флуоресцентная. С помощью окрашивания флуоресцентными антителами этот метод позволяет визуализировать белки, участвующие в патогенезе заболевания, а также оценить их продукцию и распределение (рис. 4) [3].
Рисунок 5. Ультраструктура образца поврежденного участка кожи пациента с рецессивным дистрофическим БЭ. Звездочками обозначены места разрывов, расположенные сразу под темной пластинкой базальной мембраны (бесклеточного слоя, отделяющего дерму от эпидермиса), на которую указывают «галочки». Стрелками обозначены участки с единичными фибриллами коллагена VII. Изображение получено методом электронной микроскопии. Рисунок из [3].
Но только генетический анализ (ДНК-диагностику) можно назвать оптимальным методом для определения типа наследования и специфических мутаций, имеющихся у больных БЭ, а также наиболее точным методом различения клинических форм простого, пограничного и дистрофического БЭ [4].
Существует также пренатальная (до рождения) диагностика БЭ, материалом для которой служит ДНК из околоплодной жидкости, забираемая в первом триместре беременности (до 11 недель) [4].
Лечение
К сожалению, в настоящее время БЭ неизлечим. Основная терапия направлена на предотвращение образования новых пузырей и эрозий, лечение ран и предотвращение их инфицирования. Главные задачи лечения — защита хрупкой кожи пациентов от механических воздействий (использование специальных повязок) и обработка уже существующих ран (применение антисептиков, наложение повязок).
Но наука не стоит на месте, и ученые всего мира отчаянно ищут лекарство от страшного недуга. Наиболее проработаны три перспективных вида терапии БЭ: протеиновая, клеточная и генная. Рассмотрим эти подходы подробнее.
Протеиновая терапия
При этом подходе в организм пациента вводится достаточное количество нормального белка. Исследования показали, что внутридермальное введение мышам с рецессивным дистрофическим БЭ очищенного человеческого коллагена VII приводит к формированию нормальных коллагеновых фибрилл в зоне соединения эпидермиса с дермой. При внутривенном введении очищенного белка наблюдается системное отложение коллагена VII в коже. Также было показано, что подобная терапия не только улучшает функциональное состояние кожи, но и способствует заживлению ран. Основываясь на результатах доклинических исследований, компания Lotus Tissue Repair, впоследствии вошедшая в состав Shire Pharmaceuticals, начала проведение расширенных доклинических исследований внутридермальных и внутривенных инъекций коллагена VII на модели рецессивного дистрофического БЭ у собак, а также первую стадию клинических исследований [3, 5].
Клеточная терапия
При этом способе лечения в организм пациента вводится необходимое и достаточное количество клеток, содержащих нормальный ген, кодирующий нужный белок.
Одним из перспективных видов клеточной терапии является внутридермальная инъекция аллогенных (полученных от здоровых доноров) фибробластов. Так, было показано, что подобный подход восстанавливает синтез коллагена VII и стабилизирует соединение эпидермиса с дермой в мышиной модели рецессивного дистрофического БЭ. Следующий шаг на пути к реализации этого вида терапии уже предпринят: нескольким пациентам с рецессивным дистрофическим БЭ были введены аллогенные фибробласты. И хотя спустя две недели после инъекции введенные клетки не обнаруживались, уровень продукции коллагена оставался повышенным как через две недели, так и через три месяца. Ученые считают, что основной терапевтический эффект инъекции аллогенных фибробластов заключается в увеличении продукции эпидермального фактора роста HB-EGF, а также в увеличении экспрессии гена коллагена VII в кератиноцитах и фибробластах реципиента. Однако механизм этого явления пока не установлен [3, 6].
Аллогенная трансплантация костного мозга также может быть перспективным способом лечения БЭ. Так, на мышиной модели рецессивного дистрофического БЭ было показано, что трансплантация костного мозга приводит к облегчению симптомов болезни. Вслед за обнадеживающими результатами были начаты клинические испытания подобного метода терапии. Однако пока результаты неутешительны: пять из двадцати пациентов умерли от прогрессии заболевания или осложнений после трансплантации [3, 6].
Генная терапия
Наконец, последний и, пожалуй, самый перспективный подход — генная терапия (рис. 6). В этом случае пациентам пересаживаются аутологичные (сделанные из собственных клеток) трансплантаты, в клетках которых с помощью методов генетического редактирования дефектный ген заменяется нормальным. И хотя подобная процедура не приводит к полному исцелению, она способна временно устранить симптомы БЭ, а также является относительно простой в техническом отношении.
Рисунок 6. Редактирование собственной ДНК в лечении БЭ. а — Принцип генной терапии. На первом этапе культивируют эпидермальные стволовые клетки из биоптатов кожи пациента с БЭ. Затем стволовые клетки подвергают процедуре генетического редактирования, в результате которой дефектный ген замещается нормальным. После того как пласт из генетически отредактированных кератиноцитов будет проверен на безопасность, его трансплантируют пациентам. б — Трансплантаты, сформировавшиеся из «правильных» кератиноцитов пациента с рецессивным дистрофическим БЭ. Рисунок из [7].
Первые успехи генной терапии были достигнуты в Италии в 2006 году, когда в эпидермальные стволовые клетки пациента с пограничным БЭ с помощью ретровирусной конструкции был доставлен нормальный ген LAMB3, кодирующий одну из субъединиц белка ламинина-332. Из «исправленных» клеток были созданы эпидермальные трансплантаты, которые затем были пересажены на ноги пациента. В результате из них образовалась полноценная в функциональном отношении кожа. Исследование показало, что выживание даже небольшого числа стволовых клеток в подобных трансплантатах приводит к успешному восстановлению нормальных функций кожи. Спустя восемь лет продукция целевого белка LAMB3 в коже пациентов всё еще сохранялась. Не было обнаружено ни пузырей, ни признаков воспаления, опухолевого роста или какого-либо иммунного ответа в области трансплантата. В июле 2014 года в Австрии провели вторую подобную операцию. Профессор Альфред Лэйн из Стэнфордского университета (Калифорния) вместе с сотрудниками начал клинические испытания подобной технологии, нацеленной на восстановление синтеза коллагена VII в эпидермальных стволовых клетках пациента с рецессивным дистрофическим БЭ. Спустя 30 дней после операции в областях трансплантации не было отмечено никаких отклонений, а уровень продукции коллагена VII был гораздо выше исходного [7].
Конечно, и в случае генной терапии существует множество сложностей. Так, замена гена с использованием вирусных конструкций и невирусных систем редактирования ДНК (ZFN, TALEN и CRISPR/Cas9)* связана с риском встраивания гена не в то место генома, которое являлось мишенью. Оценить последствия такого встраивания довольно сложно. Поэтому такой подход требует большой осторожности.
* — Методы ZFN, TALEN и CRISPR/Cas9 основаны на сайт-специфическом действии нуклеаз in vivo. Эти системы обычно состоят из двух модулей, один из которых распознает целевую олигонуклеотидную последовательность, а другой режет цепи ДНК: «А не замахнуться ли нам на. изменение генома?» [8], «CRISPR-системы: иммунизация прокариот» [9], «Мутагенная цепная реакция: редактирование геномов на грани фантастики» [10]. — Ред.
Другая проблема подобной терапии — возможный риск развития иммунного ответа на экспрессируемый новый белок. Особенно велик риск для тех пациентов, чьи клетки несли мутации, полностью исключающие синтез определенного белка. В то же время известно, что у некоторых пациентов с БЭ есть участки кожи, на которых не образуются пузыри и продуцируется повышенный уровень белка. Это явление названо обратным мозаицизмом, или естественной генной терапией, и может предотвращать развитие иммунной реакции на синтезируемый в результате генной терапии белок. Более того, такие «самоизлечившиеся» клетки можно использовать для клеточной терапии, и тогда потребность в генной коррекции исчезнет. Однако до сих пор попытки создать трансплантаты на основе таких клеток у больных с пограничным БЭ не увенчались успехом из-за малого числа подобных клеток в пересаживаемом материале [11].
Заключение
С тех пор как в 1886 году немецкий врач Кебнер впервые употребил термин «буллезный эпидермолиз», многое стало известно о патогенезе этого заболевания. Тем не менее до сих пор основным инструментом терапии является правильный уход за такими больными. Всё дело в том, что разработка и производство лекарств для лечения орфанных заболеваний представляет собой наукоемкий и дорогостоящий процесс, увы, невыгодный с коммерческой точки зрения из-за малого потребительского рынка. К сожалению, государство не в состоянии самостоятельно обеспечить решение этой проблемы. В 1978 году в Великобритании была основана ассоциация DEBRA, в настоящее время насчитывающая более 40 стран-участниц. Деятельность ассоциации направлена в первую очередь на медицинскую и социальную помощь пациентам с БЭ и их родным. Помимо этого, ассоциация финансирует исследования в области БЭ и занимается привлечением общественного внимания к данной проблеме. Представителем ассоциации в России является фонд «Б.Э.Л.А. Дети-бабочки». Именно благодаря совместным усилиям государства и ассоциации DEBRA стало возможным проведение масштабных исследований БЭ. В результате многолетней работы ученых всего мира появилось несколько перспективных подходов к терапии БЭ, а некоторые из них сейчас проходят первую фазу клинических испытаний. И хотя впереди еще несколько этапов тщательных исследований, первые положительные результаты дают надежду пациентам с этим редким генетическим заболеванием.