toxoplasma gondii igg что это такое у женщин
Антитела к Toxoplasma gondii IgG и IgM
Зачем определять Anti Toxoplasma gondii антитела?
При нормальном иммунитете токсоплазмоз протекает без заметных клинических проявлений и обнаружить его как можно раньше помогает анализ на Anti Toxoplasma gondii антитела. Раннее определение Т oxoplasma gondii IgG и IgM даёт возможность предотвратить серьёзные осложнения, которые способна вызвать токсоплазма на фоне сниженного иммунитета или беременности. Anti Toxoplasma gondii антитела также можно определять в динамике при наличии острых проявлений инфекции. При ослабленном иммунитете токсоплазмоз проявляется менингоэнцефалитами и другими видами воспаления мозговых оболочек, а также воспалениями сетчатки глаза и др.
Расшифровка анализов на Т oxoplasma gondii IgG и IgM
Преимущество анализа на Т oxoplasma gondii IgG и IgM – это его высокая чувствительность, что позволяет устанавливать диагноз на ранних стадиях заболевания.
Если Т oxoplasma gondii IgG находится в крови в концентрации менее 1,6 Ед/мл, то анализ считают отрицательным. Если количество IgG от 3 Ед/мл и выше – анализ положительный. Промежуточные между этими значениями цифры делают результат анализа сомнительным.
Положительный анализ на Т oxoplasma gondii IgG говорит о наличии иммунитета к токсоплазмозу, что подтверждает факт контакта с инфекцией. О том, что процесс обострился, говорит повышение IgG при повторных исследованиях больше, чем на 30%. Положительный анализ на IgM может подтвердить острую или первичную инфекцию, а также врождённый токсоплазмоз. Однако этот тип антител может сохраняться в течение года и более, поэтому их наличие не всегда указывает на острую инфекцию.
Toxoplasma gondii igg что это такое у женщин
Токсоплазмоз – паразитарное заболевание, вызываемое представителем простейших токсоплазмой гондии. Наибольшую опасность оно представляет для беременных женщин, так как может привести к аномалиям развития плода и даже к его смерти.
Антитела класса IgG к токсоплазме гондии.
Antitoxo-IgG, toxoplasma gondii Antibodies, IgG, toxoplasmosis antibodies, IgG.
Твердофазный хемилюминесцентный иммуноферментный анализ («сэндвич»-метод).
МЕ/мл (международная единица на миллилитр).
Какой биоматериал можно использовать для исследования?
Как правильно подготовиться к исследованию?
Не курить в течение 30 минут до исследования.
Общая информация об исследовании
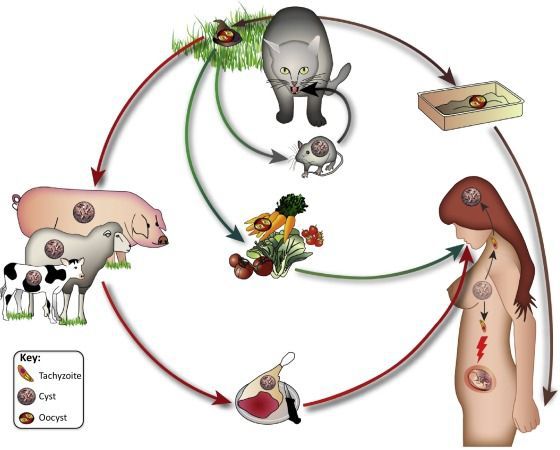
Т. гондии – это микроскопический паразит, основным хозяином которого является кошка. Также он может быть обнаружен в почве.
У большинства здоровых людей данная инфекция не вызывает никаких проявлений или протекает в форме легких гриппоподобных заболеваний. У плода, заразившегося от матери, или у человека с ослабленной иммунной системой т. гондии может приводить к тяжелым осложнениям.
Т. гондии очень распространена. Она встречается во всем мире, а в некоторых странах инфицировано до 95 % населения. По данным ВОЗ, около 23 % людей старше 12 лет страдают токсоплазмозом. Заражение происходит при употреблении загрязненной пищи (особенно плохо приготовленного мяса) или воды, а также при уборке помета кошки, при передаче инфекции от матери к ребенку и в редких случаях во время трансплантации органов или переливания крови.
Окончательными хозяевами для т. гондии являются дикие и домашние кошки. После того как кошки заражаются, употребляя в пищу инфицированных птиц, грызунов или сырое мясо, т. гондии проходят половой цикл развития, приводящий к образованию яиц, заключенных в защитную оболочку (ооцисту). Во время активности возбудителя у кошки с фекалиями за несколько недель могут выделиться миллионы микроскопических ооцист. Они становятся заразными в течение двух дней и могут оставаться жизнеспособными несколько месяцев. Во всех других хозяевах, включая человека, т. гондии проходят только ограниченную часть своего жизненного цикла, а затем формируют неактивные кисты в мышцах, головном мозгу и глазах. Иммунная система хозяина защищает организм человека от дальнейшего заражения. Скрытый период может длиться в течение всей жизни хозяина, пока иммунитет не снизится.
Первичное или повторное заражение т. гондии приводит к выраженным симптомам заболевания у людей с ослабленной иммунной системой, например у больных ВИЧ/СПИДом, проходящих курсы химиотерапии, пациентов после трансплантации органов или принимающих иммунодепрессанты. Могут поражаться глаза и нервная система, что вызывает головные боли, судороги, спутанность сознания, лихорадку, энцефалит, потерю координации и затуманенность зрения.
Когда заражается беременная женщина, вероятность того, что инфекция передастся будущему ребенку, составляет 30-40 %. Причем, если инфицирование происходит в начале беременности, оно может вызывать выкидыши, мертворождения или приводить к серьезным осложнениям у новорождённых, в том числе умственной отсталости, судорогам, слепоте и увеличению печени или селезенки. Многие инфицированные дети, особенно те, кто заразился ближе к появлению на свет, рождаются здоровыми, но спустя несколько лет у них развиваются тяжелые инфекции глаз, потеря слуха и задержка умственного развития.
Когда происходит контакт человека с т. гондии, его иммунная система реагирует, вырабатывая антитела против паразита. В крови может быть обнаружено два вида антител к токсолплазме: IgM и IgG.
Антитела IgG вырабатываются организмом через несколько недель после первичного инфицирования, чтобы обеспечить долгосрочную защиту. Уровень IgG нарастает во время активности инфекции, а затем стабилизируется, как только заболевание проходит и паразит становится неактивным. Однажды столкнувшись с т. гондии, человек на протяжении всей жизни будет иметь некоторые измеряемые количества антител IgG в крови.
Данный тест может быть использован, наряду с анализом на IgM, чтобы помочь подтвердить наличие острого или прошедшего инфицирования токсоплазмой.
Для чего используется исследование?
Когда назначается исследование?
Что означают результаты?
Причины положительного результата:
Причины отрицательного результата:
При подозрении на заражение исследование рекомендуется повторить через 10-14 дней, так как при первичном инфицировании антитела могут просто не успеть выработаться иммунной системой.
Следует внимательно относиться к интерпретации результатов тестирования лиц с иммунодефицитом. В этом случае не всегда развивается сильный иммунный ответ к т. гондии – уровень IgM и IgG тогда окажется ниже, чем ожидалось, при наличии активной формы токсоплазмоза.
Кто назначает исследование?
Гинеколог, инфекционист, терапевт, педиатр.
Что такое токсоплазмоз? Причины возникновения, диагностику и методы лечения разберем в статье доктора Александрова Павла Андреевича, инфекциониста со стажем в 13 лет.
Определение болезни. Причины заболевания
Токсоплазмоз — это острое и хроническое паразитарное заболевание человека в виде манифестных форм или носительства, вызываемое простейшими внутриклеточными паразитами — токсоплазмами, которые попадая в организм человека могут при условиях иммунодефицита поражать нервную ткань, среды глаза, сердечно-сосудистую и ретикулоэндотелиальную системы, вызывая поражение организма той или иной степени тяжести. Болезнь относится к группе TORCH-комплекса, т. е. вызывает врождённую патологию.
Этиология
Таксономия:
Вид — Toxoplasma gondii
Токсоплазмы обитают в мире в трёх формах:
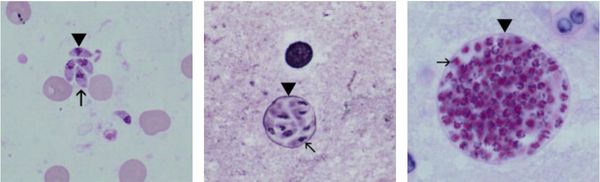
Трофозоиты достигают 4-7 мкм в длину и 2-4 мкм в ширину. Их тело по форме напоминает полумесяц с заострённым передним и закруглённым задним концами, состоит из пелликулы (покровной ткани) и различных органелл. Такие паразиты обитают во всех клетках млекопитающих кроме эритроцитов, размножаются путём деления. Могут создавать движение, активно проникая в клетки хозяина через клеточную мембрану или посредством фагоцитоза (захвата и переваривания клетки). Обнаруживаются в тканях в острой стадии инфекции. Их скопление внутри одной клетки называют псевдоцистой. Трофозоиты неустойчивы вне клетки и во внешней среде, быстро погибают при высушивании, прогревании и применении дезинфицирующих средств. Хорошо окрашиваются по Романовскому. Чувствительны к различным химиопрепаратам (сульфаниламидам, некоторым макролидам и другим).
Цисты размерами до 100 мкм отличаются плотной оболочкой, через которую не могут проникнуть антитела или лекарственные препараты. Внутри оболочки сосредоточено 3000-5000 паразитов, со временем они увеличиваются. Цисты формируются в организме хозяина (в основном в скелетных мышцах, миокарде и ЦНС) и живут там десятки лет. Чрезвычайно устойчивы к воздействиям внешних факторов. При адекватной иммунной системе могут пожизненно находиться в состоянии функционального покоя и не приносить никакого вреда организму человека.
Ооцисты играют основную роль в передаче инфекции. Они представляют собой овальные образования 10-12 мкм в диаметре. Их развитие и формирование длится 3-24 дня и проходит в слизистой оболочке тонкой кишки кошек. Затем в течение 7-20 дней паразиты выделяются с испражнениями, после этого срока новые фекалии кошки уже не заразны. За сутки с испражнениях животного выделяется до 10 миллионов ооцист. Спустя 2-3 дня при температуре 24 °C происходит споруляция ооцист — образование спор. При благоприятных условиях микроорганизмы сохраняются во внешней среде до года и дольше.
Существует множество штаммов токсоплазм, одни из которых отличаются высокой вирулентностью, а другие относительно маловирулентны. [1] [2] [7] [9]
Эпидемиология
Учитывая большое количество латентных форм, заболевание не поддаётся общему исчислению — им может быть заражено не менее 1,5 миллиардов человек. Только ежегодно регистрируется около 200 тысяч случаев внутриутробного инфицирования.
Распространение возбудителя повсеместное — токсоплазма обнаружена на всех материках. После заражения паразиты способны пожизненно сохранятся в организме большинства животных и птиц. Количество случаев приобретённого токсоплазмоза в разных странах колеблется: от 85 % во Франции и Мадагаскаре до 15 % в США и Англии.
От человека к человеку заболевание не предаётся (кроме случаев каннибализма). Нельзя заразиться посредством укуса насекомых и при половом контакте.
Инфицирование токсоплазмой вызывает устойчивый пожизненный иммунитет к повторному заражению, однако известны случаи рецидива первичной инфекции при заражении другим высоковирулентным штаммом (у беременных, заразившихся при употреблении сырого мяса с другого континента). [1] [3] [5] [8] [9]
Симптомы токсоплазмоза
Инкубационный период при манифестных формах (явных проявлениях болезни) длится от двух недель до двух месяцев.
Специфичных симптомов, характерных именно для токсоплазмоза, не существует.
В большинстве случаев приобретённого токсоплазмоза заболевание протекает бессимптомно или со стёртой клиникой, напоминающей нетяжёлое ОРЗ: кратковременная лихорадка, слабость, недомогание, повышение температуры до 38,0 °C, увеличение периферических лимфоузлов, небольшое увеличение печени и селезёнки.
Доказано, что токсоплазма может оказывать влияние на психику человека. Это выражается в учащении рискованных действий, снижении концентрации внимания, повышенной нервозности, у лиц с тяжёлым острым или длительным хроническим активным течением повышен риск развития шизофрении.
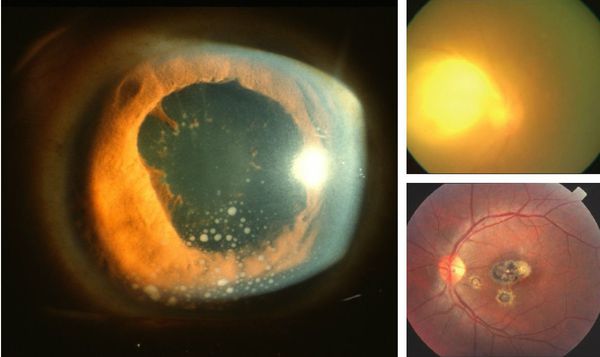
Иногда заболевание проявляется изолированной глазной формой — длительно текущие увеиты, иридоциклиты и хориоретиниты. Как правило, эти нарушения являются поздними проявлениями нераспознанного ранее врождённого процесса.
У людей с выраженным иммунодефицитом (ВИЧ, пересадка органов с последующей цитостатической терапией) возможно развитие генерализованного процесса с поражением нескольких органов (головного мозга, сердца, печени, почек, лёгких), нередко очень тяжёлого течения, проявляющегося в виде синдрома полиорганной недостаточности.
Токсоплазмоз у беременных может протекать в различных клинических вариантах и представляет опасность не столько для самой беременной (исключая тяжело протекающие патологии у беременных со СПИДом), сколько для плода.
При первичном заражении беременной токсоплазмозом имеет значение срок гестации:
Патогенез токсоплазмоза
Входные ворота токсоплазмоза — ротовая полость, оттуда ооцисты попадают в кишечник человека. Далее при развитии паразита (делении его клеток) образуются трофозоиты, которые мигрируют в различные органы и ткани (преимущественно в ЦНС и мышечную). В клетках они формируют псевдоцисты — большое количество размножающихся паразитов.
По мере развития и размножения токсоплазм поражённые клетки разрушаются, происходит заражение новых здоровых клеток, и при попадании возбудителя в кровоток паразиты разносятся по всему организму. Образуются некрозы с формированием фиброзной ткани и кальцификацией (отложение солей кальция в организме).
Под воздействием иммунитета безоболочечные трофозоиты превращаются в брадизоиты (оболочечные скопления токсоплазм), т.е. в тканевые цисты, которые сохраняются десятками лет в неактивном состоянии и при значительном снижении иммунитета способны к обратной трансформации с развитием обострения.
При первичной инфекции у беременных возбудитель проникает в ткани плода и вызывает воспалительный процесс, причём в разные периоды развития наблюдается различный характер воспаления: у эмбриона происходит лишь альтерация (дистрофия и некроз ткани без фиброза), в раннем фетальном периоде дополняется повышенным образованием соединительной ткани (фиброзом), а в позднем фетальном периоде присоединяется сосудистый компонент. Отсюда вытекают различные по характеру и тяжести поражения плода, которые зависят от сроков инфицирования матери. [1] [2]
Классификация и стадии развития токсоплазмоза
По течению процесса токсоплазмоз бывает:
По клиническим признакам выделяют пять форм заболевания:
По степени тяжести заболевание бывает:
По наличию осложнений выделяют:
В Международной классификации болезней 10 пересмотра выделены шесть типов заболевания:
Осложнения токсоплазмоза
При врождённой форме может возникнуть гидроцефалия, микроцефалия, задержка психомоторного развития и слепота. Эти осложнения сопровождаются увеличением или уменьшением размеров черепа, различными неврологическими расстройствами — косоглазием, судорогами, трудностью с сидением и держанием головы, рвотой и другими.
При глазной форме заболевания развивается слепота, снижение остроты зрения и воспалительные явления всех сред глаза. Причём возможно как рождение с грубыми дефектами зрения, так и появление воспалительных явлений и нарушения зрения спустя много лет после рождения.
Токсоплазмоз у иммунокомпрометированных людей осложняется шизофренией, токсоплазменный энцефалитом и полиорганной недостаточностью — тяжёлой патологией различных органов при выраженном иммунодефиците. При этом свойственна картина тяжёлого энцефалита. Прогноз, как правило, неблагоприятный. [1] [5] [8] [9]
Диагностика токсоплазмоза
Лабораторная диагностика:
Дифференциальная диагностика
Токсоплазмоз — это инфекция с необычайно разнообразными проявлениями, поэтому ввиду неспецифичности проявлений основное место в дифференциальной диагностике отводиться лабораторному обследованию, а именно специфическим серологическим тестам.
Необходимо исключить следующие заболевания:
Лечение токсоплазмоза
Большинство случаев приобретённого токсоплазмоза протекают в лёгкой или бессимптомной форме, они не регистрируются и, по-видимому, не нуждаются в каком-либо лечении.
Необходимость проведения специфической этиотропной терапии возникает лишь у некоторых групп пациентов:
Проведение лечения может осуществляться как в стационаре, так и амбулаторно в зависимости от выраженности процесса, реакции пациента на вводимые препараты, необходимости тех или иных вариантов патогенетического и симптоматического обеспечения. [1] [4] [7]
Прогноз. Профилактика
При приобретённом токсоплазмозе у иммунокомпетентных лиц прогноз благоприятный, у иммунокомпрометированных лиц (СПИД) прогноз серьёзен, нередки летальные исходы.
При врождённом токсоплазмозе исход заболевания зависит от сроков инфицирования плода:
Основным методом профилактики приобретённого и врождённого токсоплазмоза является соблюдение санитарно-гигиенических правил, особенно беременными, не имеющими антител класса G к токсоплазмам:
Для беременных особенно важен скрининг антител к токсоплазме, позволяющий выявить активно протекающее заболевание или риск его возникновения, а также вовремя провести медикаментозную профилактику острого токсоплазмоза беременной и снизить риск врождённой инфекции на 60 %. При отсутствии антител класса G в первом триместре необходимо отслеживать антитела IgM и IgG не только в тертьем, но и во втором триместре беременности.
В очаге токсоплазмоза противоэпидемические мероприятия не проводятся, вакцина на разработана. [2] [3]
Токсоплазмоз
Токсоплазмоз – протозойная инвазия, характеризующаяся большим разнообразием вариантов течения и полиморфизмом клинических проявлений. В 1972 г. эксперты ВОЗ включили токсоплазмоз в число зоонозов, наиболее опасных для здоровья человека, а позднее в связи с распространением ВИЧ-инфекции он был признан одной из немногих оппортунистических инфекций протозойной этиологии.
Возбудитель – кокцидия Toxoplasma gondii – облигатный внутриклеточный паразит из класса Sporozoa, относящегося к типу простейших. Окончательным хозяином T. gondii считаются домашняя кошка и другие представители семейства кошачьих, в организме которых происходит как бесполое размножение токсоплазм, так и образование половых клеток (ооцисты), которые с фекалиями попадают во внешнюю среду, где проявляют высокую устойчивость к различным неблагоприятным факторам (в почве при достаточной влажности сохраняются до 2 лет). Ооцисты из внешней среды попадают с контаминированной пищей или водой в организм человека или других промежуточных хозяев (многие дикие и домашние животные и птицы), где происходит бесполый цикл размножения паразита. Спороцисты, освобождаемые из ооцист в кишечнике, образуют тахизоиты, которые, мигрируя в организме, поражают многие ткани, в основном, головной мозг и мышцы. Затем тахизоиты превращаются в истинные тканевые цисты, в которых медленно размножаются тысячи брадизоитов. У людей без нарушений иммунной системы тканевые цисты находятся в латентном состоянии в течение всей жизни, но при значительном снижении иммунитета часто происходит реактивации инфекции с развитием клинических вариантов болезни.
Токсоплазмозная инвазия имеет широкое, практически повсеместное распространение: на земном шаре от 500 млн до 1,5 млрд человек инфицировано токсоплазмами. Пораженность населения в разных странах зависит от санитарно-гигиенических условий, особенностей питания, влияния экологических факторов, частоты иммунодефицитных состояний и др. Показатели инфицированности населения в различных регионах России колеблются от 15 до 50%, а частота врождённого токсоплазмоза среди новорожденных составляет в среднем 3-8 детей на 1000 рождений.
Источником возбудителя инвазии являются домашняя кошка и многие виды диких и домашних животных. Однако кошки выделяют ооцисты с фекалиями в течение короткого периода (1-2 недели) и только в возрасте 4-5 месяцев, поэтому заражение непосредственно от кошки – окончательного хозяина возбудителя – происходит редко (например, заражение ребенка при контакте с фека лиями кошки в песочнице и несоблюдении правил гиги ены). Заражение людей происходит различными путями: алиментарным, контактным, конгенитальным (трансплацентарным), парентеральным, возможно заражение медицинского персонала, контактирующего с кровью. Часто люди заражаются при употреблении в пищу продуктов из непрошедшего достаточной термической обработки мяса промежуточных хозяев (куры гриль, шаурма, шашлык, сырой мясной фарш), плохо вымытых овощей и т.д. В зависимости от механизма инфицирования различают приобретенный и врожденный токсоплазмоз.
Приобретенный токсоплазмоз у взрослых чаще протекает бессимптомно – у 9095 % инвазированных лиц не наблюдается каких-либо значимых проявлений. Примерно 5–7% женщин впервые инфицируются в период беременности, в этих случаях токсоплазмоз особенно опасен: он вызывает прерывание беременности в ранние сроки, мертворождение, рождение детей с аномалиями развития, поражением ЦНС и др. При инфицировании женщин в течение всего периода беременности в среднем рождается 61% здоровых детей и 39% детей с врожденным токсоплазмозом. При первичной инфекции в период беременности передача возбудителя плоду при остром токсоплазмозе осуществляется в 40–50% случаев, при заражении плода в первом триместре тяжелая форма встречается в 40%, при заражении во втором или третьем триместре – в 17,7% и 2,7% случаев соответственно. Высокую патогенетическую значимость токсоплазмоз имеет для ВИЧ-инфицированных лиц, когда клинические формы заболевания развиваются в результате реактивации латентной инфекции. В России в настоящее время токсоплазмозный энцефалит является главной причиной поражения ЦНС у больных СПИДом (обычно при количестве CD4 лимфоцитов менее 0,1 х 10 9 /мкл).
Врожденный токсоплазмоз – острое или хроническое заболевание новорожденных, возникающее при инфицировании плода токсоплазмами во время внутриутробного развития. Он требует к себе особого внимания в связи с трудностью диагностики и возможностью тяжелых последствий заболевания. Единственным методом профилактики врожденного токсоплазмоза считается обследование беременных для выявления специфических АТ.
Клинические проявления инфекции у плода определяются преимущественно сроком беременности, в который произошло инфицирование и путем проникновения возбудителя (неблагоприятный исход преимущественно связан с гематогенным путем передачи инфекции). Выделяют три клинические формы врожденного токсоплазмоза, которые являются последовательными стадиями развития инфекционного процесса: острая генерализованная форма (с гепатоспленомегалией и желтухой), подострая (с явлениями энцефалита) и хроническая (с явлениями постэнцефалического дефекта).
При инфицировании в I и II триместрах беременности, когда стадия генерализации процесса заканчивается внутриутробно, чаще возникают самопроизвольные выкидыши, тяжелые аномалии развития, несовместимые с жизнью плода и ребенка, а также наиболее тяжелое поражение ЦНС и глаз. В подострой стадии заболевания ребенок рождается с выраженными симптомами поражения ЦНС – явлениями менингита или менингоэнцефалита, с клинической картиной очагового или диффузного поражения мозговых оболочек. В случаях, когда острая и подострая стадии прошли внутриутробно, ребенок рождается с хронической формой токсоплазмоза при наличии грубых повреждений ЦНС (картина постэнцефалитического состояния) и глаз (от хориоретинита до микрофтальмии).
При заражении в III триместре у новорожденных чаще преобладают асимптомные формы. Однако если инфицирование произошло незадолго до рождения ребенка, то внутриутробно начавшаяся стадия генерализации продолжается и после рождения и проявляется разнообразными клиническими симптомами.
Острая форма врожденного токсоплазмоза выявляется чаще всего у недоношенных детей, протекает очень тяжело по типу сепсиса. Летальность зараженных новорожденных колеблется от 1 до 6%. Выжившие дети страдают задержкой умственного развития или другими проявлениями нарушений ЦНС.
Показания к обследованию
Дифференциальная диагностика
Материал для исследования
Этиологическая лабораторная диагностика включает визуальное выявление возбудителя с использованием микроскопии, выделение возбудителя в культуре клеток, обнаружение АГ или ДНК возбудителя, определение специфических АТ к АГ токсоплазмы.
Сравнительная характеристика методов лабораторной диагностики. Микроскопия мазков, мазков–отпечатков, гистологических срезов, биопроба на лабораторных животных, выделение возбудителя в культуре клеток позволяют провести идентификацию токсоплазм в тканях или биологических жидкостях пациента. Иногда при тяжелом течении токсоплазмоза у больных СПИДом (септическое состояние) возможно увидеть возбудитель при прямой микроскопии в мазке крови. Названные методы выявления T.gondii для рутинной диагностики токсоплазмоза применяются редко ввиду трудоемкости и длительности исполнения.
Для обнаружения АГ токсоплазм в исследуемом материале используют РИФ. Присутствие АГ, характерное для острой фазы токсоплазмоза, устанавливают по наличию специфического свечения, выявляемого с помощью люминесцентного микроскопа, исследование особо полезно для ранней диагностики.
Высокое диагностическое значение, преимущественно при остром и врожденном токсоплазмозе, имеет обнаружение ДНК токсоплазм в крови, СМЖ или биоптатах методом ПЦР, обладающим наиболее высокой чувствительностью и специфичностью. Диагностическая ценность определения ДНК патогена повышается при сочетании с определением специфических АТ.
АТ-токсо IgМ к АГ T.gondii относятся к биомаркерам острой фазы заболевания, они появляются первыми в ответ на внедрение возбудителя (в первые две недели после заражения), количество их достигает максимума через 4–8 недель. В течение нескольких месяцев эти АТ исчезают, но в отдельных случаях могут сохраняться до 18 месяцев с момента инфицирования. Через плаценту не передаются.
АТ-токсо IgA появляются через 2–3 недели после заражения, достигают максимальной концентрации через месяц, в 90% случаев исчезают через 6 месяцев, но иногда могут выявляться до года. При реактивации их концентрация увеличивается, что позволяет рассматривать IgA в качестве критерия активности инфекционного процесса. Через плаценту не передаются (являются собственными АТ новорожденного).
АТ-токсо IgG появляются с 6–8 недели инфицирования, достигают максимума через 1–2 мес и сохраняются (у отдельных лиц на высоком уровне) в течение нескольких лет, обеспечивая длительный иммунитет. Передаются через плаценту, обеспечивают «материнский» иммунитет.
Выявление АТ-токсо методом ИФА широко используется для эпидемиологических исследований и при перинатальном скрининге. Исследование имеет высокую чувствительность и специфичность, позволяет выявлять АТ-токсо разных классов. Стандартный подход направлен на выявление в сыворотке/плазме крови АТ-токсо IgМ и IgG. Обнаружение АТ IgМ позволяет дифференцировать активную инфекцию от латентно протекающей. Широкое используемое в рутинных исследованиях однократное выявление IgG имеет низкое диагностическое значение для определения формы инфекции. Определение авидности АТ IgG проводят для уточнения срока заражения, дифференциации острого и хронического токсоплазмоза. АТ IgG с низкой авидностью обнаруживаются в ранней стадии инфекции, АТ с высокой авидностью характерны для предшествующей инфекции. При наличии клинических показаний для обследования или для подтверждения/исключения врожденного токсоплазмоза целесообразно в лабораторный алгоритм включать выявление АТ IgА к T. gondii. Наличие АТ-токсо IgА свидетельствует в пользу активного процесса, позволяет установить подострое течение и рецидив заболевания. Тест может эффективно использоваться для ранней диагностики как врожденного, так и приобретенного токсоплазмоза.
Наличие высокого индекса авидности не исключает реактивацию токсоплазмоза (особенно на фоне иммунодефицита), поскольку установлена возможность персистенции T. gondii. В этом случае целесообразно определение специфических IgА. Использование комбинированных исследований – определение авидности АТ IgG и выявление АТ Ig А – позволяет при обнаружении АТ-токсо IgG в кратчайшее время (в течение 2–3 дней) завершить обследование и подтвердить (исключить) первичную инфекцию, подострое течение или обострение хронической инфекции.
Параллельное определение АТ-токсо в крови и СМЖ дает дополнительную информацию о специфическом прогрессирующем поражении мозга (в т. ч. и при врожденной патологии). Наличие АТ в СМЖ предполагает специфическое прогрессирующее поражение мозга. При поражении ЦНС, особенно при менингоэнцефалите и энцефалите, у новорожденных при подозрении на врожденный токсоплазмоз, тест имеет важное диагностическое и прогностическое значение. У больных с иммунодефицитом повышение уровня АТ IgG в СМЖ и выявление специфических IgМ наблюдается редко.
Показания к применению различных лабораторных исследований и особенности интерпретации результатов у разных категорий обследуемых
Скрининг при планировании беременности и у беременных женщин направлен на выявление АТ-токсо IgМ, IgА, IgG. Диагноз недавнего заражения токсоплазмозом, как правило, ставится при появлении специфических АТ у пациента с ранее отрицательными результатами таких исследований (сероконверсия). Отрицательные результаты исследования позволяют исключить токсоплазмоз.
Выявление АТ-токсо IgМ указывает на первичное инфицирование токсоплазмами, однако у беременных женщин и у лиц с аутоиммунной патологией (наличие ревматоидного фактора) возможен ложноположительный результат исследования.
При выявлении АТ-токсо IgМ для подтверждения диагноза и определения фазы инфекционного процесса целесообразны дополнительные исследования а) выявление ДНК токсоплазм в плазме крови; б) определение АТ-токсо IgА, наличие которых указывает на текущую инфекцию; в) обследование пациента в динамике (появление АТ IgG подтверждает диагноз острого токсоплазмоза); г) определение индекса авидности АТ IgG; наличие низкоавидных АТ свидетельствует в пользу заражения в течение последних 3–6 месяцев.
Выявление АТ-токсо IgА свидетельствует о первичном инфицировании токсоплазмами или реактивации инфекции. Появление отрицательного результата наличия АТ IgА при исследовании в динамике указывает на завершение активного процесса и эффективную терапию. Возможно длительное выявление АТ IgА у лиц с выраженным иммунодефицитом, как правило, при микст-инфекции (активно протекающей ЦМВИ).
Положительный результат однократного определения АТ IgG свидетельствует об инфицировании токсоплазмами, но не позволяет определить фазу инфекционного процесса. Рекомендуется повторно обследовать пациента в динамике через 3–4 недели: при активно протекающей инфекции наблюдается нарастание титра АТ. При таком подходе затягивается срок установления диагноза. Более целесообразно провести исследование авидности АТ IgG и/или определение АТ-токсо IgА.
Низкоавидные АТ IgG к антигенам T.gondii могут выявляться до 3–6 месяцев. Их наличие свидетельствует об острой инфекции, высокоавидных – о хронической инфекции (более 6 мес).
При скрининге нецелесообразно определение ДНК токсоплазм в крови, т. к. отрицательные результаты исследования не исключают наличия инфекции ввиду кратковременности паразитемии.
Диагностическое обследование беременной женщины включает определение АТ-токсо IgМ, IgА, IgG и при возможности – ДНК токсоплазм. Обследование проводят при наличии инфекционного синдрома (лимфаденопатия, длительный субфебрилитет неясного генеза, гепато- и спленомегалия) или выявлении признаков внутриутробной инфекции при УЗИ.
Наличие ДНК токсоплазмы и/или АТ-токсо IgМ и/или IgА свидетельствует о текущей инфекции, для оценки стадии инфекции необходимо определение авидности АТ IgG.
Для установления причины перинатальных потерь на разных сроках гестации с учетом влияния микст-инфекции на исход беременности, целесообразно параллельное исследование ткани погибших плодов и плаценты для выявления НК группы потенциальных возбудителей (токсоплазма, листерия, ВПГ 1 и 2 типа, ЦМВ, ВЭБ) методом ПЦР.
Диагностическое обследование новорожденных детей и детей раннего возраста с признаками внутриутробной инфекции или родившихся от матерей с острым или хроническим (при наличии реактивации во время беременности) токсоплазмозом.
Приоритетным является выявление ДНК токсоплазм в плазме крови или СМЖ (при наличии строгих показаний для спинальной пункции) методом ПЦР. Положительный результат указывает на заражение ребенка. В случае поражения мозга детекция ДНК токсоплазм в СМЖ однозначно подтверждает паразитоз. Дополнительные исследования для выявления АТ-токсо на данном этапе диагностики не обязательны.
Отрицательный результат выявления ДНК токсоплазмы методом ПЦР не исключает ранее произошедшего инфицирования или наличия очага в мозге вдали от ликворонесущих путей. Для диагностики токсоплазмоза требуется дополнительное исследование сыворотки (плазмы) крови для выявления АТ-токсо IgM и АТтоксо IgА, при поражении мозга – параллельное исследование СМЖ и сыворотки (плазмы) крови для выявления АТ-токсо IgА и IgG.
При отсутствии возможности проведения ПЦР-исследования у ребенка необходимо определение АТ-токсо IgM и IgА.
Отсутствие АТ-токсо IgM при наличии АТ-токсо IgG не дает основание исключить внутриутробное заражение и требует определения ДНК токсоплазм либо АТтоксо IgА.
Обнаружение АТ-токсо IgА имеет высокое диагностическое значение и свидетельствует о заражении ребенка.
Обнаружение у новорожденного АТ IgG может быть обусловлено передачей их через плаценту от матери, что затрудняет диагностику врожденного токсоплазмоза. К 4 мес после рождения концентрация АТ-токсо IgG резко снижается ввиду распада материнских АТ. В случае заражения вскоре после рождения концентрация АТ IgG, вырабатываемых организмом ребенка, нарастает, однако в первом полугодии жизни «маскируется» уровнем материнских АТ. Повышение уровня АТ IgG во втором полугодии жизни можно рассматривать как показатель инфицирования ребенка, но в ряде случаев (у недоношенных и иммунодефицитных детей) даже при появлении симптомов (чаще всего со стороны ЦНС) резкого подъема АТ не наблюдается.
Рецидивы перинатальной инфекции (хориоретинит, поражение ЦНС с формированием гидроцефалии) могут иметь место в любом возрасте и сопровождаются усиленной продукцией АТ IgA (редко – IgМ) к токсоплазмам.
При поражении мозга (менингоэнцефалит, энцефалит, прогрессирующая гидроцефалия, кальцификаты, кисты мозга) АТ-токсо IgG целесообразно определять одновременно в СМЖ и сыворотке крови. При локальном поражении мозга уровень АТ в СМЖ значительно выше, и, рассчитав соотношение уровня АТ, можно подтвердить (или исключить) поражение мозга токсоплазмами.
Диагностическое обследование больных ВИЧ-инфекцией показано на ранних стадиях перед назначением первичной профилактики токсоплазмоза, которая проводится при числе CD 4+ менее 0,1.109 и включает определение АТ-токсо АТ IgG. Обследование больных ВИЧ-инфекцией на поздних стадиях показано при развитии симптомов поражения ЦНС (желательно проведение МРТ) и при подозрении на церебральный токсоплазмоз (наиболее частое поражением ЦНС у больных СПИДом). В этих случаях диагностическое значение имеет присутствие АТ-токсо IgG в крови в высоких и средних титрах (или их нарастание в динамике). Обнаружение в сыворотке крови АТ-токсо без определения их титра позволяет судить лишь об инфицировании и не может быть рекомендовано для подтверждения диагноза.
При церебральном токсоплазмозе у больных ВИЧ-инфекцией клиническая чувствительность обнаружения АТ IgM в крови и АТ IgG в СМЖ очень низкая. АТ IgM в крови выявляют редко (только при свежем инфицировании, что бывает лишь в 1-2% случаев), АТ IgG в СМЖ определяют не более чем в 5% случаев. Диагностическое значение имеет наличие специфических АТ IgG в крови в высоких и средних титрах (или их нарастание в динамике). Однако на фоне очень глубокого подавления иммунитета примерно у 5% пациентов эти АТ не обнаруживаются. Тем не менее, отрицательный результат исследования или низкие титры АТ IgG не исключают диагноза церебрального токсоплазмоза и не должны быть причиной отказа от начала эмпирического лечения. Использование ПЦР в диагностике церебрального токсоплазмоза продемонстрировало, что диагностическая чувствительность определения ДНК T. gondii в СМЖ составляет 30% при 100% специфичности. Таким образом, положительный результат ПЦР всего лишь констатирует зараженность индивидуума, но не может достоверно подтвердить токсоплазмозную этиологию поражения ЦНС.