амилоидная ангиопатия что это
Церебральная амилоидная ангиопатия
Церебральная амилоидная ангиопатия (ЦАА) – цереброваскулярное заболевание, причиной которого является накопление церебрального амилоида-бета (Ав) в средней оболочке и адвентиции лептоменингиальных и кортикальных сосудов головного мозга. Нарушение прочности сосудистой стенки у пожилых нормотензивных пациентов может приводить к лобарным интрацеребральным кровоизлияниям. Данное заболевание, наряду с болезнью Альцгеймера, принадлежит группе нозологий, характеризующихся отложением амилоида в головном мозге.
Эпидемиология
Церебральная амилоидная ангиопатия подразделяется на спорадические и семейные формы.
Спорадическая ЦАА
Спорадическая ЦАА – частая (16%) случайная находка у пожилых пациентов при проведении МРТ с последовательностью градиентного эха. При аутопсических исследованиях ЦАА выявляется у 5-9% среди пациентов в возрасте 60-69 лет, и у 43-58% среди пациентов старше 90 лет.
При аутопсии пациентов со всеми признаками болезни Альцгеймера ЦАА подтверждалась в 90% случаев.
Важно, что данная форма обычна не ассоциирована с системным амилоидозом.
Семейная ЦАА
Под семейной ЦАА описывается группа очень редких заболеваний, которые преимущественно являются аутосомно-доминантными состояниями. Большая их часть встречается внутри определенных семей, и главное их отличие от спорадической формы – начало в более раннем возрасте, обычно в среднем или позднем среднем. Более того, данный вид ЦАА может быть также частью мультисистемных (или с преимущественным поражением ЦНС) генетических заболеваний.
Примеры семейной формы ЦАА:
Клиническое представление
Вовлечение кортикальных сосудов приводит к интрацеребральным кровоизлияниям (чаще к лобарным, нежели мозжечковым), что может проявляться как инсульт или небольшие лобарные микрокровоизлияния, которые часто можно выявить радиологически. Повреждение сосудов в кортико-субкортикальных областях может стать причиной ишемической лейкоэнцефалопатии. Считается, что лобарные церебральные микрокровоизлияния и ишемическая лейкоэнцефалопатия играют роль в развитии когнитивных нарушений, которые не зависят от болезни Альцгеймера, хотя повторяющиеся лобарные кровоизлияния также могут приводить к постепенному снижению когнитивных функций.
Возможно наличие необычной воспалительной реакции, проявляющаяся в подостром состоянии с когнитивными нарушениями, судорогами, головной болью инсульто-подобными эпизодами (без кровоизлияния). Данный симптомокомплекс получил название ЦАА-опосредованное воспаление и обсуждается отдельно.
Также имеются сообщения о массоподобном поражении, получившим название церебральная амилоидома. Не следует путать с церебральным амилоидозом, являющимся проявлением системного амилоидоза.
Патология
ЦАА характеризуется отложением амилоида в средней оболочке и адвентиции лептоменингиальных и кортикальных артерий головного мозга малого и среднего калибра. На фоне фибриноидной дегенерации происходит отделение интимы от средней оболочки и образование микроаневризм.
Существует большое количество различных белков, участвующие в процессе интраваскулярного отложения амилоида, однако, наиболее распространенным (особенно в случае спорадических форм ЦАА) является Ав, короткий пептид из 42 аминокислот, отщепляющийся от белка-предшественника амилоида (APP), ген которого расположен в 21 хромосоме.
Связь с другими заболеваниями
Радиографические признаки
Радиографические признаки отражают различные проявления ЦАА:
Диагностические критерии
Бостонские критерии и их модификаци включают сочетание клинических, радиологических и патологоанатомических критериев, которые используются для оценки вероятности наличия церебральной амилоидной ангиопатии. Эти критерии требуют наличия биопсии и данных МР исследования. Кроме этого могут использоваться Эдинбургские критерии для внутримозговых кровоизлияний, особенно у пациентов не прошедших МР исследование.
Амилоидная ангиопатия что это
а) Терминология:
1. Сокращения:
• Церебральная амилоидная ангиопатия (ЦАА)
2. Синонимы:
• «Конгофильная ангиопатия», церебральный амилоидоз
3. Определение:
• ЦАА является частой причиной «спонтанных» долевых кровоизлияний у пожилых
• Наблюдается три морфологических варианта отложения амилоида в головном мозге:
о ЦАА (часто)
о Амилоидома (нечасто)
о Воспалительная ЦАА: ангиит, обусловленный отложением β-а-милоида (БАА) с диффузными воспалительными изменениями белого вещества (редко)
1. Общие характеристики амилоидоза головного мозга:
• Лучший диагностический критерий:
о Пациенты, страдающие деменцией и имеющие нормальное артериальное давление:
— Лобарное кровоизлияние(я) различной давности
— Мультифокальные кортикальные/субкортикальные микрокровоизлияния в виде «черных точек» при МРТ на Т2* или SWI
• Локализация:
о Кора/субкортикальное БВ (переход между серым и белым веществом)
о При аутопсии наиболее часто выявляется поражение теменных + затылочных долей; по данным диагностической визуализации-лобные + височные
о Менее частая локализация патологических изменений-ствол головного мозга, глубокие ядра, мозжечок, гиппокамп
• Размеры:
о Для острого долевого кровоизлияния более характерны крупные размеры
о Гипоинтенсивные очаги на Т2*/последовательностях, взвешенных по восприимчивости (участки «выцветания» изображения) характеризуют хронические микрокровоизлияния (не специфичные для ЦАА):
— Микрокро- и макрокровоизлияния могут представлять собой отличительные признаки ЦАА САА
• Морфология:
о Острые гематомы имеют крупные размеры, часто неправильную форму в зависимости от скорости оседания эритроцитов
2. КТ при амилоидозе головного мозга:
• Бесконтрастная КТ:
о Разрозненные или сливные очаги кровоизлияния кортикальной/субкортикальной локализации с неровными границами, окруженные перифокальным отеком
о Кровоизлияние может прорываться в субарахноидальное пространство или в полость желудочков
о Пациенты могут поступать в лечебное учреждение с конвекситальными субарахноидальными кровоизлияниями
о Редко: гиральная кальцификация
о Часто встречается генерализованная атрофия мозговой ткани
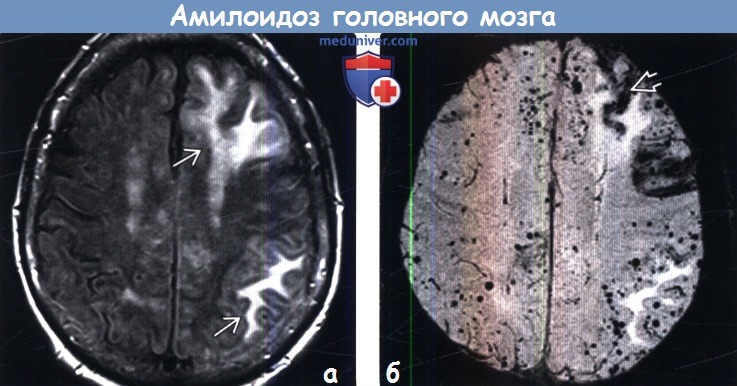
(б) MPT, SWI, аксиальный срез: у этой же пациентки определяются многочисленные очаги артефакта восприимчивости по типу «выцветания» изображения, представляющие собой типичные при ЦАА микрокровоизлияния в паренхиму мозга. Линейный гипоинтенсивный участок представляет собой зону поверхностного сидероза.
При биопсии была диагностирована воспалительная форма амилоидоза. Ответ на стероидную терапию был удовлетворительным.
3. МРТ при амилоидозе головного мозга:
• Т1-ВИ:
о Лобарная гематома (характеристики сигнала варьируют в зависимости от ее давности)
• Т2-ВИ:
о Острая гематома, изо-/гипоинтенсивный сигнал:
— У 1 /3 пациентов имеются признаки старых кровоизлияний (долевых, петехиальных), визуализируемых, как мультифокальные «черные точки»
о Сочетается с разрозненными/сливными очагами поражения БВ почти в 70% случаев
о Редкие формы: не геморрагическое диффузное воспаление со сливными гиперинтенсивными очагами в структуре БВ:
— Острый вазогенный отек белого вещества может визуализироваться при острых воспалительных формах:
Визуализационная картина может имитировать синдром задней обратимой энцефалопатии (СЗОЭ)
— Асимметричный характер повреждения и наличие множественных микрокровоизлияний позволяют выдвинуть предположение о наличии ЦАА
— Отсутствие типичных для СЗОЭ предрасполагающих факторов (например, гипертонический криз, иммунодепрессорная терапия)
— Острая воспалительная ЦАА = ответ на стероидную терапию
• Т2* GRE:
о Мультифокальные «черные точки»
• Постконтрастные Т1-ВИ:
о ЦАА, долевые кровоизлияния обычно не контрастируются
о Амилоидома (фокальное объемное образование[я] без геморрагического компонента):
— Масс-эффект обычно минимальный/умеренный
— Возможно умеренно интенсивное/выраженное контрастирование, что может имитировать новообразование
— Часто распространяются от медиальной к латеральной желудочковой стенке с тонкими радиальными накапливающими контраст краями
— Редко: инфильтрация
о Воспалительная форма (БАА):
— Возможно контрастное усиление борозд, цистерн
• Изображение, взвешенное по магнитной восприимчивости (SWI):
о Мультифокальные гипоинтенсивные очаги (микрокровоизлияния) сходные с таковыми на Т2* GRE, но данный метод более чувствителен в их выявлении
4. Радионуклидная диагностика:
• 99m Tc-ECD ОФЭКТ: снижение церебральной перфузии
• Агенты для ПЭТ визуализации амилоидоза (меченный углерод-11 питтсбургского состава В [11С PiB])
о Демонстрация накопления β-амилоида
5. Рекомендации по визуализации:
• Лучший инструмент визуализации:
о Бесконтрастная КТ = лучший скрининговый метод (для визуализации острых кровоизлияние)
о МРТ с Т2* или SWI для оценки неострой патологии (деменция)
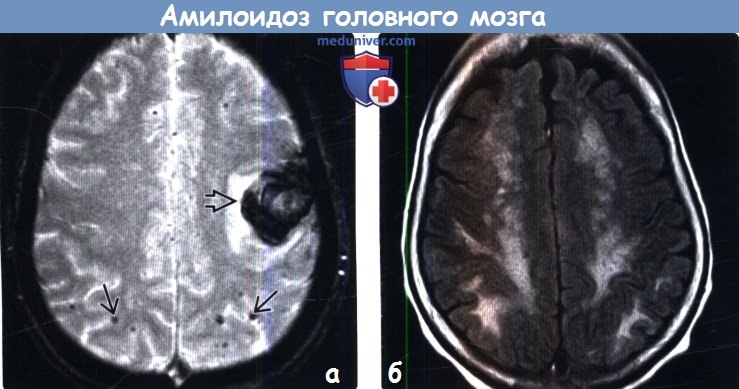
(б) МРТ, FLAIR, аксиальный срез: у пациента 73 лет с WFF определяются типичные сливные очаги в структуре белого вещества, которые могут визуализироваться при церебральной амилоидной ангиопатии и атеросклерозе (хроническая микроваскулярная ишемия). По данным SWI изображений (не представлены) были подтверждены множественные микрокровоизлияния, типичные для ЦАА, 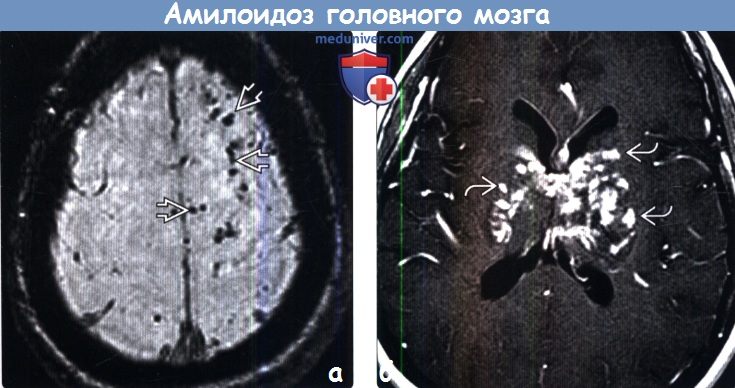
(б) МРТ, постконтрастное Т1-ВИ, аксиальный срез: билатерально в структуре базальных ганглиев, а также перивентрикулярного белого вещества периваскулярно по ходу сосудистых структур определяются множественные мелкие очаги контрастного усиления с умеренным масс-эффектом. Такие признаки («амилоидомы», имитирующие неопластический процесс или возможную атипичную инфекционную/воспалительную этиологию) наблюдаются в меньшинстве случаев амилоидоза.
в) Дифференциальная диагностика:
3. Течение и прогноз:
• Неоднократные рецидивирующие кровоизлияния
• Прогрессивное ухудшение когнитивных функций
4. Лечение:
• Эвакуация фокальной гематомы при возрасте пациента
Видео этиология, патогенез амилоидоза
Редактор: Искандер Милевски. Дата публикации: 18.3.2019
Амилоидная ангиопатия что это
Российская медицинская академия последипломного образования, Москва
Российская медицинская академия последипломного образования
Отдел лучевой диагностики городской клинической больницы им. С.П. Боткина, Москва
Церебральная амилоидная ангиопатия
Журнал: Журнал неврологии и психиатрии им. С.С. Корсакова. Спецвыпуски. 2014;114(6-2): 87-93
Макотрова Т. А., Левин О. С., Араблинский А. В. Церебральная амилоидная ангиопатия. Журнал неврологии и психиатрии им. С.С. Корсакова. Спецвыпуски. 2014;114(6-2):87-93.
Makotrova T A, Levin O S, Arablinskiĭ A V. Cerebral amyloid angiopathy. Zhurnal Nevrologii i Psikhiatrii imeni S.S. Korsakova. 2014;114(6-2):87-93.
Российская медицинская академия последипломного образования, Москва
Российская медицинская академия последипломного образования, Москва
Российская медицинская академия последипломного образования
Отдел лучевой диагностики городской клинической больницы им. С.П. Боткина, Москва
Этиология и патогенез
Накопление β-амилоида может быть связано с нарушением процесса его клиренса, осуществляемого через периваскулярные пространства. В результате отложения β-амилоида происходит изменение архитектуры сосудистой стенки, могут развиваться фибриноидный некроз, гиалиновая дегенерация сосудов с облитерацией их просвета, формироваться микроаневризмы [5]. Эндотелий остается интактным даже в сосудах, тяжело пораженных ЦАА.
Выделяют 2 основных типа ЦАА. При 1-м типе ЦАА β-амилоид откладывается в корковых капиллярах, лептоменингеальных и корковых артериях, артериолах, реже венах и венулах. При 2-м типе ЦАА при иммуногистохимическом исследовании β-амилоид преимущественно обнаруживается в лептоменингеальных и корковых сосудах, но не в корковых капиллярах. Частота аллеля APOEe4 при ЦАА 1-го типа в 4 раза выше, чем при ЦАА 2-го типа [9]. Последний более тесно связан с АРОЕе2. ЦАА 1-го типа в большей степени связана с паренхиматозным отложением амилоида при БА.
Описаны как спорадические, так и семейные случаи ЦАА. Последние встречаются реже спорадических, но возникают в более раннем возрасте и имеют более тяжелое клиническое течение. Семейные случаи ЦAA связаны с мутациями белка-предшественника амилоида, а также генов цистатина C и транстиретина. Гетерогенность находит выражение в клиническом полиморфизме ЦАА [10]. Клинически ЦАА может проявляться повторяющимся геморрагическим инсультом (внутримозговыми кровоизлияниями), когнитивным снижением, вплоть до развития деменции, кратковременными эпизодами очаговой неврологической симптоматики.
Транзиторные неврологические эпизоды (ТИА-подобные пароксизмы, или «амилоидные кризы») характеризуются стереотипно повторяющимися приступами распространяющихся позитивных сенсорных симптомов (парестезий), парциальными моторными эпилептиформными эпизодами (встряхивания конечностями) или зрительными нарушениями (позитивные симптомы, напоминающие ауру при мигрени). Пароксизмы обычно длятся от нескольких минут до получаса и могут быть связаны с церебральными геморрагиями: при МРТ в таких случаях могут выявляться ЦМК или конвекситальные субарахноидальные кровоизлияния в соответствующих зонах коры. Подобные приступы нередко принимают за ТИА, в результате чего могут быть ошибочно назначены антитромботические средства, которые приводят к стойким геморрагическим осложнениям. В то же время позитивная реакция на противоэпилептические средства свидетельствует о возможном эпилептическом происхождении приступов.
Риск спорадических случаев ЦАА может быть связан с аллельным полиморфизмом гена АпоЕ4. Аллели &egr;4 и &egr;2 повышают риск ЦАА и связанного с ней внутримозгового лобарного кровоизлияния, в том числе повторного. Пациенты с множественными ЦМК чаще бывают гомозиготны по аллелю &egr;4. Тем не менее диагностическое значение аллелей гена AроE пока остается недостаточно изученным [11].
Кроме того, ЦAA связана с полиморфизмом других генов, в том числе пресенилина1, α1-антихимотрипсина, неприлизина, рецепторами липопротеинов низкой плотности, а также генов ингибитора ангиотензинпревращающего фермента и CR1 [12].
Внутримозговые кровоизлияния при ЦАА
У пациентов с внутримозговыми кровоизлияниями церебральные микроинфаркты и другие ишемические острые повреждения на МРТ описаны в режиме DWI. При патоморфологическом исследовании у пациентов с ЦМК обнаруживаются корковые инфаркты, которые могут отражать наличие ЦАА. Альтернативной гипотезой, объясняющей корковые микроинфаркты, является их связь с микроэмболизацией проксимальных артерий, пораженных атеросклерозом [10, 16, 17].
ЦАА увеличивает риск внутримозговых кровоизлияний при тромболитической терапии по поводу инфаркта миокарда, эмболии легочной артерии, ишемического инсульта, а также приеме варфарина. Применение антиагрегантной терапии, в частности аспирина, связано с повышенным риском ЦМК в корковых отделах 19. Спровоцировать кровоизлияние может также легкая травма головы.
Когнитивные нарушения при ЦАА
Показано, что при ЦАА наблюдаются нарушения нейродинамических когнитивных функций, прежде всего замедление скорости сенсомоторных реакций, а также расстройство эпизодической памяти [26]. При сочетании ЦАА и БА выявляется профиль, типичный для БА, в этом случае отмечаются характерные для БА изменения уровня биомаркеров в цереброспинальной жидкости (ЦСЖ) 27. ЦАА усугубляет влияние нейродегенеративной патологии на мозг, снижая порог развития деменции. Таким образом, заболевание осуществляет связь между нейродегенеративной и цереброваскулярной патологией.
Диагностика ЦАА
МРТ играет центральную роль в диагностике ЦАА. МРТ в эхоградиент (GRE) Т2*-режиме позволяет обнаружить «старые» и «свежие» ЦМК в виде гипоинтенсивных малых очагов, которые не видны с помощью других методов визуализации (рис. 1 и 2). 






Бостонские критерии [30, 35], используемые в настоящее время для диагностики ЦAA, опираются на преимущественную локализацию кровоизлияний в корковых областях мозга. В соответствии с этими критериями вероятный диагноз ЦАА может быть установлен у пациентов в возрасте старше 55 лет не менее чем с двумя корковыми (лобарными) поражениями при исключении другой этиологии кровоизлияний [30]. Недавно была произведена модификация Бостонских критериев с включением в них лобарных ЦМК, что повысило их чувствительность (см. таблицу).
Лабораторные биомаркеры
Воспаление при ЦАА
Воспалительная форма ЦAA (церебральный амилоидный ангиит), как правило, встречается у пожилых и проявляется остро или подостро развивающимся когнитивным снижением, головной болью, эпилептическими припадками, очаговым неврологическим дефицитом, поражением белого вещества на МРТ. В нейропсихологическом профиле доминируют прогрессирующие когнитивные нарушения по альцгеймеровскому типу.
APOE &egr;2/&egr;4-генотип имеет связь с ЦAA, опосредованной воспалением, что повышает риск воспалительной формы ЦАА, в том числе на ее ранней стадии, о чем свидетельствуют васкулит и периваскулярное воспаление при патоморфологическом исследовании. У другой группы пациентов с ЦAA, опосредованной воспалением, было обнаружено повышение титра аутоантител к Aβ40 и Aβ42 в ЦСЖ с его последующим снижением после лечения кортикостероидами [44].
Перспективы лечения
В исследовании PROGRESS было показано, что снижение АД (независимо от наличия или отсутствия артериальной гипертонии) уменьшает риск внутримозговых кровоизлияний, связанных с ЦАА, на 77% при наблюдении в течение 3,9 года. Статины могут повышать риск геморрагического инсульта, особенно у лиц, недавно перенесших внутримозговое кровоизлияние, в том числе связанное с ЦАА. Соответственно в подобной ситуации следует избегать их назначения. Однако остается неясным, следует ли распространять подобную рекомендацию на лиц с множественными лобарными ЦМК, у которых можно подозревать ЦАА.
Следует учитывать, что риск кровоизлияния связан с численностью лобарных ЦМК и наличием лейкоареоза в задних отделах полушарий головного мозга, которые могут служить своеобразным маркером ЦАА и ее тяжести [35].
Вопрос о том, являются ли множественные лобарные ЦМК (без макрокровоизлияний) основанием для отказа от применения антитромботических средств, требует дальнейшего изучения. На сегодняшний день показано, что при варфарин-индуцированных кровоизлияниях ЦМК встречаются чаще, чем при спонтанных внутримозговых кровоизлияниях. При этом наличие ЦМК повышало риск кровоизлияний при приеме антитромботиков более чем в 10 раз.
На данный момент очевидно, что следует избегать антикоагулянтов у пациентов с ЦАА, перенесших внутримозговое кровоизлияние, за исключением случаев, когда риск повторного кровоизлияния перевешивается непосредственной опасностью для жизни (например, при тяжелой тромбоэмболии легочной артерии или наличии механического клапана сердца).
Хотя антиагреганты также повышают риск внутримозговых кровоизлияний у больных ЦАА, их назначенние возможно у отдельных категорий больных ЦАА для вторичной профилактики ишемических эпизодов, если риск кровоизлияния представляется относительно низким. При первичной профилактике соотношение риска и пользы скорее свидетельствует в пользу отмены антитромботических средств при выявлении множественных лобарных ЦМК [35].
Заключение
В настоящее время существует возможность прижизненной диагностики ЦАА на разных стадиях с помощью биохимических и нейровизуализационных методов исследования. Возможность ранней диагностики ЦАА снижает повышенный риск церебральных кровоизлияний при использовании тромболитической терапии при остром инфаркте миокарда, эмболии легочной артерии, ишемическом инсульте, а также применении варфарина. Кроме того, диагностика ЦАА прогностически важна для уточнения диагноза, оценки течения и прогноза нейродегенеративных заболеваний с когнитивными нарушениями.
Так, мы предполагаем, что сочетание изменений биомаркеров в ЦСЖ (снижение уровня Aβ42, увеличение соотношения Aβ40/Aβ42, а также увеличение уровней общего и фосфорилированного &tgr;-протеина) и наличия корковых ЦМК может иметь наибольшую специфичность для выявления ЦАА при умеренных когнитивных нарушениях, что может позволить определить их прогноз.
Церебральная амилоидная ангиопатия и гипертензивная церебральная микроангиопатия. Дифференциальный диагноз
Полный текст
Аннотация
Церебральная амилоидная ангиопатия (ЦАА) и гипертензивная церебральная микроангиопатия (гЦМА) имеют целый ряд сходных клинических проявлений, однако прогноз, лечение и подходы к профилактике инсультов у больных с этими заболеваниями различны, что определяет важность их дифференциальной диагностики. В данной статье обсуждаются наиболее значимые отличительные клинические признаки ЦАА, такие как «амилоидные периоды», конвекситальное субарахноидальное кровоизлияние, клинические проявления лобарных гематом и микрокровоизлияний. Важными нейровизуализационными отличиями ЦАА от гЦМА служат кортикальный поверхностный сидероз, конвекситальное субарахноидальное кровоизлияние, кортикальные микрокровоизлияния, «лобарные» лакуны, расширение периваскулярных пространств в полуовальном центре, гиперинтенсивность белого вещества в задних отделах головного мозга.
Ключевые слова
Полный текст
Гипертензивная церебральная микроангиопатия (гЦМА) и церебральная амилоидная ангиопатия (ЦАА) представляют собой наиболее частые формы болезней мелких сосудов головного мозга и являются важными факторами риска развития инсультов, занимающих лидирующее место в структуре смертности и инвалидизации населения [4, 14, 23]. Клинические проявления поражения мелких сосудов головного мозга при ЦАА и гЦМА имеют некоторое сходство [14, 23], которое определяет важность их дифференциальной диагностики, поскольку подходы к терапии и профилактике инсультов, а также прогноз для восстановления больных при этих заболеваниях существенно различаются [11, 46].
Цель данного обзора – представить клинико-нейровизуализационные отличительные признаки ЦАА и гЦМА, позволяющие провести их дифференциальную диагностику в неврологической практике.
Церебральная амилоидная ангиопатия – это патология сосудов головного мозга среднего и мелкого калибра, характеризующаяся отложением бета-амилоида в стенках лептоменингеальных артерий/артериол, а также артерий, артериол (реже – венул) и капилляров коры головного мозга [15, 37, 46]. Диаметр вовлекаемых в патологический процесс сосудов варьирует от 5 микрон до 2 мм [21]. Распространенность ЦАА в популяции варьирует от 20 до 40%, а у пожилых лиц с деменцией составляет 50–60% [31]. Тем не менее, ЦАА является существенно более редкой формой патологии, чем цГМА, которая встречается у 60% пациентов с артериальной гипертензией (АГ) в возрасте старше 55 лет и у 80 % – старше 85 лет [1, 7].
Общими звеньями патогенеза микроангиопатии как при ЦАА, так и при АГ являются снижение эластичности сосудистой стенки, нарушение ауторегуляции мозгового кровотока, эндотелиальная дисфункция с повреждением гематоэнцефалического барьера и развитие асептического нейровоспалительного процесса [21]. В то же время, имеются существенные патогенетические различия ЦАА и гЦМА, определяющие их клинические и нейровизуализационные проявления. Эти различия во многом связаны с особенностями архитектоники страдающих при данных заболеваниях внутримозговых церебральных сосудов и сосудов мягкой мозговой оболочки [4, 21, 29].
Основную часть мягкой мозговой оболочки (лат. pia mater, «нежная мать») составляют пиальные артерии. Они обозначаются также как «лептоменингеальные» артерии (от греч. leptos – тонкий, нежный и meninx – мозговая оболочка) [9]. От лептоменингеальных (пиальных) артерий) отходят пенетрирующие артериолы, которые окружены периваскулярными пространствами Вирхова–Робина и дают начало концевым и лишенным дистальных анастомозов ветвям – паренхиматозным артериолам [9, 39]. Паренхиматозные артериолы окружены только одним слоем спирально расположенных гладких мышц, не имеют коллатералей и не реагируют на многие нейротрансмиттеры, на которые реагируют пиальные артерии [9].
При гЦМА страдают прежде всего пенетрирующие и паренхиматозные артериолы головного мозга, диаметр которых составляет от 40 до 900 микрон [21]. Это связывают с тем, что при длительной АГ стенки церебральных артериол утолщаются из-за вызванной сокращением гладких мышц гипертрофии мышечного слоя. Такая гипертрофия мышечного слоя церебральных мелких артерий и артериол, с одной стороны, имеет приспособительное значение, так как «срыв» ауторегуляции мозгового кровообращения» возникает при более высоких значениях артериального давления [4, 42]. С другой стороны, повышается «жесткость» стенок артериол и кровоток в них приобретает «пульсирующий» характер, при этом короткие прямые пенетрирующие артериолы начинают испытывать повышенную гемодинамическую нагрузку. Эта нагрузка передается непосредственно на их концевые ветви, т.е. на паренхиматозные артериолы, вызывая ослабление контактов между их эндотелиальными клетками, нарушение целостности гематоэнцефалического барьера и проникновение компонентов крови в сосудистую стенку [42, 49].
В стенках артериол головного мозга у больных с длительно существующей АГ при морфологических исследованиях выявляются такие гистопатологические изменения, как фибриноидный некроз, гиалиноз, милиарные аневризмы [3, 4]. На поздних стадиях цГМА развиваются микротромбозы и формируются церебральные лакунарные инфаркты, развитию которых способствует отсутствие коллатералей у измененных паренхиматозных артериол [1, 3, 38]. Таким образом, гЦМА проявляется прежде всего поражением пенетрирующих и паренхиматозных артериол с развитием мелких инфарктов в глубинных отделах головного мозга [1, 3, 4].
Что касается ЦАА, то ее морфологическую основу составляют отложения амилоида прежде всего в стенках поверхностных церебральных сосудов. β-амилоид представляет собой протеин, содержащий от 38 до 42 аминокислот [5]. Он образуется в результате последовательного расщепления трансмембранного белка-предшественника β-амилоида (англ. amyloid precursor protein, сокращенно АРР). В основном β-амилоид откладывается в корковых и лептоменингеальных (пиальных) артериях и артериолах, в меньшей степени – в капиллярах и крайне редко – в венулах [48]. На поздних стадиях развития ЦАА наблюдается некроз стенок сосудов, формирование микроаневризм, разрывы сосудов с возникновением микро и макро кровоизлияний [34]. Что касается крупных инфарктов головного мозга, то для ЦАА они не характерны, поскольку вовлекающиеся в патологический процесс лептоменингеальные артерии соединены между собой множеством анастомозов, и окклюзия одной или нескольких из них не приводит к существенному снижению церебрального кровотока и ишемии вещества мозга [42]. В то же время, мелкие инфаркты в коре и белом веществе головного мозга при ЦАА возможны. Они развиваются вне зависимости от возраста и наличия сопутствующей АГ, и их происхождение связывают с окклюзией артериол и капилляров из-за отложений бета-амилоида в их стенках [43].
В настоящее время описывается новый вариант ЦАА, а именно – ЦАА, ассоциированная с воспалением. Это заболевание лиц пожилого возраста связано с воспалительными реакциями на отложения бета-амилоида в сосудах головного мозга при ЦАА [37]. Выделяют два варианта этого процесса. Первый вариант обозначается как «связанное с ЦАА воспаление» (англ. «cerebral amyloid angiopathy-related inflammation» CAA-RI); его морфологической основой является воспалительный клеточный инфильтрат, занимающий периваскулярные пространства. Второй вариант обозначается как «А-бета-связанный ангиит» (англ. «A-beta related angiitis» ABRA). Он представляет собой трансмуральный (вовлекающий все стенки сосуда) васкулит [37]. Следует отметить, что у ряда пациентов возможно сочетание ЦАА и гЦМА, в этом случае наблюдается так называемая «смешанная ангиопатия». Обсуждается два наиболее вероятных механизма этого явления: независимое параллельное развитие гЦМА и ЦАА (возникающих одновременно при наличии одних и тех же факторов риска), либо вторичное возникновение ЦАА на фоне повреждения стенок сосудов при гЦМА [23].
Клинические особенности ЦАА и гЦМА имеют как сходство, так и различия. Их общими клиническими проявлениями являются повторные инсульты и прогрессирующее когнитивное снижение [21, 36]. Различия между ЦАА и гипертензивной микроангиопатией заключаются в том, что для ЦАА характерны эпизоды преходящей очаговой неврологической симптоматики, обозначаемые как «амилоидные периоды» (англ. transient focal neurological episodes); спонтанные микрокровоизлияния и обширные лобарные (не выходящие за пределы коры и белого вещества доли) кровоизлияния, повторные конвекситальные субарахноидальные кровоизлияния [13, 17, 35]. Существенно реже при ЦАА наблюдаются лакунарные ишемические инфаркты, мигренозные атаки и эпилептические припадки [24, 39].
Для гЦМА более типичны транзиторные ишемические атаки (ТИА), повторные лакунарные ишемические инсульты (часто – асимптомные), нарушения ходьбы по типу лобно-подкорковой дисбазии, недержание мочи по центральному типу, глубинные внутримозговые кровоизлияния [3, 4, 6].
Амилоидные периоды представляют собой стереотипные повторяющиеся приступы преходящей очаговой неврологической симптоматики, продолжительностью от нескольких минут до получаса. Чаще всего наблюдаются распространяющиеся парестезии или зрительные нарушения, напоминающие ауру при мигрени, возможны также преходящий парез и афазия [13]. Полагают, что амилоидные периоды связаны с микрокровоизлияниями, локализующимися по соседству с первичной моторной и сенсорной корой [41]. Как возможные механизмы амилоидных периодов обсуждаются фокальные эпилептические припадки, распространяющаяся кортикальная депрессия или локальный вазоспазм при фокальном накоплении продуктов распада крови в субарахноидальном пространстве и поверхностных слоях коры [13].
Амилоидные периоды при ЦАА клинически похожи на ТИА при гЦМА, но их важно отличать от последних из-за различной тактики ведения больных. Так, например, назначение дезагрегантов (показанных больным с ТИА при цГМА) способно спровоцировать массивные кровоизлияния при ЦАА [11, 36, 46].
Церебральные микрокровоизлияния – это результат субклинического «просачивания» компонентов крови через стенку поражённого сосуда в паренхиму головного мозга, приводящего к последующему отложению в ней гемосидерина. Они более характерны для ЦАА, чем для гипертензивной микроангиопатии [18, 28, 39].
Обширные внутримозговые кровоизлияния считаются важными клиническими проявлениями как ЦАА, так и гЦМА [39]. При нетравматическом внутримозговом кровоизлиянии у пожилых лиц всегда необходим дифференциальный диагноз ЦАА и гЦМА [4, 23, 35].
Клинические особенности внутримозговых кровоизлияний при ЦАА определяются тем, что они имеют в основном лобарное, кортикальное или субкортикальное расположение [34]. Их размеры варьируют от мелких до крупных, они склонны к рецидивам, и частота таких рецидивов составляет около 30% в год [39]. Каждое новое кровоизлияние при ЦАА обычно имеет другую локализацию по сравнению с предыдущим [26]. В случаях, когда кровоизлияние происходит из кортикальных сосудов, оно нередко распространяется и на конвекситальное субарахноидальное пространство [17].
Для больных с гипертензивной микроангиопатией характерны кровоизлияния в базальные ганглии, таламус и варолиев мост (что и определяет особенности их клинических проявлений), в то время как лобарные гематомы, в отличие от гЦМА, не столь характерны [23].
Ишемические инсульты могут наблюдаться в клинике как ЦАА, так и гипертензивной микроангиопатии. Преобладают лакунарные ишемические инсульты, асимптомные или проявляющиеся «лакунарными синдромами» [25, 44]. В этой связи следует заметить, что исходно термин «лакунарный инсульт» был предложен C. Miller Fisher для обозначения только лишь глубинно расположенных мелких инфарктов у больных с гипертонической болезнью [22], однако позднее все маленькие инфаркты стали обозначаться как «лакунарные» [40, 42]. Различия лакунарных инсультов при ЦАА и гЦМА касаются не их клинических симптомов, а частоты встречаемости: при гипертонической болезни они развиваются значительно чаще, чем при ЦАА [29].
Другими общими для ЦАА и гЦМА проявлениями служат прогрессирующие когнитивные нарушения. На ранних стадиях обеих этих форм патологии в наибольшей степени страдают регуляторные функции: замедляется скорость обработки получаемой информации, нарушается концентрация и возможности переключения внимания, ухудшается кратковременная слухо-речевая память (затрудняется активное воспроизведение информации при сохранности ее узнавания [2, 12, 31]. Эпизодическая память и зрительно-пространственные функции, связанные с функциональной активностью задних отделов головного мозга, вначале остаются интактными, снижаясь лишь на поздних стадиях как ЦАА, так и гЦМА. [27].
Особенностью когнитивных нарушений при гЦМА является их сочетание с нарушениями походки (лобная дисбазия) и дисфункцией тазовых органов по типу центрального недержания мочи. Эти нарушения объясняют характерным для гипертензивной микроангиопатии поражением подкоркового белого вещества, приводящим к «разобщению» лобной коры и базальных ганглиев [2].
ЦАА, ассоциированная с воспалением, имеет свои клинические особенности, отличающие ее и от «классической» ЦАА, и от гЦМА [37]. Основу ее клинической симптоматики составляет очаговый неврологический дефицит, фокальные эпилептические припадки на фоне когнитивного дефицита. Однако в ряде случаев симптоматика «стерта» и ограничивается лишь цефалгиями и зрительными расстройствами, несмотря на наличие множественных очагов церебрального поражения по данным нейровизуализации [20].
Нейровизуализационные исследования занимают важное место в дифференциальной диагностике микроангиопатий. Сходство нейровизуализационных изменений при ЦАА и гЦМА заключается в том, что при обеих этих формах патологии выявляются так называемые «нейровизуализационные маркеры» поражения мелких сосудов, к которым относят: 1) «недавние мелкие субкортикальные инфаркты»; 2) лакуны; 3) цереб-ральные микрокровоизлияния; 4) расширение периваскулярных пространств; 5) гиперинтенсивность белого вещества; 6) атрофия вещества головного мозга [45].
Термином «мелкий недавний субкортикальный инфаркт» (англ. recent small subcortical infarct) или «церебральный микроинфаркт» обозначают выявляемый при КТ или МРТ очаг поражения головного мозга, максимальный диаметр которого составляет менее 20 мм и который соответствует развившейся в предшествующие несколько недель острой ишемии в зоне кровоснабжения одной перфорирующей артериолы. Эти инфаркты локализуются субкортикально, как в белом, так и в сером веществе головного мозга, и не затрагивают субкортикальных U-волокон [45]. Субкортикальные U волокна (соединяющие соседние извилины непосредственно под корой головного мозга) при мелких инфарктах обычно остаются интактными, поскольку чаще всего получают «двойное» кровоснабжение из соседних перфорирующих артериол [39].
На КТ эти очаги выглядят как участки пониженной плотности вещества головного мозга. На МРТ данный очаг является гиперинтенсивным на T2-взвешенных изображениях, при использовании импульсной последовательности FLAIR и на диффузионно-взвешенных изображениях (англ Diffusion-Weighted Imagies, сокращенно DWI). DWI последовательности являются наиболее чувствительными при выявлении очагов острой ишемии, однако верификация инфаркта головного мозга на основании высокого сигнала на картах с высоким коэффициентом молекулярной диффузии (b = 1000) не является достоверной без верификации гипоинтенсивности соответствующей зоны по ADC-карте [39, 44].
Следует отметить, что мелкие инфаркты субкортикальной локализации характерны лишь для гЦМА, и не типичны для ЦАА, поскольку ЦАА, как отмечалось, поражает кортикальные и лептоменингеальные сосуды. Из-за наличия множества анастомозов инфаркты при закупорке этих артерий возникают очень редко, а если и возникают, то имеют преимущественно корковую локализацию [9].
Термином «лакуна» в нейровизаулизации обозначают полость круглой или овоидной формы, заполненную жидкостью, диаметром от 3 до15 мм [21, 29]. Лакуны могут располагаться как в глубинных отделах серого и белого вещества головного мозга – в базальных ганглиях, таламусе, внутренней капсуле, варолиевом мосту («глубинные лакуны»), так и в поверхностном белом подкорковом веществе («лобарные лакуны») [21, 29].
Появление лакун связывают с ранее перенесенными мелкими ишемическими инфарктами (вызванными закупоркой лишенных анастомозов пенетрирующих артерий и паренхиматозных артериол) или мелкими кровоизлияниями [29, 39, 45]. МРТ-сигнал при этом аналогичен сигналу от ЦСЖ. На КТ лакуны выглядят как мелкие гиподенсные очаги, а на МРТ при использовании импульсной последовательности FLAIR – как области с высоким сигналом, «щадящие» U-волокна [39].
При гЦМА существенно чаще обнаруживаются «глубинные лакуны», чем «лобарные», в то время как при ЦАА преобладают «лобарные» лакуны [29, 39]. Этот признак предлагается использовать для дифференциальной диагностики гипертензивной микроангиопатии и ЦАА, хотя количественных критериев в отношении этих показателей пока не предложено [29].
Гиперинтенсивность белого вещества – это нейровизуализационный термин, обозначающий диффузные изменения в области перивентрикулярного белого вещества [3, 14, 39]. Белое вещество головного мозга преимущественно состоит из миелинизированных аксонов, соединяющих, в частности, кору и базальные ганглии. Кровоснабжение белого вещества осуществляется из мелких пенетрирующих артериол, которые отходят от лептоменингеальных артерий и пересекают кору головного мозга перед вступлением в белое вещество [14, 39]. В этой связи при гЦМА наиболее подвержено ишемии перивентрикулярное белое вещество, поскольку оно наиболее удалено от коры [14, 39].
При МРТ диффузные связанные с ишемией изменения белого вещества выглядят гиперинтенсивными на T2-взвешенных изображениях, а также при использовании импульсной последовательности FLAIR Гиперинтенсивность белого вещества выявляется и при гипертензивной микроангиопатии, и при ЦАА [14, 21].
Различия заключаются в том, что при ЦАА эти изменения преобладают в задних областях головного мозга и в перивентрикулярном белом веществе, окружающем задние рога боковых желудочков, в то время как при гЦМА страдает вся перивентиркулярная область [14, 21].
Гиперинтенсивность белого вещества также наблюдается и при ЦАА-ангиите. На МРТ обнаруживаются инфильтративно-подобные (псевдотуморозные) изменения белого вещества, которые на Т2-ВИ и при использовании импульсной последовательности FLAIR являются гиперинтенсивными, обладают масс-эффектом и не накапливают контрастное вещество [37]. Эти изменения требуют дифференциальной диагностики с глиомой головного мозга [37].
Атрофия коры головного мозга – ещё один нейровизуализационный признак как ЦАА, так и цГМА, характеризующийся снижением объема вещества головного мозга, которое не связано с макроскопическим локальным повреждением (таким как травма или инфаркт) и нарастает со временем. Полагают, что к постепенно прогрессирующей атрофии коры головного мозга приводит возникновение церебральных лакун, нарушающих целостность аксонов кортикальных нейронов и в итоге приводящих к гибели последних [39].
На сегодняшний день оценка кортикальной атрофии требует проведения МРТ головного мозга с применением специализированных трёхмерных последовательностей с волюметрической постобработкой [39].
Микрокровоизлияния – это мелкие участки округлой или овоидной формы диаметр которых чаще всего составляет 2–5 мм, хотя иногда достигает и 10 мм. Клинически они могут быть асимптомными [25]. На КТ такие очаги обычно не видны. Они хорошо заметны на МРТ при использовании последовательности градиентное эхо (англ. GRE или T2*); и на изображениях, взвешенных по магнитной восприимчивости (англ. SWI) [39].
Отличия между ЦАА и гЦМА заключаются в том, что микрокровоизлияния в первом случае являются преимущественно лобарными и расположенными главным образом в задних отделах головного мозга, а во втором случае – локализующимися в основном в глубинных структурах головного мозга [23, 30]. Микрогеморрагии в мозжечке могут быть следствием как ЦАА, так и гЦМА [19]. Ранее локализация микрокровоизлияний в мозжечке считалась мало типичной для ЦАА [30, 39], однако в последнее время эта точка зрения пересматривается: указывается на то, что поверхностные мозжечковые кровоизлияния (в черве и в поверхностных отделах гемисфер) более характерны для ЦАА, а геморрагии в области глубоких ядер мозжечка – для гЦМА [30, 33, 39].
Расширение периваскулярных пространств считается новым нейровизуализационным маркером церебральных микроангиопатий [16]. Данные периваскулярные пространства имеют линейную форму, если сосуд проходит в плоскости изображения, и округлую форму (диаметр менее 3 мм), если ход сосуда перпендикулярен плоскости изображения [21].
Периваскулярные пространства на МРТ являются гиперинтенсивными на T2-взвешенных изображениях и гипоинтенсивные при использовании импульсной последовательности FLAIR. Расширение периваскулярных пространств при ЦАА наиболее выражено в полуовальных центрах, а при гЦМА – в области базальных ганглиев [16].
Конвекситальное субарахноидальное кровоизлияние – нейровизуализационный маркер, характерный в основном для ЦАА [17]. Конвекситальное субарахноидальное кровоизлияние (кСАК) – это неаневризматическое субарахноидальное кровоизлияние со скоплением крови в пределах одной-двух кортикальных борозд по конвекситальной поверхности головного мозга, не распространяющееся в сильвиевы борозды, межполушарную щель, базальные цистерны и желудочки головного мозга [8, 10]. Подобное субарахноидальное кровоизлияние хорошо визуализируется как на КТ, так и на МРТ головного мозга при использовании ее специальных режимов [39]. Чувствительность КТ в диагностике кСАК очень высока лишь в острейшем периоде, а в дальнейшем быстро снижается. Напротив, импульсные последовательности FLAIR, Т2*, SWI при выполнении МРТ головного мозга обладают более высокой чувствительностью в подострую фазу кСАК [17]. В подострую и хроническую фазу кСАК остатки распада крови можно увидеть на МРТ в виде так называемого кортикального поверхностного сидероза (cSS) [32].
Кортикальный поверхностный сидероз – поверхностные отложения гемосидерина (продукта распада гемоглобина) в субарахноидальном пространстве и субпиальных поверхностных слоях церебральной или церебеллярной коры, образующиеся после интрасулькальных асимптомных микрокровоизлияний [19, 32, 47]. Данный нейровизуализационный признак характерен исключительно для ЦАА и рассматривается как индикатор повышенного риска развития последующих лобарных кровоизлияний при этой патологии [19].
Заключение. Гипертензивная микроангиопатия и церебральная амилоидная ангиопатия являются наиболее частыми формами болезней мелких сосудов головного мозга и требуют дифференциальной диагностики.
Клинические и нейровизуализационные различия заключаются в том, что для ЦАА характерны «амилоидные периоды», лобарные микрои макрокровоизлияния (преимущественно в задних отделах головного мозга), конвекситальные субарахноидальные кровоизлияния, кортикальный поверхностный сидероз.
Для гипертензивной микроангиопатии более типичны транзиторные ишемические атаки, глубинные внутримозговые гематомы и лакунарные ишемические инсульты. Расширение периваскулярных пространств при ЦАА наиболее выражено в полуовальных центрах, а при гипертензивной микроангиопатии – в области базальных ганглиев.
Решающее значение в дифференциальной диагностике ЦАА и гЦМА придается результатам МРТ головного мозга с дополнительным использованием таких импульсных последовательностей как: Т2* градиентное эхо, FLAIR и SWI для выявления геморрагических феноменов, и DWI – для выявления очагов острой ишемии.
Вышеописанные признаки позволяют своевременно различить церебральную амилоидную ангиопатию и гипертензивную микроангиопатию, что имеет значение для определения прогноза заболевания и тактики лечения больных.


