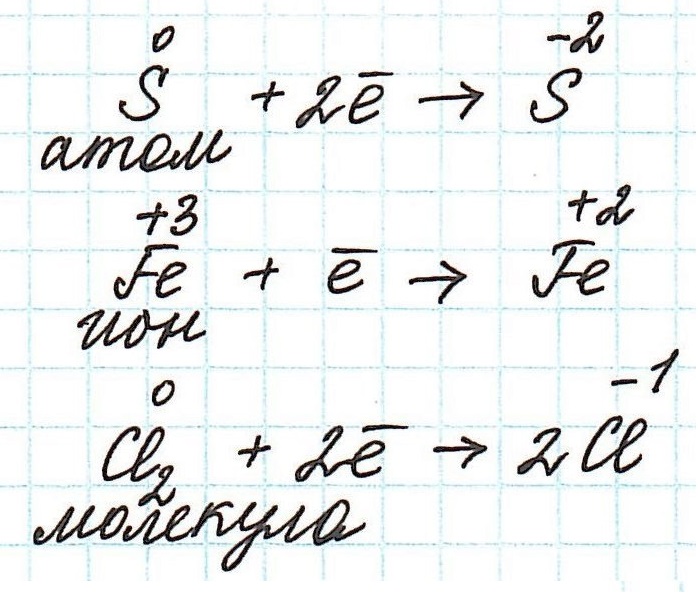более слабые восстановители чем водород
Водород
В трудах химиков XVI-XVIII вв. упоминался «горючий» или «воспламеняемый воздух», который в сочетании с обычным давал взрывчатые смеси. Получали его, действуя на некоторые металлы (железо, цинк, олово) разбавленными растворами кислот – серной и соляной. Первым ученым, описавшим свойства этого газа, был Г.Кавендиш. Он определил его плотность и изучил горение на воздухе, однако приверженность теории флогистона помешала исследователю разобраться в сути происходящих процессов. Кавендиш принял «горючий воздух» (водород) за чистый флогистон – невидимую субстанцию, которую тела теряют при горении или при растворении в кислотах. Тогда металлы считали сложными веществами, содержащими флогистон, его-то они якобы и выделяют под действием кислоты.
Дальнейшее развитие химии показало ошибочность этой теории. Теперь общеизвестно, что водород входит в состав кислот, а металлы являются простыми веществами. Однако способ получения водорода, открытый в те времена, используется в лабораториях до сих пор. Для этого в аппарат Киппа загружают палочки, отлитые из цинка, и заливают 20-процентную серную кислоту:
А.Л.Лавуазье в 1779 г. получил водород при разложении воды, пропуская ее пары через раскаленную докрасна железную трубку с железными опилками. При температуре красного каления железо вступает в реакцию с водяным паром, и выделяется водород: 3Fe + 4H2O = Fe3O4 + 4H2↑

Лавуазье также доказал, что при взаимодействии «горючего воздуха» с кислородом образуется вода, причем газы реагируют в объемном соотношении 2:1. Это позволило ученому определить состав воды – Н2О. Название элемента – Hydrogenium – Лавуазье и его коллеги образовали от греческих слов «гидор» — «вода» и «геннао» — «рождаю». Русское слово «водород», т.е. «рождающий воду», является точным переводом латинского названия.
Водород относится к числу наиболее распространенных химических элементов. В земной коре он встречается почти исключительно в виде соединений: входит в состав нефти, природного газа, каменного угля, некоторых минералов. В свободном состоянии он обнаружен в незначительном количестве в вулканических газах, а также среди продуктов разложения органических веществ микроорганизмами. Но конечно, самое известное соединение водорода – это его оксид, вода. По оценкам ученых, на Земле 1,4∙10 18 т поверхностных вод, и еще около 1,3∙10 13 т – в виде пара в атмосфере. Обширны также запасы подземных вод.
Кроме того, водород самый распространенный элемент во Вселенной. Энергия, излучаемая Солнцем и другими звездами, выделяется в результате ядерных реакций с участием его ядер.
Элемент образует несколько изотопов: наряду с обычным водородом с относительной атомной массой 1 (его называют протием, 1 Н), на Земле встречаются два тяжелых изотопа – дейтерий( 2 Н или D) и тритий ( 3 Н или Т). Содержание дейтерия в природном водороде очень незначительно: лишь один из 100 тыс. атомов водорода является атом дейтерия. Этот изотоп был выделен в 1931 г. при испарении жидкого водорода. Радиоактивного трития еще меньше – примерно один атом на каждые 10 18 атомов 1 Н. Недавно зафиксировано образование сверхтяжелых изотопов водорода – 4 Н и 5 Н.
Водород – бесцветный газ без вкуса и запаха, слаборастворимый в воде. Он в 14,5 раз легче воздуха – самый легкий из газов. Поэтому водородом раньше наполняли аэростаты и дирижабли.
Молекулы Н2 настолько малы, что способны легко проходить не только через мелкие поры, но и сквозь металлы. Некоторые из них, например никель и палладий, могут поглощать большое количество водорода и удерживать его в атомарном виде в пустотах кристаллической решетки. Нагретая до 250 о С палладиевая фольга свободно пропускает водород: этим пользуются для тщательной очистки его от других газов.
Подобно Н2, дейтерий при нормальных условиях – газ, состоящий из молекул D2. Однако по сравнению с обычным водородом он имеет более высокую температуру кипения (-249 о С ).
Химические свойства водорода
В химических реакциях водород может быть как восстановителем (что для него более характерно), так и окислителем.
Водород взаимодействует как восстановитель:
Смесь 2 объемов Н2 и 1 объема О2 при поджигании взрывается (так называемый «гремучий газ»);
б) с серой при нагревании:
в) с хлором при поджигании и облучении смеси газов УФ-светом:
г) с фтором при обычных условиях:
д) с азотом при повышенном давлении и нагревании в присутствии катализаторов(реакция необратима):
Как окислитель водород взаимодействует только с активными (щелочными и щелочноземельными) металлами. В результате образуются гидриды металлов, представляющие собой солеобразные ионные соединения, которые содержат гидрид-ионы Н — :
Гидриды металлов – нестойкие кристаллические вещества белого цвета. Они являются сильными восстановителями, так как степень окисления – 1 малохарактерна для водорода. Так, при действии воды гидриды разлагаются, восстанавливая при этом воду до водорода:
а) При высокой температуре водород может восстанавливать большинство оксидов металлов; например:
в) Водород способен присоединяться ко многим органическим молекулам. Такие реакции называются гидрированием и будут подробно рассмотрены в разделе «Органическая химия».
Получение водорода
Существует достаточно много способов получения водорода. Рассмотрим наиболее широко используемые лабораторные (первые три) и промышленные способы.
Применение водорода
В химической промышленности водород служит сырьем для получения аммиака NH3, хлороводорода НСl, метанола СН3ОН и других органических веществ. В пищевой промышленности водород используют для выработки твердых жиров путем гидрогенизации растительных масел. В металлургии водород используется для восстановления некоторых цветных металлов из их оксидов. Как уже отмечалось выше, водород – очень легкий газ, поэтому им заполняют воздушные шары, зонды и другие летательные аппараты. Высокая экзотермичность реакции горения водорода в кислороде обусловливает использование «водородной» горелки для сварки и резки металлов (температура водородного пламени достигает 2600 о С ). Жидкий водород является одним из наиболее эффективных видов ракетного топлива.
В последние годы все больше внимание уделяется водородной энергетике, т.е. использованию водорода в качестве топлива, в частности для двигателей внутреннего сгорания. Это представляет особый интерес с экологической точки зрения, так как при горении водорода в выделяющихся газах не содержится вредных веществ (продукт горения – вода!).
Пероксид водорода (Н2О2)
Раствор пероксида водорода имеет кислую реакцию среды, что обусловлено диссоциацией его молекул по типу слабой кислоты:
Как кислота пероксид водорода взаимодействует с основаниями:
Некоторые пероксиды металлов, например Na2O2, BaO2, можно рассматривать как соли слабой кислоты пероксида водорода. Из них можно получать Н2О2 действием более сильных кислот:
Графическая формула пероксида водорода: Н – О – О – Н. «Пероксидный мостик» из двух атомов кислорода обусловливает неустойчивость молекулы. При хранении на свету, нагревании, в присутствии катализатора пероксид водорода разлагается на воду и кислород:
Данная реакция относится к типу реакций диспропорционирования. Способность пероксида водорода к самоокислению-самовосстановлению объясняется тем, что атомы кислорода в его молекуле находятся в промежуточной степени окисления – 1. Этим же обусловлено участие Н2О2 в различных реакциях в роли окислителя или в роли восстановителя. В реакциях с типичными восстановителями пероксид водорода проявляет свойства окислителя и восстанавливается до воды или гидроксид-ионов; например:
При взаимодействии с сильными окислителями Н2О2 проявляет восстановительные свойства и окисляется до свободного кислорода; например:
Пероксид водорода применяют как дезинфицирующее средство в медицине для полосканий, промываний и как кровоостанавливающее средство в виде 3%-ного раствора.
Скачать:
Скачать бесплатно реферат на тему: «Водород» Водород.docx (239 Загрузок)
Скачать бесплатно реферат на тему: «Водород и Вселенная» Водород-и-Вселенная.docx (222 Загрузки)
Скачать бесплатно реферат на тему: «Вода» Вода.docx (230 Загрузок)
Скачать бесплатно реферат на тему: «Водородная связь» Водородная-связь.docx (252 Загрузки)
Скачать бесплатно реферат на тему: «Вода и ее свойства» Вода-и-её-свойства.docx (220 Загрузок)
Скачать бесплатно реферат на тему: «Водные ресурсы» ВОДНЫЕ-РЕСУРСЫ.docx (215 Загрузок)
Скачать рефераты по другим темам можно здесь
Похожее
Добавить комментарий Отменить ответ
Репетитор по химии. Занятия проходят онлайн по Скайпу. По всем вопросам пишите в Ватсапп: +7 928 285 70 42
Большая Энциклопедия Нефти и Газа
Слабый восстановитель
Слабый восстановитель ; реагирует с кислотами-окислителями. [1]
Слабые восстановители не изменяют окраски раствора. Это свойство используется для определения больших количеств родия в присутствии хлоридов иридия ( IV) и платины ( IV), которые при восстановлении обесцвечиваются. [2]
Слабый восстановитель ; реагирует с кислотами-окислителями. [3]
Слабые восстановители не изменяют окраски раствора. Это свойство используется для определения больших количеств родия в присутствии хлоридов иридия ( IV) и платины ( IV), которые при восстановлении обесцвечиваются. [5]
Применяя более слабые восстановители и подбирая соответствующую кислотность или щелочность реакционной смеси, можно получить ряд соединений, представляющих различные промежуточные стадии процесса восстановления нитробензола. [8]
Будет ли слабый восстановитель хорошим реактивом на амины или он больше подходит для открытия альдегидов. [10]
Будет ли слабый восстановитель хорошим реактивом на амины или он больше подходит для открытия альдегидов. [11]
При действии слабых восстановителей процесс заканчивается на стадии бразовання нестойкого арилдиимина, который мгновенно разрушается с, выделением азота. [13]
Монозы являются слабыми восстановителями ; так, они выделяют металлическое серебро из аммиачного раствора окиси серебра и при нагревании красную закись меди из фелинговой жидкости. Последняя реакция в отсутствии других восстановителей является не только качественной, но позволяет также при соблюдении определенных условий. [15]
Комплект тестов к урокам химии
Тесты составила: учитель химии МБОУСОШ№4 Сурова Ирина Александровна, ст. Староминская
Комплект тестов к урокам химии
Тесты по теме «Металлы»:
1)Самый распространенный металл в земной коре:
А) Fe Б) Ti В) Al Г)Са
2)В лампах накаливания используют металлическую нить из:
А) Al Б) Fe В)С u Г) W
3) Наиболее легкоплавкий металл:
А) Li Б) Al В) Hg Г)С u
4) Наиболее тугоплавкий металл:
5)К металлам не относится последовательность элементов:
6) При горении натрия на воздухе образуется:
А) Na 2 O Б) Na 2 O 2 В) NaO Г) Na 3 N
7)Щелочной металл, образующий нитрид при н.у.:
8)Растворимый гидроксид образуется при взаимодействии с водой:
9)При высокой температуре из воды вытесняет водород:
А) Cu Б) Fe В) Ag Г) Hg
10)Более слабыми восстановителями чем водород являются:
11)Уменьшение активности металлов в ряду:
12)Водород не восстановит металл из :
А)СаО Б) CuO В) Cr 2 O 3 Г) MnO 2
13)С соляной кислотой не взаимодействует:
А) Mg Б) Zn В) Ca Г) Cu
14) C оединение CaH 2 называют:
А)амид кальция Б)гидрат кальция В)гидрид кальция Г)гидроксид кальция
Тесты по теме «Неметаллы» :
1)О фторе нельзя сказать, что он самый:
2)Для поглощения хлора можно использовать концентрированный раствор:
А) NaCl Б) NaOH В)НС l Г) H 2 SO 4
3) C какими из перечисленных веществ не взаимодействует хлор:
А)водой Б)раствором хлорида натрия В)раствором бромида натрия Г)раствором щелочи
4)Степень окисления хлора в соединении Ca ( OCl )2 :
5)Сила галогеноводородных кислот возрастает в ряду:
6)Хлорноватистая кислота имеет формулу:
А) HClO Б) HClO 2 В) HClO 3 Г) HClO 4
7)Кислород проявляет положительную степень окисления в соединении:
А) Na 2 O Б) H 2 O 2 В) OF 2 Г) NaNO 3
8)Сожгли 8г кислорода и 8г водорода. Масса образовавшейся воды:
9)Какой из указанных газов не горит в атмосфере кислорода:
А)оксид углерода( II ) Б)метан В)водород Г)оксид углерода( IV )
10)Кислород образуется при разложении:
А)СаСО3 Б) H 2 SO 4 В) H 2 CO 3 Г) HgO
11)Отрицательная степень окисления у азота в соединении:
А) N2O Б) NO В) Na3N Г) NO2
12)Оксид азота( IV ) может взаимодействовать с:
А)хлоридом натрия Б)кислородом В)соляной кислотой Г)гидроксидом кальция
13)Взаимодействие медной стружки с концентрированной азотной кислотой приводит к образованию: А) NO 2 Б) NO В) NH 3 Г) N 2 O
Тесты по теме «Техника безопасности»:
1)Токсичными являются газы:
А)Н2,СО2 Б) Cl 2, H 2 S В)О2,Н2 Г) N 2, He
2)Из наборов газов неядовитыми являются:
А )H2S,NH3,HCl Б ) H2,O2,N2 В ) CO,Cl2,NO2 Г )F2,NO2,NO
3)Этикетка с надписью зеленого цвета приклеивается на тару с веществом:
А)ядовитым Б)боящимся воды В)взрывоопасным Г)огнеопасным
4)Поражает обоняние и оказывает токсическое действие:
А)СО Б)Н2 S В) Cl 2 Г) SO 2
5)Пятно иода, попавшего на халат, исчезнет, если использовать раствор:
А )NaCl Б )Na2S4O6 В )Na2S2O3 Г )KI
6)Если вещество обладает взрывоопасными свойствами, то на тару наклеивают этикетку:
А)красного цвета Б)желтого цвета В)голубого цвета Г)зеленого цвета
7)Если вещество необходимо беречь от воды, на тару наклеивают этикетку:
А)белого цвета Б)желтого цвета В)голубого цвета Г)зеленого цвета
8)В школьных лабораториях в газометрах категорически запрещается хранить: А)азот Б)кислород В)ацетилен Г)оксид углерода( IV )
9)Вентили баллонов с сжатым кислородом нельзя смазывать маслом:
А)кислород растворим в масле Б)кислород будет растворяться парами масла В)кислород находится в баллоне под давлением Г)масло реагирует с сжатым кислородом со взрывом
10)При перегонке легковоспламеняющихся жидкостей в лаборатории разрешается пользоваться только:
А)газовой горелкой Б)спиртовкой В)электроплиткой Г)водяной баней
11)При наличии у реактива ядовитых свойств на тару с ним наклеивают этикетку: А)красного цвета Б)желтого цвета В)голубого цвета Г)зеленого цвета
12)В спиртовках можно использовать только:
А)бензин Б)керосин В)зтанол Г)глицерин
Тест «Металлы» Тест «Неметаллы»
Тест «Техника безопасности»
Тест к уроку«Карбоновые кислоты»:
1. Пропановую кислоту можно получить при взаимодействии:
А)Пропанола и гидроксида натрия
Б)Пропаналя и гидроксида меди( II )
В)Пропена и бромоводорода
Г)Пропаналя и гидроксида натрия
2.Формула масляной кислоты:
4.Карбоновые кислоты взаимодействуют с :
А)Медь и гидроксид натрия
Б)Оксид магния и соляная кислота
В)Магний и гидроксид калия
Г)Оксид кальция и сульфат натрия
5.Кислотные свойства усиливаются:
Тест к уроку «Типы кристаллических решеток»
1. Установите соответствие:
Вещество Тип кристаллической решетки
А) сероводород 1) ионная
Б) кремний 2) молекулярная
В) хлорид калия 3)металлическая
2. Вещества только с молекулярной кристаллической решеткой:
А) магний, иод, хлорид лития;
Б) белый фосфор, оксид углерода( IV ); аммиак;
В)вода, цинк, кремний;
Г) кислород, алмаз, гидроксид натрия.
3. Вещества только с ионной кристаллической решеткой:
4.Вещество с атомной кристаллической решеткой:
А)СО2; Б) SiO 2; В) Mg ; Г) NaCl
5.Вещество молекулярного строения-это:
6.Вещество немолекулярного строения:
Если Вы считаете, что материал нарушает авторские права либо по каким-то другим причинам должен быть удален с сайта, Вы можете оставить жалобу на материал.
Курс повышения квалификации
Дистанционное обучение как современный формат преподавания
Курс повышения квалификации
Современные педтехнологии в деятельности учителя
Курс повышения квалификации
Педагогическая деятельность в контексте профессионального стандарта педагога и ФГОС
Ищем педагогов в команду «Инфоурок»
Найдите материал к любому уроку, указав свой предмет (категорию), класс, учебник и тему:
также Вы можете выбрать тип материала:
Краткое описание документа:
Тесты составила: учитель химии МБОУСОШ№4 Сурова Ирина Александровна, ст. Староминская
Комплект тестов к урокам химии
«Тесты по теме «Металлы»:
1)Самый распространенный металл в земной коре:А)Fe Б)Ti В)Al Г)Са
2)В лампах накаливания используют металлическую нить из:А)Al Б)Fe В)Сu Г)W
3) Наиболее легкоплавкий металл:А)Li Б)Al В)Hg Г)Сu
4) Наиболее тугоплавкий металл:А)Fe Б)Cu В)W Г)Са
5)К металлам не относится последовательность элементов:А)Са,Zn, Cd Б)В,As,Se В)К,Na,Mg Г)Cu,W,Au
6) При горении натрия на воздухе образуется:А) Na2O Б)Na2O2 В)NaO Г)Na3N
7)Щелочной металл, образующий нитрид при н.у.:А)К Б)Са В)Li Г)Na
8)Растворимый гидроксид образуется при взаимодействии с водой:А)К Б)Mg В)Ag Г)Сu
9)При высокой температуре из воды вытесняет водород:А)Cu Б)Fe В)Ag Г)Hg
10)Более слабыми восстановителями чем водород являются:А)Са,Al Б)Fe,Co В)Bi,Ag Г)Sn,Pb
11)Уменьшение активности металлов в ряду:А)Fe,Zn,Pb,Cd Б)Fe,Zn,Cd,Pb В)Zn,Fe,Cd,Pb Г)Zn,Fe,Cd,Pb
12)Водород не восстановит металл из :А)СаО Б)CuO В) Cr2O3 Г) MnO2
13)С соляной кислотой не взаимодействует:А)Mg Б)Zn В)Ca Г)Cu
14)Cоединение CaH2 называют:А)амид кальция Б)гидрат кальция В)гидрид кальция Г)гидроксид кальция
«Тесты по теме «Неметаллы» :
1)О фторе нельзя сказать, что он самый:А)легкийБ)активныйВ)электроотрицательныйГ)агрессивный
2)Для поглощения хлора можно использовать концентрированный раствор:А)NaCl Б)NaOH В)НСl Г)H2SO4
3)C какими из перечисленных веществ не взаимодействует хлор:А)водой Б)раствором хлорида натрия В)раствором бромида натрия Г)раствором щелочи
4)Степень окисления хлора в соединении Ca(OCl)2 :А)-1 Б)+1 В)+3 Г)+5
5)Сила галогеноводородных кислот возрастает в ряду:А) HCl,HBr,HI Б)НI,HBr,HF В)HBr,HI,HCl Г)HI,HCl,HBr
6)Хлорноватистая кислота имеет формулу:А)HClO Б)HClO2 В)HClO3 Г)HClO4
7)Кислород проявляет положительную степень окисления в соединении:А)Na2O Б)H2O2 В)OF2 Г)NaNO3
8)Сожгли 8г кислорода и 8г водорода. Масса образовавшейся воды:А)8г Б)9г В)16г Г)18г
9)Какой из указанных газов не горит в атмосфере кислорода:А)оксид углерода(II) Б)метан В)водород Г)оксид углерода(IV)
10)Кислород образуется при разложении:А)СаСО3 Б)H2SO4 В)H2CO3 Г)HgO
11)Отрицательная степень окисления у азота в соединении:А)N2O Б)NO В) Na3N Г) NO2
12)Оксид азота(IV) может взаимодействовать с:А)хлоридом натрия Б)кислородом В)соляной кислотой Г)гидроксидом кальция
13)Взаимодействие медной стружки с концентрированной азотной кислотой приводит к образованию: А)NO2 Б)NO В)NH3 Г) N2O
«Тесты по теме «Техника безопасности»:
1)Токсичными являются газы:А)Н2,СО2 Б)Cl2,H2S В)О2,Н2 Г)N2,He
2)Из наборов газов неядовитыми являются:А)H2S,NH3,HCl Б) H2,O2,N2 В) CO,Cl2,NO2 Г)F2,NO2,NO
3)Этикетка с надписью зеленого цвета приклеивается на тару с веществом:А)ядовитым Б)боящимся воды В)взрывоопасным Г)огнеопасным
4)Поражает обоняние и оказывает токсическое действие:А)СО Б)Н2S В)Cl2 Г)SO2
5)Пятно иода, попавшего на халат, исчезнет, если использовать раствор:А)NaCl Б)Na2S4O6 В)Na2S2O3 Г)KI
6)Если вещество обладает взрывоопасными свойствами, то на тару наклеивают этикетку:А)красного цвета Б)желтого цвета В)голубого цвета Г)зеленого цвета
7)Если вещество необходимо беречь от воды, на тару наклеивают этикетку:А)белого цвета Б)желтого цвета В)голубого цвета Г)зеленого цвета
8)В школьных лабораториях в газометрах категорически запрещается хранить: А)азот Б)кислород В)ацетилен Г)оксид углерода(IV)
9)Вентили баллонов с сжатым кислородом нельзя смазывать маслом:А)кислород растворим в масле Б)кислород будет растворяться парами масла В)кислород находится в баллоне под давлением Г)масло реагирует с сжатым кислородом со взрывом
10)При перегонке легковоспламеняющихся жидкостей в лаборатории разрешается пользоваться только:А)газовой горелкой Б)спиртовкой В)электроплиткой Г)водяной баней
11)При наличии у реактива ядовитых свойств на тару с ним наклеивают этикетку: А)красного цвета Б)желтого цвета В)голубого цвета Г)зеленого цвета
12)В спиртовках можно использовать только:А)бензин Б)керосин В)зтанол Г)глицерин
ОКИСЛИТЕЛИ И ВОССТАНОВИТЕЛИ В ХИМИЧЕСКИХ РЕАКЦИЯХ
Окислители и восстановители в химии — интересный, но очень часто вызывающий затруднения, вопрос.
К примеру, превращение с помощью нитрифицирующих бактерий атмосферного азота в легко усваиваемую растениями форму, фотосинтез, дыхание живых организмов (от бактерий до высших растений и животных) — это ОВР в природе.
А вот выплавка стали, промышленное получение аммиака из азота и водорода, гальванические процессы, электролиз – эти и огромное количество других процессов являются примерами ОВР в технике.
Так что же такое окислительно-восстановительные реакции (процессы)?
Понятие окислительно-восстановительной реакции
Окислительно-восстановительные реакции (ОВР) – это процессы, в ходе которых изменяются степени окисления атомов химических элементов.
Окисление и восстановление сопровождают друг друга. Один процесс без другого просто не существует. Почему?
Изменение степени окисления всегда означает переход электронов от одних частиц к другим. То есть одни частицы отдают электроны в ходе химического или электрохимического взаимодействия, а другие частицы принимают. Здесь срабатывает закон сохранения материи.
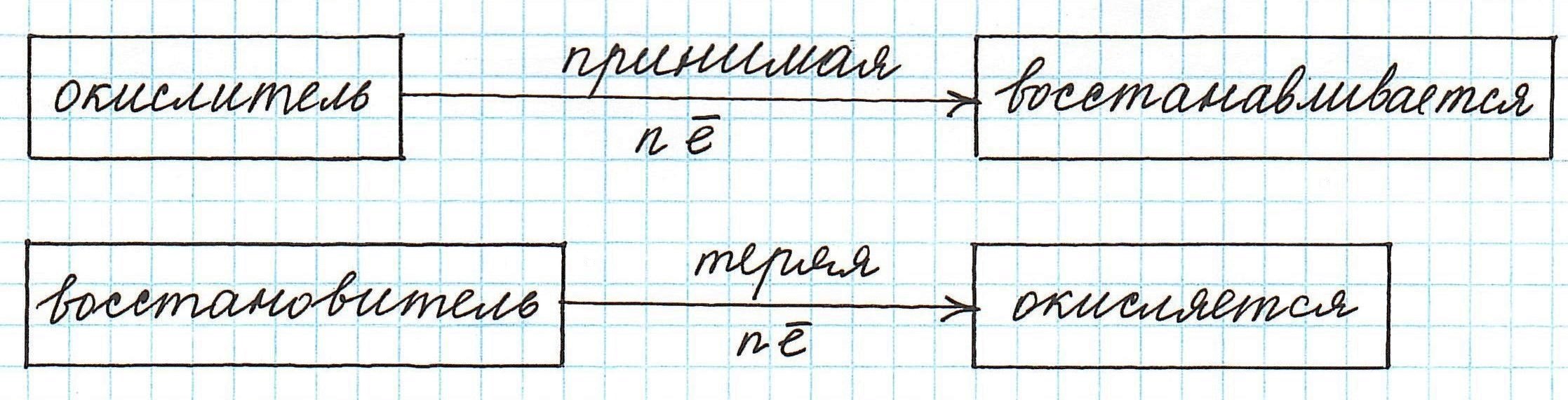
Окислители, восстановители. Окисление, восстановление
Итак, окисление – это процесс, в ходе которого частица передает свои электроны другой частице. В качестве таких частиц могут выступать отдельные атомы или ионы, а также молекулы.
Переход электронов принято показывать с помощью полуреакций:
Как не сложно заметить из представленных полуреакций, окислительный процесс приводит к увеличению степени окисления.
Частица, принимающая электроны, является окислителем.
Восстановление всегда сопровождается уменьшением степени окисления!
Способность к окислению и восстановлению: как определить
Существует несколько закономерностей, которые помогают определить наличие у частицы (атома, иона, молекулы) способности окисляться или восстанавливаться. Обратимся к периодической таблице химических элементов.
1) В периодах слева направо (т.е. с повышением порядкового номера элемента) восстановительные свойства простых веществ уменьшаются, а окислительные увеличиваются:
То есть в начале периода находятся явные восстановители, а в конце – окислители. Например, в III периоде активным восстановителем является натрий, а активным окислителем – хлор.
А причина данной закономерности кроется в строении атомов элементов.
У атомов элементов одного периода:
В связи с этим растет и сила притяжения электронов к ядру. В результате радиус атома уменьшается.
У элементов конца периода эта сила велика. Поэтому атомы очень трудно отдают свои электроны в химических взаимодействиях и легче принимают их от других атомов, стремясь завершить внешний энергетический уровень. Так проявляются их окислительные свойства.
Атомам элементов начала периода для завершения внешнего уровня до устойчивого 8-электронного состояния легче отдать свои немногочисленные электроны, проявив тем самым восстановительные свойства.
2) Элементы побочных подгрупп (это металлы четных рядов больших периодов) на внешнем уровне имеют 2 или 3 (реже 1 в случае «провала») электрона, поэтому легко могут их отдавать, являясь, таким образом, восстановителями:
3) Элементы одной главной подгруппы имеют одинаковое число электронов на внешнем энергетическом уровне (например, элементы VI группы – шесть электронов). Число же энергетических уровней увеличивается и, соответственно, радиусы атомов тоже увеличиваются. Это приводит к тому, что электроны внешних уровней удаляются от ядра и притяжение их к нему ослабевает.
Вот именно поэтому, восстановительная способность (способность отдавать электроны) у элементов главных подгрупп сверху вниз растет, а окислительная способность (способность принимать электроны) снижается:
Так, среди элементов главной подгруппы VI группы окислительная способность сильнее всего проявляется у кислорода, а теллур в некоторых взаимодействиях способен проявлять восстановительные свойства.
4) Определить, чем будет являться частица (или вещество, в состав которого она входит) в окислительно-восстановительном процессе, можно по значению степени окисления (с.о.).
Если атомы имеют самую наименьшую с.о., то проявят они восстановительные свойства. Если самую высокую – то окислительные. А если с.о. является промежуточной по значению, то проявят как те, так и другие свойства (в зависимости от конкретных условий химической реакции). Например:
Сильные или слабые окислители и восстановители: как определить
Часто говорят: сильный окислитель, слабый окислитель, сильный восстановитель, слабый восстановитель. А что это значит? И как определить эту самую силу?
Мерой окислительно-восстановительной способности вещества служит значение стандартного электродного потенциала: чем оно больше, тем и окислительные свойства проявляются сильнее.
Обратимся к таблице стандартных электродных потенциалов. В ней значения потенциалов расположены в порядке уменьшения:
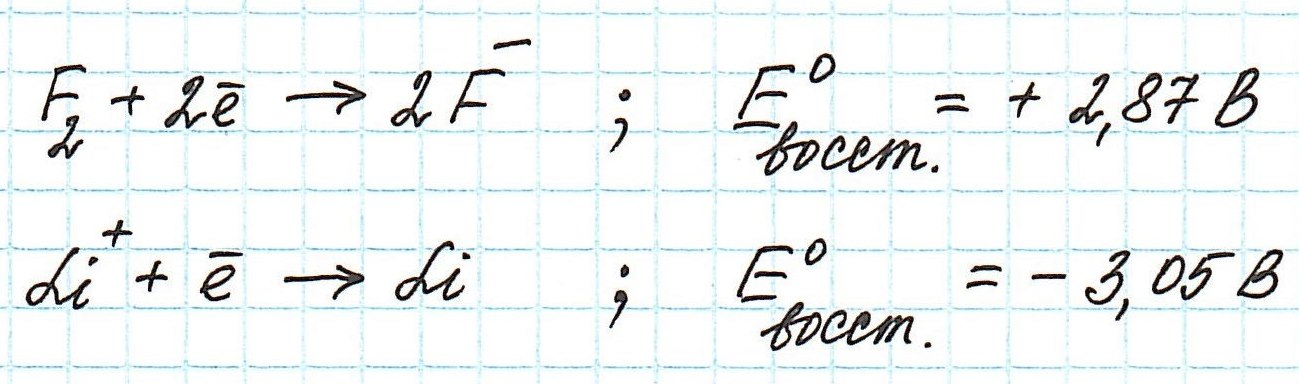
Окислительные потенциалы фтора и лития будут иметь противоположные значения.
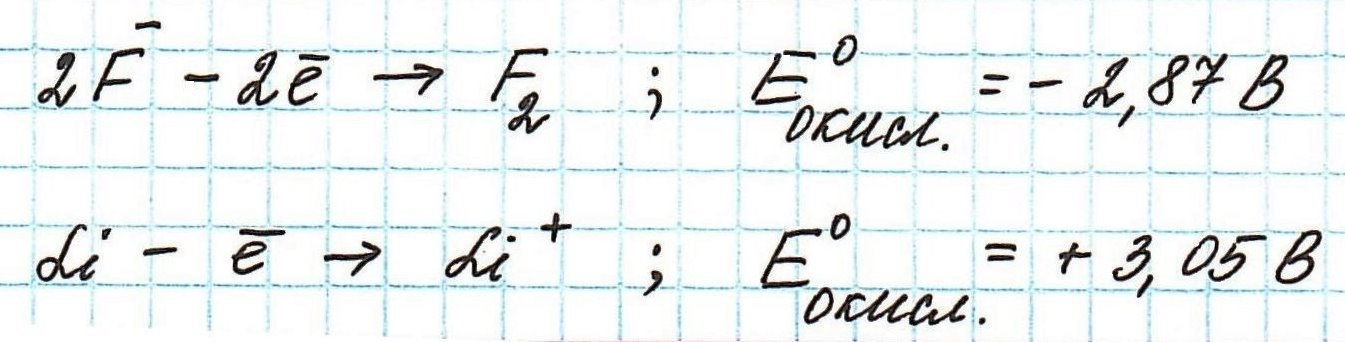
Пример . Используя таблицу стандартных электродных потенциалов, определите, какая из частиц проявляет более сильные окислительные свойства:
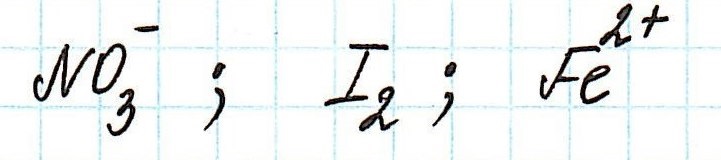
Наиболее сильным окислителем будет та частица, которая лучше всего восстанавливается, а, значит, имеет более высокий восстановительный электродный потенциал.
Сравним значения восстановительных потенциалов:
Таким образом, наиболее сильным окислителем из представленных является нитрат-ион.
Основные окислители и восстановители в химии
В технике применяется огромное количество окислителей и восстановителей с разной окислительной и восстановительной способностью.
Важнейшие из них представлены в таблице:
Итак, окисление и восстановление – два взаимосвязанных процесса. Они широко представлены в природе и играют огромную роль в промышленных производствах. Окислители и восстановители очень разнообразны. Чем будет являться частица (или вещество, в состав которого она входит): окислителем или восстановителем, – можно определить, используя некоторые закономерности.