болезнь дюшенна это что такое
Вылечить миодистрофию Дюшенна: конкуренция групп, единство методик
Вылечить миодистрофию Дюшенна: конкуренция групп, единство методик
Принцип генной терапии миодистрофии Дюшенна/Беккера. Миодистрофию Дюшенна (МДД) вызывают мутации гена дистрофина (DMD), приводящие к сдвигу рамки считывания, а более мягкую миодистрофию Беккера (МДБ) — мутации без смещения рамки считывания. Лечения этой болезни пока нет. Генная терапия поможет улучшить или даже восстановить функции мышц.
Автор
Редакторы
Мышечная дистрофия Дюшенна — тяжелейшее Х-связанное заболевание, эффективного лечения которого до сих пор нет. В одном из последних номеров Science вышли целых три статьи об успешном тестировании на мышиных моделях технологии CRISPR/Cas9 для лечения этой болезни. Может быть, у этого подхода есть шанс добраться и до клиник?
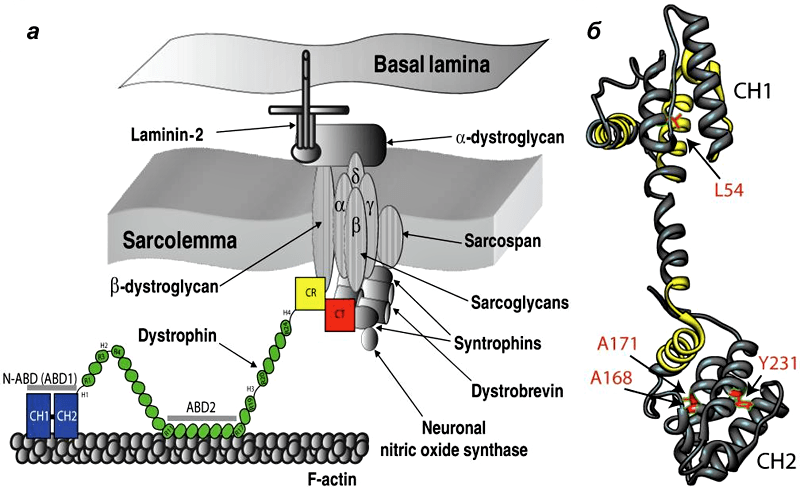
Дистрофин находится на внутриклеточной поверхности сарколеммы вдоль всей длины мышечных волокон и входит в состав дистрофин-ассоциированного гликопротеинового комплекса (ДАГК, DGC). Он связывается одним концом с F-актином цитоскелета, а другим — с β-дистрогликаном, что стабилизирует волокна во время сокращения. Ген дистрофина — один из самых длинных у человека.
Излечивать мышечную дистрофию Дюшенна пока не умеют, а сегодняшняя терапия направлена на замедление прогрессирования болезни и лечение осложнений [4], [5]. «Золотой стандарт» — это кортикостероиды, которые были предложены в качестве лечения еще несколько десятилетий назад. Однако их применение вызывает множество побочных эффектов.
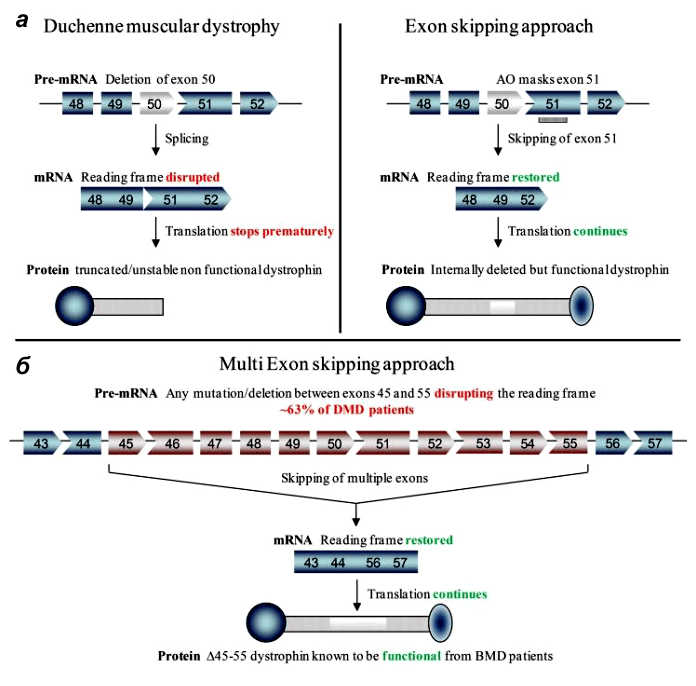
Неудивительно, что многие группы генетиков и молекулярщиков занимаются разработкой пре- и постнатального лечения миодистрофии Дюшенна. Болезнь в основном изучают на различных линиях мышей. В одном из последних номеров Science опубликовали сразу три независимых работы по методам лечения мышечной дистрофии Дюшенна [6–8]. Исследовательские группы возглавили Эрик Олсон (Eric Olson) из Техасского университета, Эми Уаджерс (Amy Wagers) из Гарвардского университета и Чарльз Герсбах (Charles Gersbach) из Университета Дьюка. Все группы для восстановления функции мышц использовали методику пропуска экзонов, при которой один или несколько экзонов удаляются из мРНК (рис. 2). В таком случае белок получается короче, но всё же может выполнять свою поддерживающую и заякоривающую функции в мышечном волокне, а «досадное обстоятельство» — лишний стоп-кодон — тоже оказывается «пропущенным».
Рисунок 2. Пропуск экзонов в гене дистрофина при миодистрофии Дюшенна. а — У пациентов с МДД в гене DMD присутствуют мутации, нарушающие рамку считывания при синтезе белка. Например, при делеции экзона 50 появляется «внерамочная» мРНК, что приводит к синтезу усеченного нефункционального или нестабильного дистрофина (слева). В одном из терапевтических подходов антисмысловой олигонуклеотид «маскирует» экзон 51, и он «пропускается» при сплайсинге, рамка считывания восстанавливается. В результате получается более короткий, но частично функциональный дистрофин (справа). В новых работах «лишние» экзоны просто вырезают из генома с помощью CRISPR/Cas9. б — Мультиэкзонный пропуск в терапии МДД. Если осуществить пропуск экзонов 45–55, мутации которых встречаются примерно у 63% пациентов, то образовавшийся короткий дистрофин приведёт к трансформации стандартного МДД-фенотипа в бессимптомный или более мягкий МДБ-фенотип.
У стратегии удаления экзонов есть даже преимущества перед воссозданием полной длины гена: ее проще разработать, чем восстановить индивидуальные делеции каждого пациента [7].
Для вырезания «лишних» нуклеотидных последовательностей исследователи воспользовались технологией редактирования генома CRISPR (clustered regularly interspaced short palindromic repeats) / Cas9 (CRISPR-associated protein 9) [9], которую, между прочим, только что разрешили применить в опытах на эмбрионах одному лондонскому институту [10].
Конкурирующие лаборатории: кто первым воплотит технологию в терапию для человека?
Ученые трех лабораторий успешно применили технологию пропуска экзонов in vivo на стандартном объекте — мышах — и показали, что их метод помогает восстановить рамку считывания и частично восстановить синтез дистрофина. Поскольку даже невысокий его уровень (3–15% от нормального) приносит терапевтическую пользу, результаты работ можно назвать успешными.
Группа Эрика Олсона уже не в первый раз использует метод CRISPR/Cas9 в своих работах по мышечной дистрофии Дюшенна. В 2014 году ученые исправили мутацию в зародышевой линии мышей и предотвратили развитие болезни. Однако, поскольку пренатальное редактирование генома на человеческих эмбрионах (пока?) запрещено, исследователям пришлось придумать способ постнатального применения технологии.
В их последней работе для доставки необходимых для редактирования компонентов в ткани использовался аденоассоциированный вирус-9 (AAV9, adeno-associated virus-9) [6]. Исследователи испытали несколько способов введения AAV9 в различные дни после рождения мышат. Во всех случаях экспрессия гена дистрофина в сердечной и скелетных мышцах восстановилась, но в разной степени. Более того, продукция белка увеличивалась с 3 до 12 недель после инъекций, а через 4 недели после инъекций улучшилась функция скелетных мышц. «Сейчас задача для исследователей из центра Уэллстоун заключается в том, чтобы перенести открытия с мышиной модели на пациентов с миодистрофией», — говорит Прадип Маммен (Pradeep Mammen), содиректор центра Уэллстоун.
Группа Эми Уаджерс провела во многом похожий эксперимент [8]. После множества подготовительных этапов работы по редактированию генома и пропуску экзона на клетках и животных их опыт тоже увенчался успехом: программируемые CRISPR-комплексы в составе аденоассоциированного вируса (AAV) были доставлены с помощью локального и системного введения к дифференцированным скелетным волокнам, кардиомиоцитам и сателлитным мышечным клеткам новорожденных и взрослых мышей. Если редактирование направлено только на мышечные волокна, то эффект со временем может сойти на нет. Однако, как отмечает Уаджерс, редактирование генов в сателлитных клетках может обеспечить гораздо более длительный результат. Оно способно привести к созданию пула регенеративных клеток, несущих отредактированный ген дистрофина, и в результате обычной репарации мышц отредактированный ген окажется и в мышечных волокнах.
Наконец, как все уже догадались, ученые под руководством Чарльза Герсбаха тоже обнаружили терапевтический эффект применения AAV-CRISPR/Cas9 в мышиной модели [7]. Внутрибрюшинное введение вирусного вектора новорожденным мышам привело к восстановлению синтеза дистрофина в абдоминальных мышцах (мышцах живота), диафрагме и сердце через семь недель после инъекции. Как отмечают авторы, терапия сердечной и легочной мышц крайне важна, поскольку именно их отказ зачастую приводит к смерти пациентов с болезнью Дюшенна. Внутривенное введение AAV-векторов шестинедельным мышам тоже привело к значительному восстановлению продукции дистрофина в сердечной мышце. «Остается еще много работы по переделке [технологии] в терапию для человека и подтверждения ее безопасности, — говорит Герсбах. — Но результаты наших первых экспериментов уже весьма воодушевляющие». Группа собирается оптимизировать систему доставки и оценивать эффективность и безопасность стратегии на более крупных животных (рис. 3). Какая же из трех лабораторий обгонит других и первой сможет провести испытания на человеке?
Терапия миодистрофии Дюшенна: старые и новые подходы
По словам Олсона, главное отличие новой стратегии с использованием вектора, вмещающего в себя компоненты для редактирования генома, от других терапевтических методов в том, что она устраняет причину болезни. А какие еще подходы разрабатывают ученые?
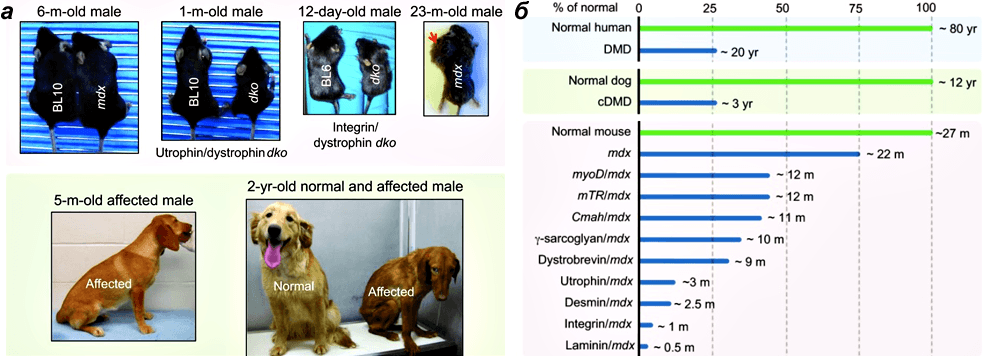
Рисунок 3. Животные модели миодистрофии Дюшенна. а — Проявления миодистрофии Дюшенна у мышей и собак. Вверху: у мышей mdx симптомы проявляются только в старости, и они склонны к образованию рабдомиосарком — опухолей мышечного происхождения. Размер мышей с нокаутами генов атрофина/дистрофина и интегрина/дистрофина значительно меньше, чем их ровесников дикого типа (BL10 и BL6). Внизу: проявления болезни у пятимесячной больной собаки. Различия между здоровой и больной двухлетними собаками. б — Сравнение продолжительности жизни здоровых и больных людей, собак и различных линий мышей.
Один из многообещающих подходов — это клеточная терапия. Хотя опыты с внутримышечной инъекцией миобластов от здоровых доноров провалились, технологии с использованием стволовых клеток и индуцированных плюрипотентных стволовых клеток (ИПСК) пока успешно испытываются на моделях не только миодистрофии Дюшенна, но и болезни Альцгеймера, Паркинсона, Хантингтона, спинальной мышечной атрофии, бокового амиотрофического склероза, аутизма и шизофрении [14–16]. Например, в 2013 году исследователи из Бостонской детской больницы (Boston Children’s Hospital’s Stem Cell Program) с помощью смеси трех малых молекул (форсколина, основного фактора роста фибробластов bFGF и ингибитора гликогенсинтазы киназы-3) перепрограммировали ИПСК из кожи пациентов с миодистрофией Дюшенна в мышечные клетки, которые затем успешно прижились у мышей. Сейчас из ИПСК получены кардиомиобласты и нейроны [2].
Другие исследования показывают, что восстановление нормального уровня синтеза оксида азота (NO), который снижается у больных из-за нарушения активности NO-синтазы (nNOS), ослабляет воспаление, повышает активность собственных стволовых клеток и реконструирует морфологию и функции скелетных мышц [3].
Уже в фазе II клинических испытаний находится препарат Givinostat — ингибитор гистондеацетилаз, который замедляет прогрессирование болезни в мышиной модели.
Болезнь дюшенна это что такое
Этиология и встречаемость мышечной дистрофии Дюшенна. Мышечная дистрофия Дюшенна (MIM №310200) — панэтническая Х-сцепленная прогрессирующая миопатия, вызванная мутациями в гене DMD. Встречаемость составляет приблизительно 1 на 3500 новорожденных мальчиков.
Патогенез мышечной дистрофии Дюшенна. Ген DMD кодирует дистрофии, внутриклеточный белок, экспрессирующийся преимущественно в гладких, скелетных и сердечной мышце, а также в некоторых нейронах мозга. В скелетной мускулатуре дистрофии составляет часть большого комплекса связанных с сарколеммой белков, обеспечивающих устойчивость сарколеммы.
Мутации в гене DMD, вызывающие миодистрофию Дюшенна, включают крупные делеции (60-65%), крупные дупликации (5-10%) и небольшие делеции, инсерции или замены нуклеотидов (25-30%). Самые крупные делеции происходят в одной из двух горячих точек. Нуклеотидные замены встречаются по всему гену, преимущественно в динуклеотидах CpG.
De novo мутации возникают со сравнимой частотой в ходе овогенеза и сперматогенеза; наиболее крупные делеции de novo возникают в овогенезе, тогда как большинство de novo нуклеотидных замен возникает в ходе сперматогенеза.
Мутации, вызывающие фенотипическое отсутствие дистрофина, приводят к более тяжелому поражению мышц, чем мутантные аллели DMD, экспрессирующие частично функциональный дистрофии. Корреляции между генотипом и фенотипом для интеллектуального снижения не обнаружено.
Фенотип и развитие мышечной дистрофии Дюшенна
Мужчины с мышечной дистрофией Дюшенна. Миодистрофия Дюшенна — прогрессирующая миопатия, приводящая к дегенерации и слабости мышц. Начинаясь с мышц тазобедренного пояса и сгибателей шеи, мышечная слабость прогрессивно захватывает плечевой пояс и дистальные мышцы конечностей и туловища. Хотя изредка и выявляют случайно больных в период новорожденности за счет гипотонии или задержки развития, обычно больных мальчиков диагностируют в возрасте от 3 до 5 лет при появлении аномалий походки.
К 5 годам большинство пораженных детей используют приемы Говерса и имеют псевдогипертрофию мышц голеней, т.е. увеличение голеней вследствие замены мышц жировой и соединительной тканью. К возрасту 12 лет основная часть больных обездвижены в инвалидном кресле и имеют контрактуры и сколиоз. Большинство пациентов умирают от нарушения легочной функции и пневмонии; средний возраст смерти — 18 лет.
Почти 95% больных миодистрофией Дюшенна имеют те или иные кардиологические отклонения (дилатационная кардиомиопатия или электрокардиографические аномалии), а 84% имеют видимые поражения мышцы сердца при вскрытии. Хронические нарушения сердца бывают почти у 50% пациентов, изредка сердечная недостаточность вызывает у них жалобы. Хотя дистрофии также присутствует в гладких мышцах, гладкомышечные осложнения встречаются редко и включают расширение желудка, заворот кишок и гипотонию мочевого пузыря.
Больные миодистрофией Дюшенна имеют IQ примерно на 1 среднеквадратичное отклонение ниже обычного, и почти треть имеет ту или иную степень умственной отсталости. Причины этого не установлены.
Женщины с мышечной дистрофией Дюшенна
Возраст начала и тяжесть миодистрофии Дюшенна у женщин зависят от степени смещения инактивации Х-хромосомы. Если Х-хромосома, несущая мутантный аллель DMD, активна в большинстве клеток, у женщины развиваются признаки миодистрофии Дюшенна; если преимущественно активна Х-хромосома, несущая нормальный аллель DMD, женщины имеют только несколько или не имеют вообще симптомов данного заболевания.
Независимо от того, есть ли у них клинические симптомы скелетной мышечной слабости, женщины-носительницы имеют отклонения в функции сердечной мышцы, например дилатационную кардиомиопатию, дилатацию левого желудочка и электрокардиографические изменения.
Особенности фенотипических проявлений дистрофии Дюшенна:
• Возраст начала: детство
• Слабость мышц
• Гипертрофия голеней
• Небольшая интеллектуальная недостаточность
• Высокий уровень креатинкиназы сыворотки
Лечение мышечной дистрофии Дюшенна
Диагноз мышечной дистрофии Дюшенна основывается на семейном анамнезе и ДНК-анализе или мышечной биопсии с иммуногистохимическим определением дистрофина.
В настоящее время излечение мышечной дистрофии Дюшенна невозможно, хотя улучшившееся симптоматическое лечение повысило средний срок жизни от конца детства до ранней зрелости. Цели терапии — замедлить развитие болезни, обеспечить мобильность, предотвратить или исправить контрактуры и сколиоз, контролировать массу тела и улучшить функции легких и сердца.
Глюкокортикоидная терапия может замедлять развитие заболевания в течение нескольких лет. Исследуют несколько видов экспериментального лечения, включая генную передачу. Большинство больных нуждается также в расширенном консультировании, так как имеют дело с психологическими эффектами хронической фатальной болезни.
Риск наследования мышечной дистрофии Дюшенна
Третья часть матерей, родивших единственного больного сына, сами являются носительницами мутаций в гене DMD. Тем не менее определение носительства остается трудной задачей, поскольку в настоящее время доступные молекулярные методы не обнаруживают небольшие мутации типа однонуклеотидных замен. Определение риска носительства в семьях без найденной делеции или дупликации основывается на анализе сцепления, серии анализов уровня креатинкиказы сыворотки крови и мозаичной экспрессии дистрофина в образцах биопсии мышц (из-за случайной инактивации Х-хромосомы). При консультировании в связи с оценкой риска повторения нужно принимать во внимание высокую частоту мозаицизма в половых клетках (приблизительно 14%).
Если мать — носитель, каждый сын имеет 50% риск развития мышечной дистрофии Дюшенна, а каждая дочь — 50% риск унаследовать мутацию DMD. Отражая случайную природу инактивации Х-хромосомы, дочери, унаследовавшие мутацию в гене DMD, имеют низкий риск мышечной дистрофии Дюшенна; тем не менее по причинам, полностью непонятным, риск сердечных аномалий может достигать 50-60%. Если мать не носительница по результатам ДНК-тестирования, у нее остается приблизительно 7% риска родить мальчика с мышечной дистрофией Дюшенна вследствие полового мозаицизма. Для этих матерей показаны генетическое консультирование и, возможно, пренатальная диагностика.
Пример мышечной дистрофии Дюшенна. А.И., 7-летний мальчик, проходит обследование в связи с легкой задержкой развития. У него затруднения при подъеме по ступенькам, беге, снижение силы и выносливости при интенсивной физической нагрузке. Его родители, два брата и сестра полностью здоровы; другие члены семьи аналогичных жалоб не имеют. При осмотре выявлены затруднения при подпрыгивании, приемы Говерса (последовательность движений, облегчающих вставание с пола), слабость проксимальных мышц, переваливающаяся («утиная») походка, уплотнение ахилловых сухожилий и заметно гипертрофированные мышцы голеней. Уровень креатинкиназы сыворотки крови оказался в 50 раз выше нормы.
Поскольку анамнез и данные медицинского осмотра, включая повышенный уровень креатинкиназы, позволили предположить миопатию, ребенок для дальнейшего обследования направлен в клинику нейрогенетики. Результаты биопсии мышц показали выраженное изменение размера мышечных волокон, некроз волокон, разрастание жировой и соединительной ткани и отсутствие окрашивания на дистрофии. На основании этих результатов ребенку установлен предварительный диагноз мышечной дистрофии Дюшенна, и он тестирован на делеции в гене дистрофина; оказалось, что у него имеется делеция с 45 по 48 экзон.
Дальнейшее обследование показало, что его мать была носителем этой делеции. Соответственно семье дано заключение, что риск для сыновей составляет 50%, риск для дочерей низкий, но зависит от смещения Х-инактивации, а риск носительства для дочерей равен 50%. Поскольку статус носительницы у матери дает повышенный риск сердечных осложнений, она направлена на кардиологическое обследование.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Лечится ли миодистрофия Дюшенна?
Время чтения: 5 мин.
Лечится ли миодистрофия Дюшенна?
Миодистрофия Дюшенна встречается так же часто, как СМА (спинальная мышечная атрофия), но болеют практически только мальчики. Согласно статистике, один из 3500-5000 мальчиков в мире рождается с мышечной дистрофией Дюшенна.
Терапия СМА и Дюшенна: в чем разница?
При всей катастрофичности СМА молекулярная и клеточная основа этого заболевания проще и понятнее, чем у миодистрофии Дюшенна.
Лекарство можно ввести в спинной мозг, оно не размывается по всему организму, не метаболизируется печенью и не выводится почками. Создается его локальная высокая концентрация. Одной инъекции хватает на несколько месяцев. А если это генотерапия, то полноценный замещающий генетический материал, однажды попав в больную нервную клетку, вылечивает ее, остается там надолго, если не на всю жизнь.
В случае миодистрофии Дюшенна все сложнее: ген дистрофина — один из самых больших. Он больше гена СМА почти в полторы тысячи раз, и в нем тысячи разных мутаций (делеции, дупликации, нонсенс и т.д.) в разных местах.
Ген не помещается целиком в вирус, поэтому используют только кусочки гена — мини- и микродистрофин, которые могут ограниченно восстановить функциональность мышечных клеток, перевести «Дюшенн в Беккер» — более легкую форму миодистрофии, при которой человек может прожить до 60 лет, сохранять дееспособность, работать.
Мышечные клетки составляют 40% от всех клеток тела, они активно работают и постоянно заменяются. Доставить лекарство в мышечные клетки – трудная задача: оно должно с кровью попасть во все клетки, а раз с кровью, то с лекарством борется печень, и оно выводится через почки. Итог – низкая концентрация и ограниченное время действия.
Генотерапия мини- и микродистрофином – подводные камни на каждом этапе. У ребенка может быть имеющийся иммунитет к вирусу-переносчику гена, таких детей примерно 30%. Компании сейчас работают над тем, как убрать антитела к вирусу из крови. И пока пациентам доступна только одна попытка генотерапии в жизни, потому что после инфузии уже точно будет выраженный противовирусный иммунитет.
Но результат стоит того, тем более с осложнениями врачи научились бороться. И, конечно, будут другие технологии, лучше и безопаснее, которые смогут преодолеть существующие проблемы.
Больные МДД как снежинки: все разные
Сделать лекарство для МДД сложно, один препарат не вылечит всех, как при СМА.
Больные МДД как снежинки: все разные, нет одинаковых, уже описано около десяти тысяч мутаций гена. Имеет значение и вся генетика ребенка. Поэтому болезнь проявляется по-разному, даже в одной семье у двух братьев с одной мутацией.
| Препарат | Одобрено международными регуляторами | Ожидаемая дата регистрации в РФ | Возраст начала терапии |
|---|---|---|---|
| Аталурен | EMA 2012 | 24.11.2020 | 2 года |
| Экзондис 51 | FDA 2016 | 2021-22 | С момента постановки диагноза |
| Вайондис, Вилтепсо 53 | FDA 2020, Япония | 2021-22 | 4(NS) 0 (S) |
| Амондис | FDA 2021 | 2022 | С момента постановки диагноза |
| Мини/микродистрофин AAV вектор (4) | 2021-22 | 2 года | |
| Гивиностат | 2021-22 | ||
| Ваморолон | 2021-22 | 2 года | |
| Тамоксифен | Off-label | 2022 | |
| ГКСФ (гранулоцитарный колониестимулирующий фактор) | Off-label | 2022 |
Мы живем во время орфанной революции, когда многие редкие генетические неизлечимые заболевания получают патогенетической лечение, и больные обретают возможность жить долгой полноценной жизнью. Новые лекарства могут превратить фатальную болезнь в хроническую, хоть и тяжелую, как, например, диабет.
Как получить лекарства?
Если у вашего ребенка выявили миодистрофию Дюшенна, и вы хотите получить терапию для него, нужно прежде всего иметь подтвержденный генетический диагноз с определением мутации, которая вызвала заболевание. Примерно в 1% случаев не удается выяснить тип мутации. В таком случае делают биопсию мышцы и определяют количество синтезируемого мышцами дистрофина.
Как участвовать в клинических исследованиях?
Сейчас активно проводятся клинические исследования нескольких лекарственных препаратов. О том, какие из них исследуются в России, можно узнать на сайте Минздрава РФ. Заполнив форму, введя название препарата (Аталурен), можно узнать, в каком учреждении проводится исследование. Родителям необходимо самостоятельно связаться с учреждением, чтобы попробовать попасть в число участников.
Информацию о новых препаратах и клинических исследований в области миодистрофии Дюшенна можно найти и в пациентских сообществах, например, ProДюшенн.
Материал подготовлен с использованиюем гранта Президента Российской Федерации, предоставленного Фондом президентских грантов.
Использовано стоковое изображение от Depositphotos.
Прогрессирующая мышечная дистрофия Дюшенна
Прогрессирующая мышечная дистрофия Дюшенна — наследуемая сцеплено с Х-хромосомой патология мышечной системы, проявляющаяся в первые 3-5 лет жизни и характеризующаяся быстро распространяющейся и усугубляющейся мышечной слабостью. Первоначально поражаются мышцы тазового пояса и бедер, затем — плеч и спины, постепенно наступает обездвиженность. Миодистрофия сопровождается скелетными деформациями и поражением сердца. Диагностика дистрофии Дюшенна включает неврологическое и кардиологическое обследование, определение уровня КФК, электромиографию, консультацию генетика, ДНК-анализ, биопсию мышц. Лечение симптоматическое. В связи со слабостью дыхательной мускулатуры на заключительном этапе заболевания требуется ИВЛ.
Общие сведения
Причины
Развитие мышечной дистрофии Дюшенна связано с наличием мутации в 21-ом локусе короткого плеча Х-хромосомы в гене, кодирующем белок дистрофин. Около 70% случаев болезни вызваны дефектным геном дистрофина, полученным от матери — носительницы патологической мутации. Остальные 30% связаны с появлением свежих мутаций в яйцеклетках матери. В отличие от миодистрофии Беккера, при дистрофии Дюшенна генетические аберрации приводят к сдвигу рамки считывания ДНК и полному прекращению синтеза дистрофина, что и обуславливает более тяжелое течение патологии.
В норме входящий в сарколемму миоцитов дистрофин обеспечивает ее целостность и устойчивость к растяжению, возникающему при сократительной активности мышечных волокон. Отсутствие дистрофина влечет за собой нарушение целостности сарколеммы, разрушение миоцитов и их замещение жировой и соединительной тканью. Клинически этот процесс выражается прогрессирующим снижением способности мышц к сокращению, утратой мышечной силы и тонуса, атрофией мышц.
Симптомы
Дебют миодистрофии Дюшенна приходится на период от 1 до 5 лет. Как правило, уже на 1-ом году жизни заметно некоторое отставание моторного развития ребенка. Отмечается задержка сроков начала сидения, самостоятельного вставания и ходьбы. Когда ребенок начинает ходить, он отличается неуклюжестью и большей, по сравнению со сверстниками, неустойчивостью; часто спотыкается.
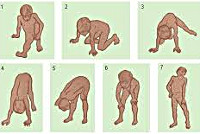
Мышечная слабость возникает на 3-4-ом годах жизни. Первоначально она выражается в патологически повышенной утомляемости при ходьбе по лестнице или на длинные расстояния. Со временем становится заметной типичная для миодистрофий утиная походка. Обращают на себя внимание особенности поведения ребенка — каждый раз, поднимаясь из положения сидя на корточках, он активно опирается руками о собственное тело, как бы взбираясь по нему как по лесенке (симптом Говерса).
Мышечные атрофии начинаются с мышц бедер и тазового пояса. Для дистрофии Дюшенна характерно их быстрое восходящее распространение на плечевой пояс, мускулатуру спины и проксимальных отделов рук. Вследствие мышечных атрофий формируется «осиная» талия и отстоящие от спины «крыловидные» лопатки. Типичным симптомом выступает псевдогипертрофия икроножных мышц. Наблюдается выпадение сухожильных рефлексов: вначале — коленных, затем — рефлексов с трицепса и бицепса плеча. Ахилловы и карпорадиальные рефлексы могут длительное время быть сохранны. Со временем развиваются ретракции сухожилий и мышечные контрактуры.
Прогрессирующая мышечная дистрофия Дюшенна сопровождается нарушениями в костно-суставной системе. Характерны искривление позвоночника (кифоз, усиленный лордоз, сколиоз), деформации грудной клетки (килевидная или седловидная), деформации стоп. Сердечно-сосудистые расстройства обусловлены развитием кардиомиопатии и включают аритмию, лабильность артериального давления, глухость тонов сердца. У 50% больных фиксируются нейроэндокринные расстройства — адипозогенитальная дистрофия, синдром Иценко-Кушинга и др. Около 30% больных страдает олигофренией, как правило, ограничивающейся степенью дебильности. Могут отмечаться СДВГ, расстройства по типу аутизма, дислексия, нарушения краткосрочной памяти.
Осложнения
Уже к 7-10-летнему возрасту дистрофия Дюшенна приводит к выраженным двигательным ограничениям. К 12 годам больные, как правило, утрачивают способность ходить, а к возрасту 15 лет большинство пациентов полностью теряют возможность самостоятельных движений. Распространение дистрофического процесса на дыхательную мускулатуру приводит к прогрессирующему падению жизненной емкости легких (ЖЕЛ) и, в конечном итоге, невозможности совершать дыхательные движения.
Диагностика
Установить диагноз миодистрофии Дюшенна помогает анамнез, неврологическое обследование, результаты электрофизиологического тестирования, определение креатинфосфокиназы (КФК) в биохимическом анализе крови, морфологическое и иммунохимическое исследование образцов мышечной ткани, генетическое консультирование и анализ ДНК:
При этом дифференциальную диагностику следует проводить с другими миопатиями — метаболической, воспалительной, миодистрофией Беккера, мышечной дистрофией Дрейфуса, дистрофией Эрба-Рота, а также с полиневропатиями, полимиозитом, БАС.
Лечение мышечной дистрофии Дюшенна
Стандартная терапия
Терапия, применяемая в клинической практике, включает симптоматическое и патогенетическое направление. В рамках данных направлений применяется медикаментозная терапия, физическая реабилитация, респираторная поддержка:
Экспериментальная терапия
Прогноз и профилактика
Профилактические мероприятия направлены на выявление женщин-носительниц аномального гена дистрофина и предупреждение рождения у них больного ребенка. В рамках профилактических мер проводятся консультации генетика для планирующих беременность супружеских пар, консультации беременных и пренатальная ДНК-диагностика.